| |
| Med Sci (Paris). 2015 March; 31(3): 250–253. Published online 2015 April 8. doi: 10.1051/medsci/20153103008.Amplification des centrioles Quand le centriole fils du centrosome prend le contrôle Adel Al Jord,1 Nathalie Spassky,1* and Alice Meunier1** 1Équipe biologie des cils et neurogenèse, École normale supérieure, Institut de biologie de l’ENS, CNRS UMR 8197, Inserm U1024, 46, rue d’Ulm, 75005Paris, France MeSH keywords: Animaux, Centrioles, Centrosome, Humains, Mitose, physiologie |
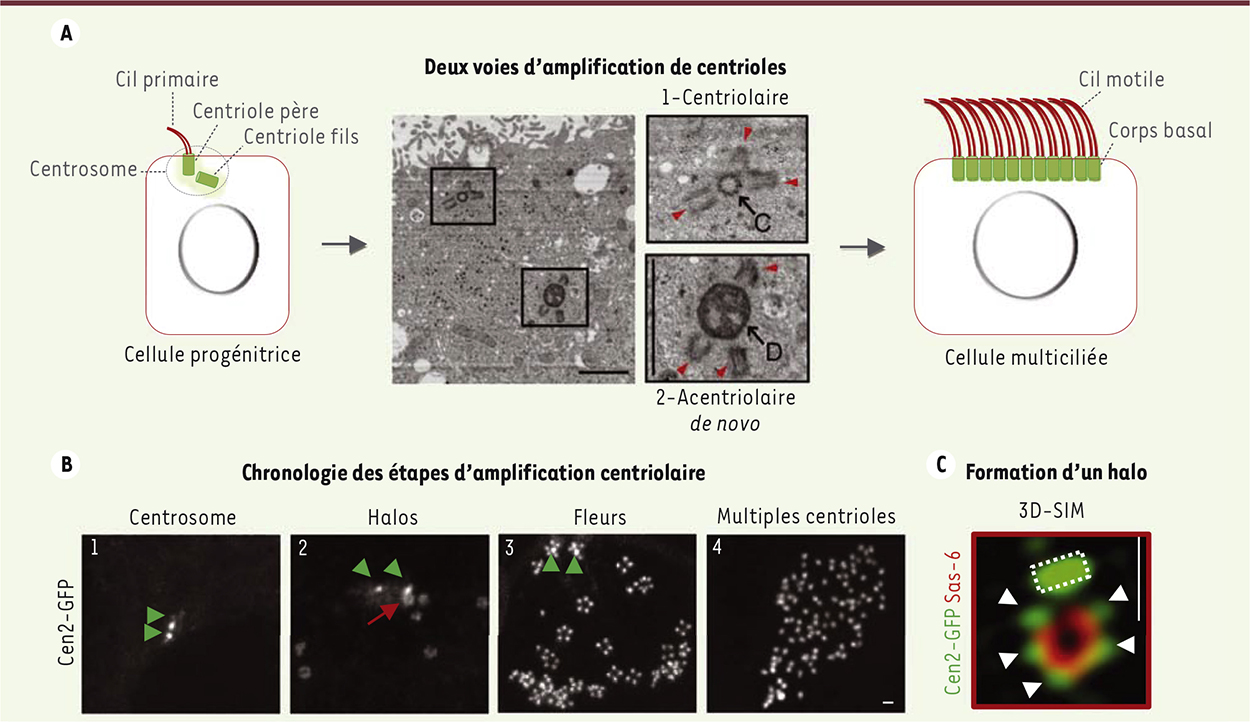
Chez les mammifères, les épithéliums multiciliés sont essentiels à la propulsion de certains fluides physiologiques. Dans le cerveau, les cils motiles des cellules épendymaires qui bordent les ventricules permettent l’écoulement du liquide céphalo-rachidien ; un dysfonctionnement de leur battement provoque des hydrocéphalies létales. Le battement orienté d’assemblées de cils motiles est également nécessaire dans d’autres organes comme l’épithélium respiratoire et l’oviducte, où il permet l’évacuation de mucus et le transport de l’œuf vers l’utérus, respectivement. Dans ces organes, des défauts de motilité ciliaire peuvent mener au développement de bronchiectasies, de grossesses extra-utérines et/ou à des problèmes d’infertilité [1, 2]. Contrairement à la plupart des cellules de mammifères qui possèdent un centrosome composé de deux centrioles, les cellules multiciliées possèdent une centaine de structures centriolaires, appelées corps basaux, qui sont ancrés à la membrane plasmique et servent de base à la nucléation des cils motiles1. Un des événements majeurs de la différenciation d’une cellule progénitrice en cellule multiciliée est donc la biogenèse massive de centrioles (Figure 1A). Deux voies parallèles d’amplification centriolaire ont été décrites. Dans la voie « acentriolaire », qui est majoritaire, les centrioles se forment sur des structures sphériques denses aux électrons, appelées deutérosomes. Dans cette voie, les centrioles sont considérés comme apparaissant « de novo », indépendamment des centrioles préexistants. Dans la voie « centriolaire », qui est minoritaire, les centrioles se forment directement à partir des centrioles du centrosome. Depuis la description de ces deux voies dans des études de microscopie électronique datant des années 1970 [3], l’origine des deuterosomes ainsi que l’interaction entre ces deux voies étaient restées inconnues.
 | Figure 1.
Voies et dynamique d’amplification de centrioles dans les cellules multiciliées. A. À gauche, schéma d’un progéniteur d’une cellule multiciliée possédant un centrosome composé d’un centriole père, qui nuclée un cil primaire, et d’un centriole fils. Panneau central, images en microscopie électronique à transmission qui montrent les deux voies d’amplification de centrioles présentes dans le progéniteur d’une cellule épendymaire multiciliée en cours de différenciation. Des procentrioles, indiqués par des têtes de flèches rouges, poussent sur un centriole du centrosome préexistant (C ; voie centriolaire), ou sur un deuterosome (D ; voie acentriolaire ou « de novo »). À droite, schéma d’une cellule dotée de multiples centrioles matures, ou corps basaux, servant à la nucléation des cils motiles. B. Images de vidéomicroscopie illustrant la chronologie des étapes d’amplification centriolaire au cours de la différenciation d’une cellule épendymaire multiciliée Cen2-GFP. Les 2 centrioles du centrosome sont indiqués par des têtes de flèches vertes. La flèche rouge indique un halo en cours de formation. C. Image de super-résolution 3D-SIM du bourgeonnement d’un halo Cen2-GFP composé de 5 procentrioles (têtes de flèches blanches), à partir d’un centriole du centrosome (rectangle en pointillé). Le marquage immunofluorescent Sas-6 (rouge) est spécifique des centrioles immatures. Barres d’échelle : 1 µm. |
|
L’amplification centriolaire débute dans la région centrosomale Afin de mettre au jour la dynamique d’amplification centriolaire, notre équipe a mis au point un système de culture permettant de visualiser en temps réel et en trois dimensions la différenciation de cellules souches neurales en cellules épendymaires multiciliées. L’observation de progéniteurs provenant de souris transgéniques exprimant la protéine centriolaire centrine 2 fusionnée à la GFP (Cen2-GFP, GFP : green fluorescent protein) a révélé un processus débutant dans la région centrosomale et marqué par deux étapes (Figure 1B). Au cours de la première étape, une dizaine de foyers de précurseurs Cen2-GFP, ou « halos », apparaissent séquentiellement dans la région centrosomale avant de s’accumuler plus profondément dans le cytoplasme. Au cours de la seconde étape, on observe une intensification progressive et collective du signal Cen2-GFP. L’ensemble des halos se transforment en structures organisées ressemblant à des fleurs. Ces « fleurs » se dissocient ensuite de façon synchronisée pour laisser apparaître de multiples centrioles qui migrent à la membrane apicale et nucléent des cils motiles. Afin de préciser la provenance des précurseurs centriolaires, nous nous sommes focalisés sur la région centrosomale en augmentant la résolution spatiotemporelle de nos expériences de vidéomicroscopie. De manière inattendue, nous avons observé que les halos bourgeonnent séquentiellement à partir d’un des centrioles du centrosome avant de se détacher pour s’accumuler dans le cytoplasme. L’utilisation d’un microscope à super-résolution (3D-structured illumination microscope, 3D-SIM) nous a permis de révéler qu’un halo est composé d’un assemblage sphérique de plusieurs procentrioles disposés d’une manière tridimensionnelle, à la façon d’une morula (Figure 1C). |
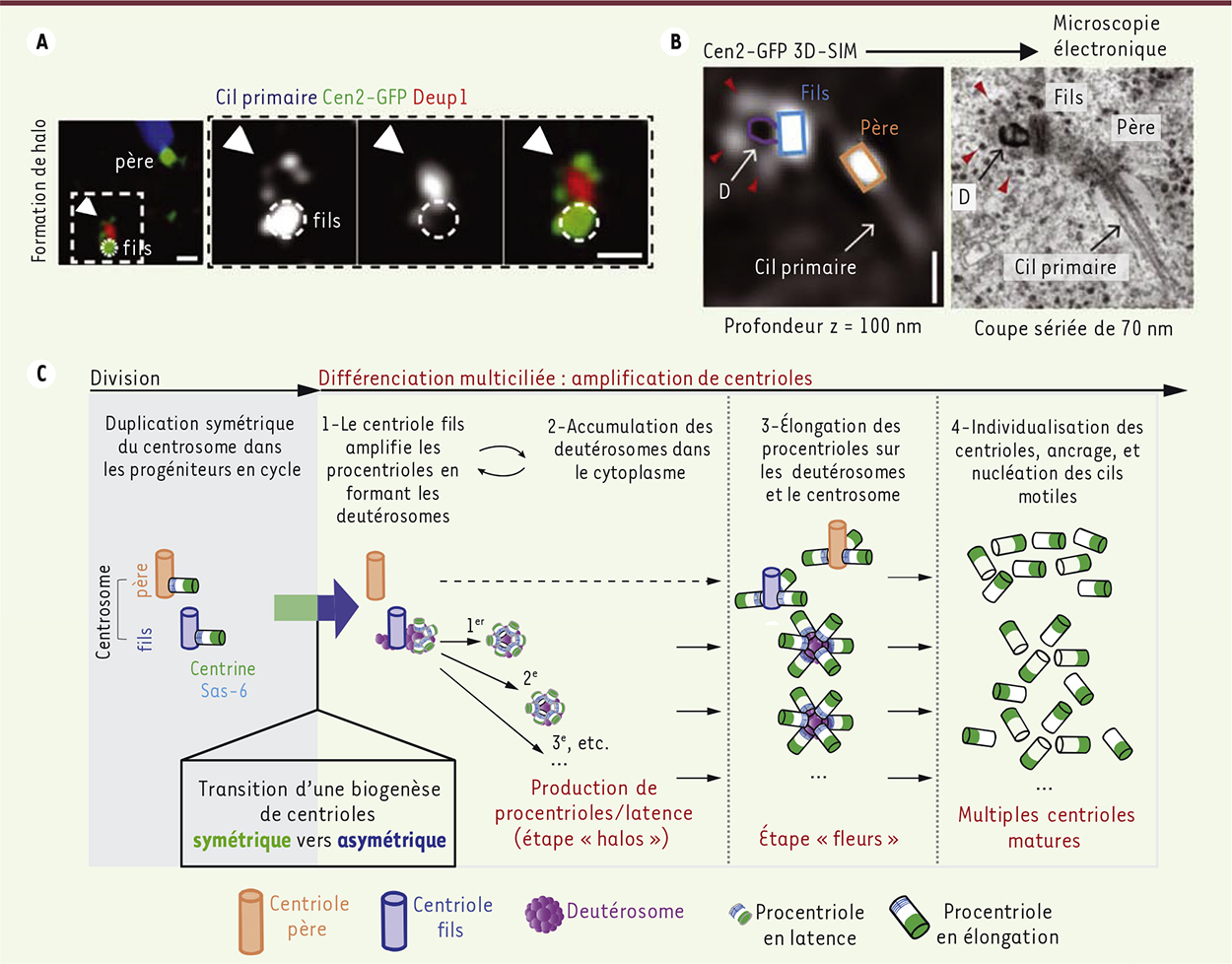
Le centriole fils du centrosome amplifie les procentrioles par l’intermédiaire de deuterosomes Pour évaluer la contribution de chaque centriole du centrosome à la formation des halos, nous avons distingué les centrioles père et fils en marquant le cil primaire (nucléé par le centriole père), et nous les avons observés par super-résolution. De façon inattendue, nous avons constaté que 100 % des halos se forment sur la partie proximale du centriole fils, mettant ainsi en évidence une asymétrie jusque-là inconnue des centrioles centrosomaux dans la biogenèse des centrioles. Afin de comprendre par quel processus le centriole fils du centrosome produit de nouveaux centrioles, nous avons marqué Deup1, une protéine impliquée dans la formation des deuterosomes [4] et connue pour recruter Cep152 et Plk4, protéines contrôlant les premières étapes de la nucléation des centrioles au cours de la duplication du centrosome dans les cellules en cycle. Alors qu’au cours de la duplication du centrosome dans les cellules progénitrices des cellules multiciliées Deup1, Cep152 et Plk4 sont distribuées symétriquement sur les deux centrioles centrosomaux, dans les cellules en cours de différenciation, ces protéines se distribuent de façon asymétrique en s’accumulant fortement au centriole fils (Figure 2A). Ces expériences suggérant que le centriole fils amplifie les centrioles en formant des deuterosomes, nous avons mis au point une technique permettant d’observer les mêmes cellules en super-résolution et en microscopie électronique à transmission (EM). Cette approche, qui permet d’accéder à l’ultrastructure des cellules, a permis de révéler que les halos en formation sur le centriole fils correspondent bien à des procentrioles émanant de deuterosomes en bourgeonnement (Figure 2B). Ces expériences ont ainsi révélé que le centriole fils du centrosome est le centre amplificateur des centrioles dans les cellules multiciliées. Elles réfutent par conséquent l’origine « de novo » des centrioles dans ces cellules.
 | Figure 2.
Le centriole fils du centrosome amplifie les procentrioles par l’intermédiaire de deutérosomes. A. À gauche, image en super-résolution 3D-SIM d’un centrosome Cen2-GFP marqué avec Deup1 (rouge), pendant la formation d’un halo indiqué par une tête de flèche blanche. Le centriole père est reconnu par la présence d’un cil primaire (bleu ; tubuline glutamylée). Panneau de droite : agrandissement du centriole fils. B. Images de microscopie corrélative 3D-SIM/microscopie électronique à transmission, qui montrent un halo en formation à partir du centriole fils. Le halo (gauche) correspond à des procentrioles émanant d’un deutérosome (D) en bourgeonnement (droite). Les têtes de flèches rouges indiquent les procentrioles. C. Modèle de biogenèse de centrioles dans les cellules multiciliées. Barres d’échelle : 0,5 µm. |
|
Les deux voies d’amplification centriolaire sont orchestrées par le centrosome Nous avons ensuite analysé la transition entre l’étape « halos » et l’étape « fleurs » par microscopie super-résolutive et microscopie électronique. Nous avons remarqué que pendant l’étape de « halos », tous les procentrioles ont une taille identique et sont immatures, indiquant la présence d’une phase de latence au cours de cette étape d’amplification par les deuterosomes. Toutefois, après la formation du dernier halo/deuterosome, la microscopie électronique nous a permis de voir que tous les procentrioles s’allongent et maturent simultanément sur l’ensemble des deuterosomes. Nous avons également constaté qu’au même moment, une dizaine de procentrioles s’allongent de façon orthogonale, directement à partir des portions proximales des centrioles centrosomaux, constituant ainsi la voie « centriolaire » décrite dans la bibliographie. Ainsi, nos expériences montrent qu’au cours de la différenciation des cellules multiciliées, les deux voies d’amplification « centriolaire » et « de novo » sont en fait une seule et même voie orchestrée par le centrosome (Figure 2C). |
Conclusion et perspectives Cette étude [5] montre que dans un contexte physiologique, le centrosome peut se dupliquer lorsqu’il est dans une cellule en division, mais également orchestrer une amplification massive de centrioles lorsqu’il est dans une cellule en cours de différenciation multiciliée. Le centriole fils du centrosome s’avère jouer un rôle clef dans la biogenèse des centrioles, en tout cas lorsque ceux-ci sont massivement amplifiés (Figure 2C). La mise en lumière de cette asymétrie du centrosome pourrait permettre de mieux appréhender l’amplification pathologique des centrioles associée aux microcéphalies [6] et aux tumeurs invasives [7–9]. Nous avons par ailleurs décrit une dynamique globale de différenciation dont la progression est phasique. L’amplification centriolaire est en effet marquée par des étapes distinctes et des transitions synchronisées (Figure 2C). De façon intéressante, des études émergentes soulignent l’implication des régulateurs de la phase S du cycle cellulaire dans l’amplification centriolaire des cellules multiciliées [10–12]. Le processus d’amplification centriolaire pourrait donc être vu, non plus comme un processus particulier aux cellules multiciliées, mais plus comme une facette de la duplication centriolaire dans laquelle la régulation spatiotemporelle du nombre de centrioles a été contournée. L’exploration des rôles potentiels d’autres régulateurs du cycle cellulaire pourrait contribuer à mieux comprendre les anomalies de la différenciation multiciliée observées dans certaines ciliopathies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Heintz N, Omran H. To beat or not to beat : roles of cilia in development and disease . Hum Mol Genet. 2003; ; 12 : :27.–35. 2.
Sharma N, Berbari N, Yoder B. Ciliary dysfunction in developmental abnormalities and diseases . Curr Topics Dev Biol. 2008; ; 85 : :371.–427. 3.
Anderson R, Brenner R. The formation of basal bodies (centrioles) in the rhesus monkey oviduct . J Cell Biol. 1971; ; 50 : :10.–34. 4.
Zhao H, Zhu L, Zhu Y, et al. The Cep63 paralogue Deup1 enables massive de novo centriole biogenesis for vertebrate multiciliogenesis . Nat Cell Biol. 2013; ; 15 : :1434.–1444. 5.
Al Jord A, Lemaitre AI, Delgehyr N, et al. Centriole amplification by mother and daughter centrioles differs in multiciliated cells . Nature. 2014;; 516 : :104.–107. 6.
Marthiens V, Rujano MA, Pennetier C, et al. Centrosome amplification causes microcephaly . Nat Cell Biol. 2013; ; 15 : :731.–740. 7.
Lingle WL, Barrett SL, Negron VC, et al. Centrosome amplification drives chromosomal instability in breast tumor development . Proc Natl Acad Sci USA. 2002; ; 99 : :1978.–1983. 8.
Ganem NJ, Godinho SA, Pellman D. A mechanism linking extra centrosomes to chromosomal instability . Nature. 2009; ; 460 : :278.–282. 9.
Godinho SA, Picone R, Burute M, et al. Oncogene-like induction of cellular invasion from centrosome amplification . Nature. 2014; ; 510 : :167.–171. 10.
Marcet B, Chevalier B, Luxardi G. Control of vertebrate multiciliogenesis by miR-449 through direct repression of the Delta / Notch pathway . Nat Cell Biol. 2011; ; 13 : :694.–701. 11.
Wang L, Fu C, Fan H, et al. miR-34b regulates multiciliogenesis during organ formation in zebrafish . Development. 2013; ; 140 : :2755.–2764. 12.
Ma L, Quigley I, Omran H, Kintner C. Multicilin drives centriole biogenesis via E2f proteins . Genes Dev. 2014; ; 28 : :1461.–1471. |