| |
| Med Sci (Paris). 2015 March; 31(3): 253–256. Published online 2015 April 8. doi: 10.1051/medsci/20153103009.Un nouvel outil pour le traitement de la myopathie de Duchenne : les tricyclo-ADN Aurélie Goyenvalle,1* Graziella Griffith,1 Aurélie Avril,1 Helge Amthor,1 and Luis Garcia1 1Université de Versailles St-Quentin, Inserm U1179, laboratoire Biothérapie des maladies du système neuromusculaire et LIA BAHN Centre scientifique de Monaco, 2, avenue de la Source de la Bièvre, 78180Montigny-le-Bretonneux, France MeSH keywords: Épissage alternatif, Animaux, Cognition, ADN, Thérapie génétique, Humains, Souris, Souris de lignée mdx, Activité motrice, Myopathie de Duchenne, Oligonucléotides antisens, Résultat thérapeutique, génétique, composition chimique, usage thérapeutique, méthodes, physiologie, physiopathologie, psychologie, thérapie |
Les maladies neuromusculaires regroupent un ensemble de plusieurs centaines de maladies, principalement d’origine génétique, définies par une perte de force par défaut de commande du muscle ou par destruction du tissu musculaire lui-même. Ces maladies diffèrent dans leurs causes, leur âge d’apparition, leur sévérité et leur évolution. Chacune de ces maladies est peu fréquente (maladies rares), mais conjointement, elles affectent plusieurs dizaines de milliers de personnes en France, constituant un enjeu majeur de santé publique et sociétal. La plus emblématique d’entre elles, la dystrophie musculaire de Duchenne (DMD), concerne un garçon sur 3 500 à la naissance ; ses spécificités génétiques et physiopathologiques en font un véritable cas d’école et un défi pour la conception et la mise au point de traitements pour des maladies où il faut traiter simultanément l’ensemble de la musculature squelettique, le cœur et, incidemment, le système nerveux central. |
Approche thérapeutique par saut d’exon Caractérisée depuis le milieu du xix
e siècle par un médecin français, Guillaume Benjamin Duchenne de Boulogne, cette myopathie très invalidante ne bénéficie encore d’aucun traitement satisfaisant. Un quart de siècle après l’identification du locus morbide DMD (gène codant la protéine dystrophine) par les équipes de L. Kunkel [1] et K. Davies [2], l’essor des recherches en biotechnologies laisse enfin entrevoir un espoir tangible de corriger certaines des anomalies du gène DMD par des approches de chirurgie de l’ARN (modulation sélective de l’épissage de l’ARNm de la dystrophine – saut d’exon) à l’aide d’oligonucléotides antisens (AON). Le principe de cette thérapie issue de la connaissance des gènes est fondée sur l’utilisation de petites séquences oligonucléotidiques antisens, capables de s’hybrider spécifiquement avec leurs ARN messagers cibles afin de moduler leur maturation et permettre la synthèse de la protéine manquante. Plusieurs études sont en cours avec différents AON modifiés, telles que les 2’O-méthyl phosphorothiate (2’OMe), ou encore les morpholinos (PMO) pour la synthèse des AON destinés à agir sur la production de dystrophine. Malgré les résultats encourageants de certains essais cliniques [3, 4], le bénéfice thérapeutique demeure difficile à démontrer du fait des limites des AON actuels : leur niveau de toxicité reste parfois élevé et leur distribution plutôt médiocre dans l’ensemble de la musculature après injection systémique. De plus, les AON existants sont incapables d’agir au niveau cardiaque ou de passer la barrière hémato-encéphalique, ce qui limite fortement leur potentiel thérapeutique. La conception d’un traitement qui soit efficace simultanément pour l’ensemble de la musculature squelettique, le cœur et le système nerveux central reste encore un défi. |
Une nouvelle génération d’oligonucléotides antisens Dans une publication récente résultant d’une collaboration internationale impliquant les universités de Versailles, Orsay, Berne, Oxford, l’institut de myologie, le Karolinska Institutet et la société Synthena, nous décrivons les propriétés très prometteuses de nouveaux nucléotides pour la synthèse des AON : les tricyclo-ADN (tcDNA) [5]. Les AON-tcDNA, analogues synthétiques de l’ADN, s’hybrident avec une très haute affinité avec leurs ARN pré-messagers cibles afin d’en moduler l’épissage et restaurer un cadre de lecture opérationnel éventuellement perturbé par une mutation [6, 7] (Figure 1). Dans le cas de la souris mdx (modèle murin de DMD), ils permettent la synthèse d’une dystrophine certes tronquée, mais suffisamment stable et fonctionnelle pour entraîner un bénéfice thérapeutique. En effet, après une douzaine d’injections intraveineuses (à raison d’une injection hebdomadaire) d’AON dirigés contre l’exon 23 (contenant une mutation non-sens) chez des souris mdx, nous avons pu démontrer que les AON-tcDNA sont plus performants que leurs équivalents des générations précédentes (efficacité supérieure en moyenne de 5 à 6 fois à celle des 2’OMe et PMO à une dose de 200 mg/kg/semaine, et de 3 à 4 fois avec un dosage équimolaire) [5].
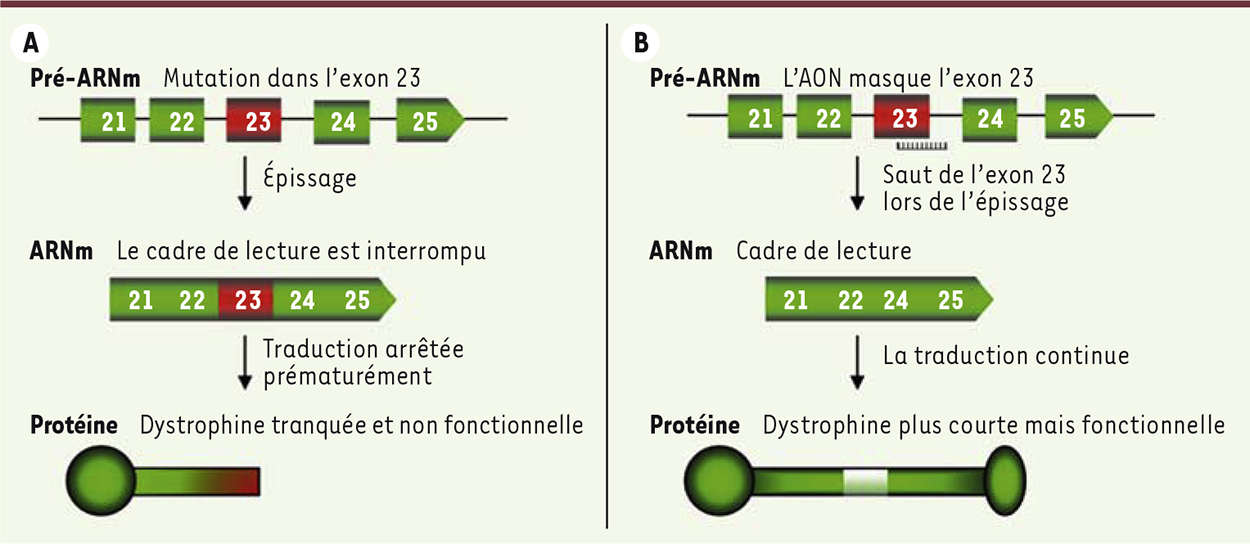
 | Figure 1.
Stratégie de réparation de la mutation de l’exon 23 par « saut d’exon ». A. Conséquences de la mutation sur la production de dystrophine. B. Mécanisme d’action de l’AON. AON : oligonucléotide antisens. |
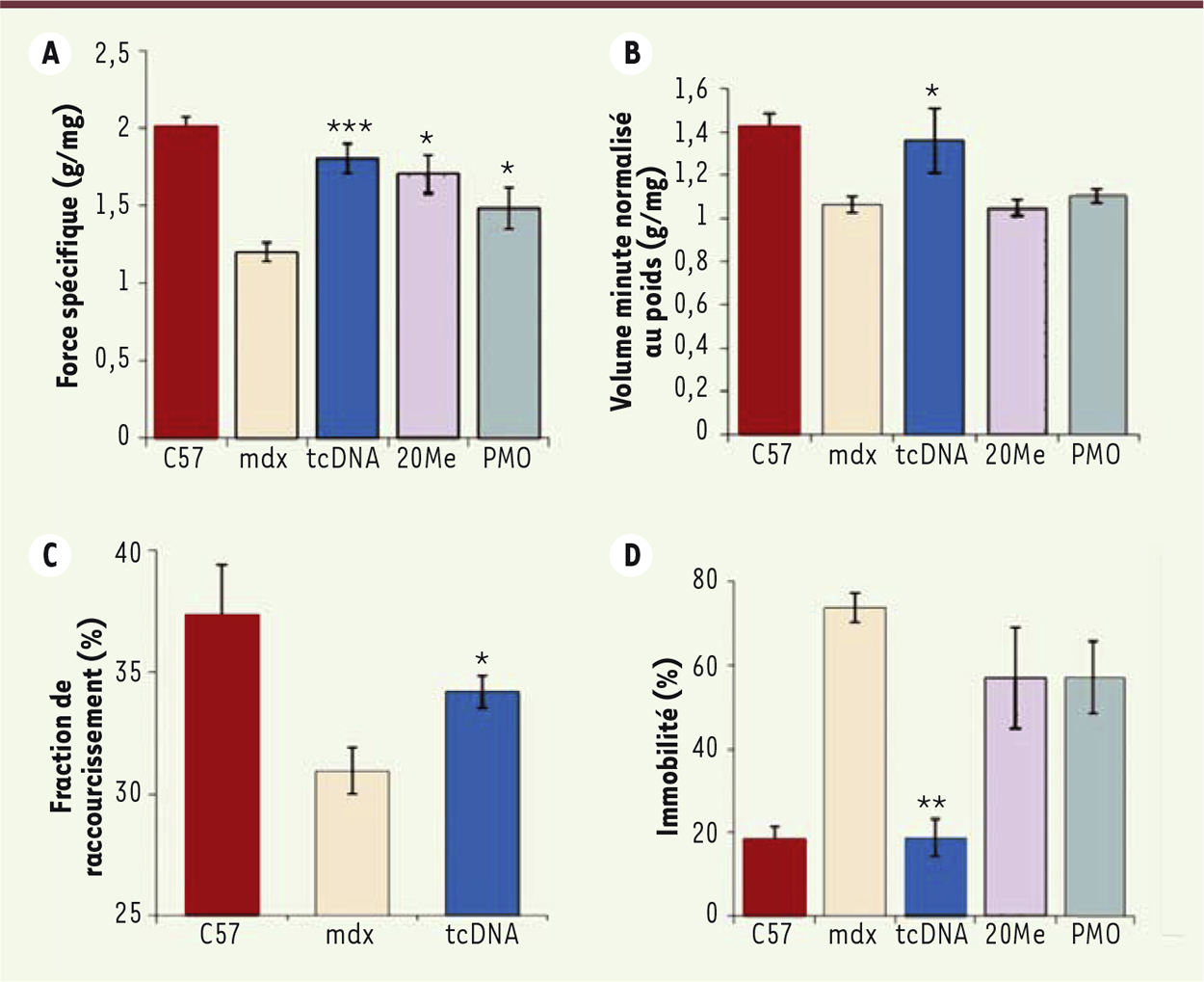
Les tcDNA se distribuent efficacement à l’ensemble de la musculature squelettique et permettent une restauration de dystrophine se traduisant par une amélioration significative de la fonction musculaire évaluée par la mesure de la force spécifique (Figure 2A). Nous nous sommes également intéressés à la fonction cardio-respiratoire puisque l’amélioration de ces paramètres représente une condition indispensable pour espérer un bénéfice thérapeutique chez les patients DMD. Chez ces patients en effet, les insuffisances respiratoire et cardiaque sont une des causes majeures du décès [8]. Les souris mdx ont un diaphragme particulièrement dystrophique, ce qui crée un dysfonctionnement respiratoire. Celui-ci est mesurable en pléthysmographie sur corps entier, et l’un des paramètres affectés en particulier est le volume-minute normalisé par rapport au poids corporel (MV/BW). Ce paramètre MV/BW est significativement amélioré chez les souris mdx traitées par les AON-tcDNA, avec une ré-expression de dystrophine d’environ 50 % dans le diaphragme des animaux, démontrant une restauration de leur capacité respiratoire (Figure 2B). De façon remarquable, les tcDNA sont également capables d’induire un saut d’exon efficace dans le cœur des souris traitées, conduisant à une amélioration de la fonction cardiaque mesurée par la fraction de raccourcissement1, ce qui représente un avantage majeur comparé aux AON actuellement utilisés en clinique (Figure 2C).
 | Figure 2.
Restauration des fonctions musculaire, respiratoire, cardiaque et émotionnelle chez les souris mdx après injections intraveineuses de tcDNA, 2’OMe ou PMO ciblant l’exon 23 de la dystrophine murine. Mesure de la force spécifique (A), du volume minute normalisé au poids par pléthysmographie (B), de la fraction de raccourcissement par échocardiographie (C) et du pourcentage d’immobilité suite à un stress reflétant la réponse émotionnelle (D). Barres d’erreur ± SEM ; ***p < 0.001, **p < 0.01 and *p < 0.05 par rapport aux souris contrôles mdx. |
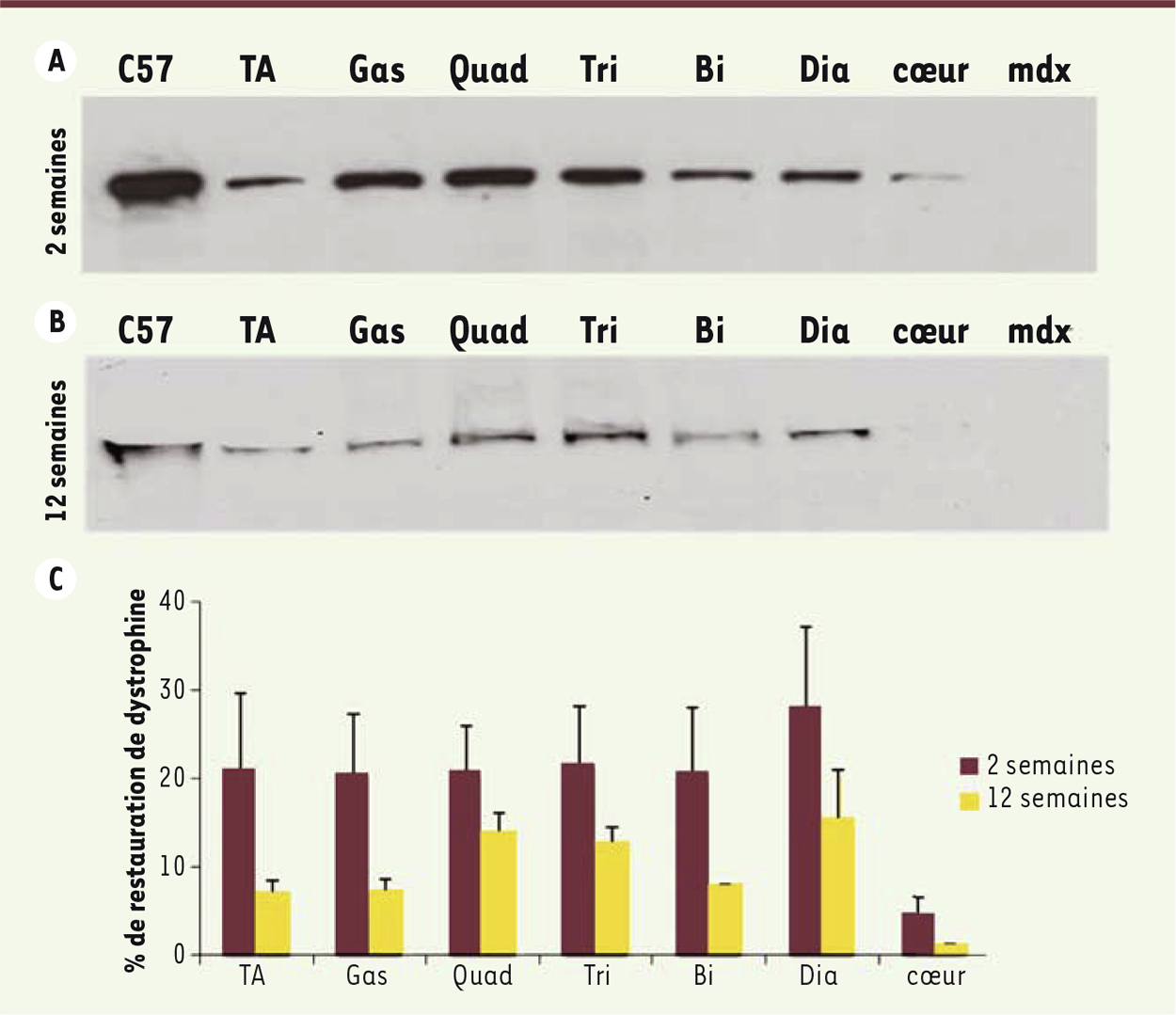
Dans ce travail, nous avons aussi mis en évidence une correction des réponses émotionnelles naturellement exacerbées, qui peuvent être liées à des difficultés d’apprentissage, voire parfois des défauts cognitifs chez les sujets dystrophiques (Figure 2D) [9]. Cette partie de l’étude, menée en collaboration avec une équipe de l’Institut des neurosciences Paris Saclay (CNRS/Université Paris-Sud), démontre que la forme Dp427 de la dystrophine est cruciale pour le bon fonctionnement de certains neurones, et que les problèmes comportementaux observés lorsqu’il y a un déficit de cette protéine sont au moins partiellement réversibles chez la souris dystrophique adulte. Enfin, nous avons démontré le potentiel thérapeutique des AON-tcDNA dans un modèle murin présentant un phénotype dystrophique beaucoup plus sévère que celui de la souris mdx [10] (souris doublement invalidée [dKO] pour la dystrophine et l’utrophine, dys-/utr-). En effet, la souris dKO est caractérisée par une forte scoliose, une activité motrice extrêmement limitée et une durée de vie réduite. Comme dans le modèle mdx, l’injection récurrente d’AON-tcDNA permet une amélioration très significative du phénotype dystrophique en général : restauration de dystrophine dans l’ensemble de la musculature squelettique, y compris dans le cœur, et augmentation importante des fonctions musculaires et motrices chez les souris traitées. Une propriété particulièrement intéressante des AON-tcDNA est qu’ils persistent relativement longtemps dans les tissus tout en étant fonctionnels (Figure 3), permettant à terme d’espacer les traitements. D’autre part, bien que les AON-tcDNA ne soient pas dégradés dans l’organisme, ils sont toutefois évacués progressivement, assurant la réversibilité possible du traitement. Les analyses toxicologiques complémentaires sont en cours, et les premiers résultats semblent indiquer que ces nouveaux AON sont bien tolérés à fortes doses chez la souris.
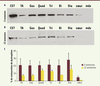 | Figure 3.
Persistance du saut d’exon dans les tissus de souris traitées par les tcDNA.
Western blot sur protéines totales extraites des tissus de souris traitées par les tcDNA pendant 4 semaines (200mg/kg/semaine) et analysées 2 semaines (A) ou 12 semaines (B) après la fin du traitement. (C57 : souris sauvage, tibialis anterior: TA, gastrocnemius : Gas, quadriceps femoris : Quad, triceps brachialis : Tri, biceps brachialis : Bi, diaphragm : Dia). |
|
Perspectives en thérapeutique humaine À ce jour, les mécanismes sous-tendant l’efficacité de ces AON de troisième génération sont encore mal compris. Hormis leur très forte affinité pour l’ARN, leur efficacité pourrait être en partie liée à leur capacité à former spontanément des agrégats de type « nanoparticules » supposés mimer l’effet de certains agents transfectants. Quoiqu’il en soit, cette nouvelle génération d’AON compatibles avec un traitement systémique et accédant à l’ensemble des compartiments de l’organisme, y compris le système nerveux central, ouvre des perspectives vers de nombreuses applications thérapeutiques, et en particulier pour les maladies génétiques du système neuromusculaire. Enfin, ces travaux confortent le rationnel de l’approche de « saut d’exon » dans le cadre de la myopathie de Duchenne, pour laquelle une grande majorité de patients est théoriquement éligible. Il est toutefois important de souligner que la mise en application de ces traitements, en particulier pour les mutations singulières ou pour les cohortes de patients extrêmement petites, se heurtera aux coûts de développement des différents oligonucléotides antisens qu’il conviendra de considérer à juste titre comme des médicaments différents. Aussi, sans une réflexion éthique et un accompagnement réglementaire appropriés, on peut craindre que certaines applications possibles et rationnelles soient abandonnées faute de débouchés économiques suffisants, générant de graves inégalités et désillusions au sein des populations de malades. |
Luis Garcia déclare avoir des liens durables avec l’entreprise Synthena qui produit les tricyclo-ADN.
Les autres auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Koenig M, Hoffman EP, Bertelson CJ, et al. Complete cloning of the Duchenne muscular dystrophy (DMD) cDNA and preliminary genomic organization of the DMD gene in normal and affected individuals . Cell. 1987;; 50 : :509.–517. 2.
Kenwrick S, Patterson M, Speer A, et al. Molecular analysis of the Duchenne muscular dystrophy region using pulsed field gel electrophoresis . Cell. 1987;; 48 : :351.–357. 3.
Goemans NM, Tulinius M, van den Akker JT, et al. Systemic administration of PRO051 in Duchenne’s muscular dystrophy . N Engl J Med. 2011;; 364 : :1513.–1522. 4.
Cirak S, Arechavala-Gomeza V, Guglieri M, et al. Exon skipping and dystrophin restoration in patients with Duchenne muscular dystrophy after systemic phosphorodiamidate morpholino oligomer treatment: an open-label, phase 2, dose-escalation study . Lancet. 2011;; 378 : :595.–605. 5.
Goyenvalle A, Griffith G, Babbs A, et al. Functional correction in mouse models of muscular dystrophy using exon-skipping tricyclo-DNA oligomers . Nat Med. 2015;; 21 : :270.–275. 6.
Renneberg D, Bouliong E, Reber U, et al. Antisense properties of tricyclo-DNA . Nucleic Acids Res. 2002;; 30 : :2751.–257. 7.
Renneberg D, Leumann CJ. Watson-Crick base-pairing properties of tricyclo-DNA . J Am Chem Soc. 2002;; 124 : :5993.–6002. 8.
Kohler M, Clarenbach CF, Boni L, et al. Quality of life, physical disability, and respiratory impairment in Duchenne muscular dystrophy . Am J Respir Crit Care Med. 2005;; 172 : :1032.–1036. 9.
Perronnet C, Vaillend C. Dystrophins, utrophins, and associated scaffolding complexes: role in mammalian brain and implications for therapeutic strategies . J Biomed Biotechnol. 2010;; 2010 : :849426.. 10.
Deconinck AE, Rafael JA, Skinner JA, et al. Utrophin-dystrophin-deficient mice as a model for Duchenne muscular dystrophy . Cell. 1997;; 90 : :717.–727. |