| |
| Med Sci (Paris). 2015 May; 31(5): 465–468. Published online 2015 June 9. doi: 10.1051/medsci/20153105002.Le récepteur HER3 ou ERBB3 La face cachée de la planète ERBB Christel Larbouret,1,2,3,4** Nadège Gaborit,5 Marie-Alix Poul,1,2,3,4 André Pèlegrin,1,2,3,4 and Thierry Chardès1,2,3,4* 1IRCM, institut de recherche en cancérologie de Montpellier, 208, rue des Apothicaires, F-34298, Montpellier, France 2Inserm U1194, F-34298, France 3Université de Montpellier, Montpellier, F-34090, Montpellier, France 4Institut régional du cancer de Montpellier, F-34298, Montpellier, France 5Department of biological regulation, Weizmann Institute of Science, Rehovot, 76100, Israël MeSH keywords: Animaux, Anticorps monoclonaux, Antinéoplasiques, Protocoles de polychimiothérapie antinéoplasique, Tests de criblage d'agents antitumoraux, Récepteurs ErbB, Humains, Thérapie moléculaire ciblée, Famille multigénique, Mutation, Protéines tumorales, Tumeurs, Phosphorylation, Inhibiteurs de protéines kinases, Maturation post-traductionnelle des protéines, Récepteur ErbB-3, Transduction du signal, Ubiquitinylation, usage thérapeutique, génétique, physiologie, antagonistes et inhibiteurs, traitement médicamenteux, enzymologie, effets des médicaments et substances chimiques |
Lors de la découverte du facteur de croissance épidermique (EGF), Rita Levi-Montalcini et Stanley Cohen n’imaginaient pas que cette recherche, dont ils étaient les initiateurs, ouvrirait la voie, 60 ans plus tard, à une révolution dans le domaine de l’oncologie thérapeutique. Ce facteur de croissance EGF appartient à un ensemble de molécules qui stimulent quatre récepteurs transmembranaires à domaine tyrosine kinase (RTK) de la famille ERBB (EGFR, HER2, HER3 et HER4). Ces molécules contrôlent le cycle cellulaire et l’apoptose des cellules tumorales, et régulent la survie, la prolifération, l’angiogenèse et le métabolisme tumoral [1]. Après fixation du facteur de croissance, ces récepteurs sont essentiellement actifs sous forme de dimères, dont le niveau d’expression et la composition jouent un rôle dans la diversification des signaux intracellulaires activés et dans le potentiel carcinogène. La multiplicité des récepteurs au sein de la famille ERBB permet une plasticité dans la dimérisation des récepteurs, qui assure une adaptation du signal tumoral, activant des voies de signalisation différentes en fonction du type de ligand, du niveau de stimulation, de la densité de récepteurs, du type cellulaire ou de la thérapie ciblée utilisée [2]. Aujourd’hui, les thérapies ciblant la famille ERBB ont une place incontournable dans l’arsenal thérapeutique en cancérologie, qu’il s’agisse d’inhibiteurs de tyrosine kinases (TKI) ou d’anticorps monoclonaux (Acm), tels que le cétuximab ou le panitumumab (anti-EGFR), le trastuzumab ou le pertuzumab (anti-HER2)1 [19]. Le récepteur HER3, qui possède une activité kinase 1 000 fois plus faible que les autres récepteurs de la famille ERBB, a longtemps été délaissé comme cible thérapeutique, bien que jouant un rôle majeur dans la plasticité/adaptabilité de la signalisation oncogénique. |
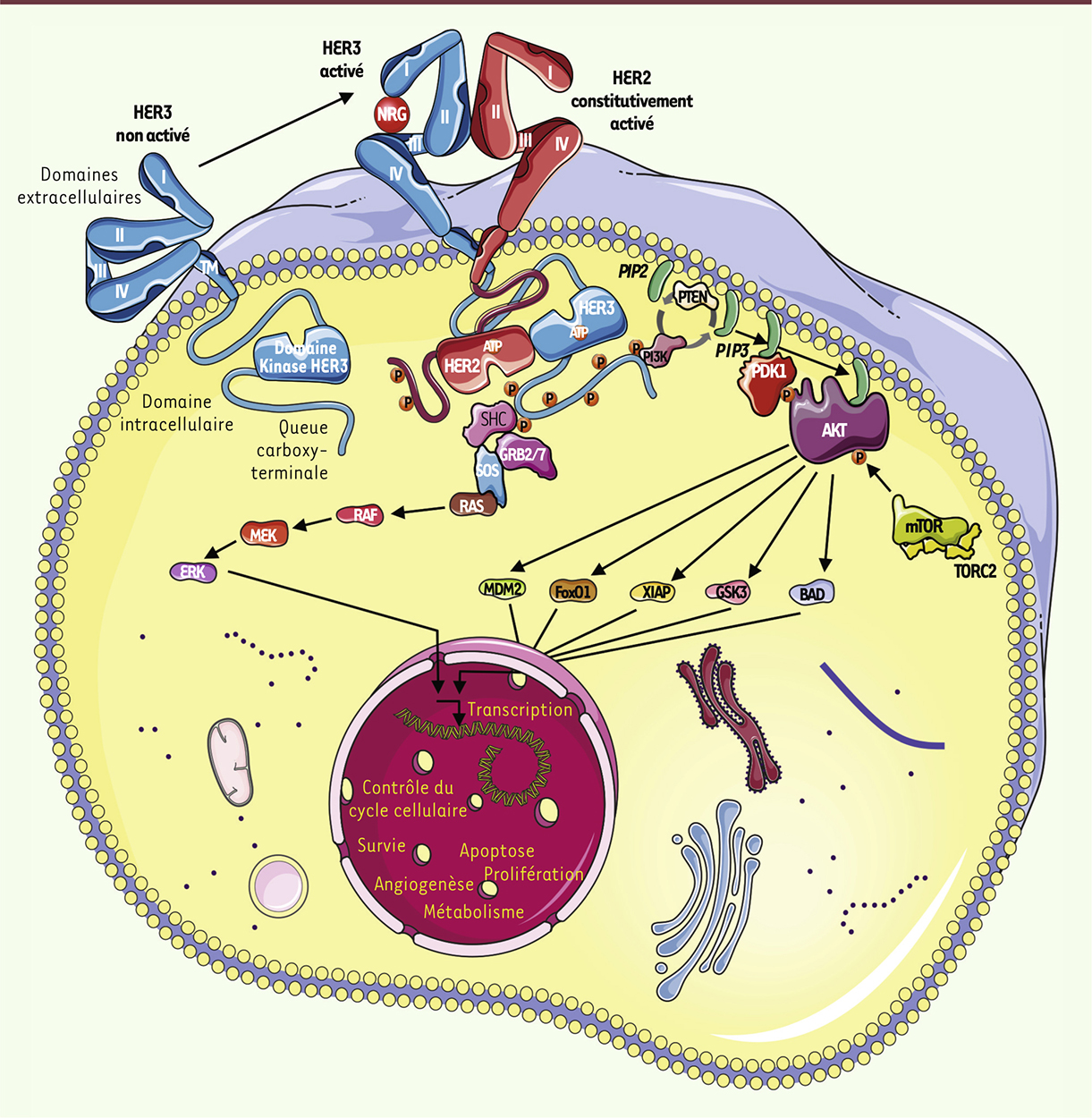
Repenser le récepteur HER3 comme cible thérapeutique En réponse à la liaison des facteurs de croissance neurégulines (NRG), le récepteur HER3 subit un changement conformationnel permettant sa dimérisation avec les autres récepteurs de la famille ERBB. Ce phénomène conduit à l’activation allostérique de chaque partenaire de dimérisation par l’autre partenaire, permettant ainsi la trans-phosphorylation des deux récepteurs et l’activation des voies de signalisation majeures RAS/RAF/MEK/ERK et PI3K/AKT/mTOR (Figure 1). Dans ce cadre, les hétérodimères EGFR/HER3 et HER2/HER3 constituent les unités fonctionnelles de signalisation oncogénique les plus efficaces, car le récepteur HER3 est le plus puissant activateur de la sous-unité p85 de la PI3K, par l’intermédiaire des six tyrosines phosphorylables dans son domaine intracellulaire (Figure 1) [1]. Le récepteur HER3 a tout d’abord été associé à la tumorigenèse parce qu’il promeut les voies de signalisation oncogéniques via EGFR et HER2. Ainsi, HER3 est généralement activé dans les cancers du sein caractérisés par l’amplification de HER2, alors que son élimination par interférence ARN bloque la croissance tumorale [3].
 | Figure 1.
Structure, mécanisme d’activation et signalisation via le récepteur HER3.
|
Des mutations somatiques de HER3, identifiées récemment dans le cancer du côlon, le cancer gastrique et quelques cas de cancer du sein [4], nous obligent à reconsidérer l’intérêt du récepteur HER3 comme cible thérapeutique directe. En effet, la plupart de ces mutations se situent dans le domaine extracellulaire et confèrent un potentiel oncogénique à la molécule. L’activation du récepteur HER3 dépendante de la NRG intervient dans certains cancers, soit par une boucle autocrine mise en évidence dans le cancer de l’ovaire [5], le cancer de la tête et du cou sans amplification de HER2 [6] ou le cancer colorectal [7], soit par une boucle paracrine de sécrétion via les fibroblastes du microenvironnement dans le cancer du pancréas [8]. Enfin, la résistance à la « pression » exercée par des inhibiteurs des récepteurs EGFR ou HER2 (anticorps ou TKI) ou d’autres récepteurs tels que Met [20] ou IGFR1 (insulin growth factor receptor), par des inhibiteurs de PI3K, MEK ou BRAF, par la chimiothérapie ou l’hormonothérapie, fait intervenir un rétrocontrôle activant le récepteur HER3 et les voies de signalisation sous-jacentes [9]. Dans la plupart de ces scénarios, l’association d’inhibiteurs comodulant la cible principale, support de la résistance thérapeutique, et le récepteur HER3, support de l’échappement thérapeutique, selon un schéma de traitement concomitant ou séquentiel, constitue certainement une solution thérapeutique d’avenir. |
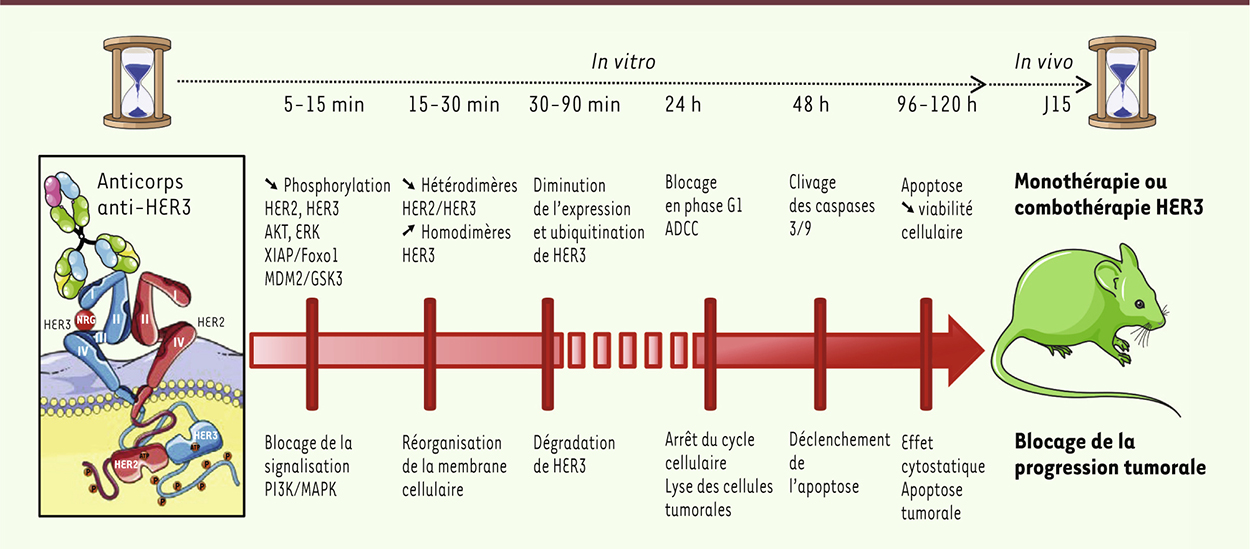
Produire et caractériser des Acm anti-HER3 L’activité kinase faible du récepteur HER3 constitue une limite au développement de TKI ciblant directement HER3, mais laisse la porte ouverte aux thérapies ciblées à base d’Acm anti-HER3. Ainsi, des Acm ciblant HER3 sont actuellement en phase clinique [10], la plupart entrant en compétition avec la NRG. Nous avons produit et caractérisé des Acm humains ou murins qui reconnaissent des épitopes localisés au niveau des domaines extracellulaires D1, D3 et D4 de HER3, et dont certains n’entrent pas en compétition avec la NRG et induisent un effet allostérique sur le récepteur HER3 [11, 12]. In vitro, ces Acm anti-HER3 inhibent très rapidement la phosphorylation des récepteurs HER2 et HER3, et des kinases AKT et ERK dans des lignées de cancer du pancréas et de cancer du sein. L’inhibition de la phosphorylation d’AKT se traduit par un blocage sous-jacent de la phosphorylation de MDM2 (murine double minute 2), qui régule l’activité de p53, de XIAP (X-linked inhibitor of apoptosis protein) et FoxO1 (forkhead box protein O1), modulant l’apoptose, et de GSK3 (glycogen synthase kinase 3), qui joue un rôle dans le cycle cellulaire [11] (Figure 2). Une modification de la membrane cellulaire des cellules tumorales est observée très précocement après traitement par les Acm anti-HER3, avec une diminution des hétérodimères HER2/HER3 et une augmentation des homodimères HER3, qui sont des impasses de signalisation [13, 14]. Puis une ubiquitination du récepteur HER3, qui implique des E3 ubiquitine ligases telles que NRDP1 et NEDD4 (neural precursor cell expressed developmentally down-regulated protein 4), conduit à la dégradation du récepteur [10, 12]. Le traitement par les Acm anti-HER3 se traduit ensuite par des effets directs sur le cycle cellulaire (blocage en phase G1), l’induction d’apoptose dépendante de caspases, et la viabilité cellulaire des cellules tumorales ; il induit aussi des effets indirects de lyse des cellules tumorales par mobilisation du système immunitaire via le mécanisme d’ADCC (antibody-dependent cell-mediated cytotoxicity) (Figure 2). In vivo, ces divers effets biologiques ralentissent la progression tumorale dans des modèles de souris immunodéficientes porteuses de tumeurs humaines de type carcinome pancréatique ou cancer du sein de type basal-like, et traitées en monothérapie par des Acm anti-HER3.
 | Figure 2.
Mécanismes d’action des anticorps anti-HER3. Combothérapie : combinaison d’anticorps utilisée en thérapeutique. |
|
Anticorps anti-HER3 : vers une stratégie combinatoire pour une meilleure efficacité En oncologie, les associations thérapeutiques sont la règle car elles permettent d’optimiser les réponses thérapeutiques tout en permettant de traiter un plus grand nombre de patients. Adopter une stratégie combinatoire à l’aide d’anticorps mono- ou bi-spécifiques anti-ERBB pour optimiser le blocage de plusieurs voies de signalisation et outrepasser de possibles résistances est la clé d’une meilleure efficacité. Nous avons déjà montré que l’association du cétuximab (anti-EGFR) avec le trastuzumab (anti-HER2 ciblant le domaine IV) induit une synergie thérapeutique efficace chez des souris immunodéficientes porteuses de carcinome pancréatique humain [15]. La combinaison cétuximab/trastuzumab est plus efficace que le lapatinib, TKI comodulant EGFR et HER2 [16], ou la gemcitabine, chimiothérapie antimétabolite de référence dans le carcinome pancréatique [17]. Un premier essai clinique (NCT00923299) d’association cétuximab/trastuzumab, administrée en seconde ligne chez 33 patients atteints de carcinome pancréatique progressant sous gemcitabine, a conduit à une stabilisation de la maladie chez 27 % des patients, avec une corrélation significative entre la toxicité cutanée et la survie sans progression [18]. Cette stratégie combinatoire a été confirmée et amplifiée chez des souris immunodéficientes greffées avec un carcinome pancréatique, traitées par l’association de pertuzumab (anti-HER2 ciblant le domaine II) avec un anticorps anti-HER3 allostérique, n’entrant pas en compétition avec la NRG [14]. La combinaison pertuzumab/anticorps anti-HER3 est plus efficace que le pertuzumab utilisé seul ou associé au trastuzumab sur le blocage de la progression tumorale (Figure 2). Une association de six anticorps ciblant EGFR, HER2 et HER3 est actuellement en phase préclinique dans le cancer du pancréas2,. Ces stratégies de combinaison se traduisent par une meilleure efficacité dans la désorganisation des hétérodimères EGFR/HER3 et/ou HER2/HER3, par un blocage accru et persistant de la signalisation RAS/RAF/MEK/ERK et PI3K/AKT/mTOR, par l’amplification de la dégradation des récepteurs ERBB ciblés et par l’amélioration de l’ADCC [12, 14, 16]. |
Conclusions et perspectives : il faut se méfier de l’eau qui dort Longtemps face cachée et oubliée de la « planète » ERBB, le récepteur HER3, en dépit d’une activité kinase très faible, s’avère être d’un intérêt thérapeutique grandissant en oncologie. Transformer cet intérêt en succès ne se fera que si diverses notions de biologie systémique sont intégrées dans la démarche. Tout d’abord, la famille ERBB doit être considérée comme un réseau biologique interconnecté qui évolue en fonction des perturbations. Puisque la fréquence de mutations au cours de l’évolution est relativement faible, ce réseau biologique ERBB est particulièrement bien adapté pour répondre à une perturbation, mais est plus fragile face à deux ou plusieurs perturbations simultanées [2]. Ce principe plaide en faveur de la combinaison d’anticorps ciblant à la fois des récepteurs très exprimés (tels que EGFR ou HER2) et des récepteurs faiblement exprimés (comme HER3) mais régulateurs du réseau biologique ERBB. Par ailleurs, il est essentiel de disposer de biomarqueurs, tels que l’expression de la NRG ou des hétérodimères de récepteurs, pour prédire l’efficacité de la thérapie anti-HER3 et permettre de sélectionner les patients éligibles à ce traitement. Enfin, continuons de nous méfier de l’eau qui dort, un récepteur ERBB peut en cacher un autre… |
Christel Larbouret, Marie-Alix Poul, André Pèlegrin et Thierry Chardès déclarent avoir participé à des interventions ponctuelles (collaboration pour des travaux scientifiques) avec les sociétés Roche, LFB, CisBio, MilleGen et GamaMabs. Nadège Gaborit déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient les Drs Yassamine Lazrek, Gaelle Thomas et Christophe Le Clorennec pour leur contribution aux travaux de l’équipe auquel il est fait référence dans cet article, et Véronique Garambois, Geneviève Heintz, Sabine Bousquié et toute l’équipe de l’animalerie de l’IRCM pour leur assistance technique. Ces travaux ont été financés par la Ligue contre le cancer, le cancéropôle GSO, le programme FUI13 UmAbHER3 (BPI France), le SIRIC Montpellier Cancer, Inserm transfert et le LabEx MAbImprove ANR-10-LABX-53-01.
|
Footnotes |
1.
Roskoski Jr R. The ErbB/HER family of protein-tyrosine kinases and cancer . Pharmacol Res. 2014; ; 79 : :34.–74. 2.
Yarden Y, Pines G. The ERBB network: at last, cancer therapy meets systems biology . Nat Rev Cancer. 2012; ; 12 : :553.–563. 3.
Lee-Hoeflich ST, Crocker L, Yao E, et al. A central role for HER3 in HER2-amplified breast cancer: implications for targeted therapy . Cancer Res. 2008; ; 68 : :5878.–5887. 4.
Jaiswal BS, Kljavin NM, Stawiski EW, et al. Oncogenic ERBB3 mutations in human cancers . Cancer Cell. 2013; ; 23 : :603.–617. 5.
Sheng Q, Liu X, Fleming E, et al. An activated ErbB3/NRG1 autocrine loop supports in vivo proliferation in ovarian cancer cells . Cancer Cell. 2010; ; 17 : :298.–310. 6.
Wilson TR, Lee DY, Berry L, et al. Neuregulin-1-mediated autocrine signaling underlies sensitivity to HER2 kinase inhibitors in a subset of human cancers . Cancer Cell. 2011; ; 20 : :158.–172. 7.
Yonesaka K, Zejnullahu K, Okamoto I, et al. Activation of ERBB2 signaling causes resistance to the EGFR-directed therapeutic antibody cetuximab . Sci Transl Med. 2011; ; 3 : :99.ra86. 8.
Liles JS, Arnoletti JP, Kossenkov AV, et al. Targeting ErbB3-mediated stromal-epithelial interactions in pancreatic ductal adenocarcinoma . Br J Cancer. 2011; ; 105 : :523.–533. 9.
Arteaga CL, Engelman JA. ERBB receptors: from oncogene discovery to basic science to mechanism-based cancer therapeutics . Cancer Cell. 2014; ; 25 : :282.–302. 10.
Mujoo K, Choi BK, Huang Z, et al. Regulation of ERBB3/HER3 signaling in cancer . Oncotarget. 2014; ; 5 : :10222.–10236. 11.
Lazrek Y, Dubreuil O, Garambois V, et al. Anti-HER3 domain 1 and 3 antibodies reduce tumor growth by hindering HER2/HER3 dimerization and AKT-induced MDM2, XIAP and FoxO1 phosphorylation . Neoplasia. 2013; ; 15 : :335.–347. 12.
Gaborit N, Abdul-Hai A, Mancini M, et al. Examination of HER3 targeting in cancer using monoclonal antibodies . Proc Natl Acad Sci USA. 2015; ; 112 : :839.–844. 13.
Gaborit N, Larbouret C, Vallaghe J, et al. Time resolved fluorescence resonance energy transfer (TR-FRET) to analyze the disruption of EGFR/HER2 dimers: a new method to evaluate the efficiency of targeted therapy using monoclonal antibodies . J Biol Chem. 2011; ; 283 : :11337.–11345. 14.
Thomas G, Chardès T, Gaborit N, et al. HER3 expression as a predictive biomarker of the efficacy of pertuzumab in pancreatic cancer . Oncotarget. 2014; ; 5 : :7138.–7148. 15.
Larbouret C, Robert B, Navarro-Teulon I, et al. In vivo therapeutic synergism of anti-epidermal growth factor receptor and anti-HER2 monoclonal antibodies against pancreatic carcinomas . Clin Cancer Res. 2007; ; 13 : :3356.–3362. 16.
Larbouret C, Gaborit N, Chardès T, et al. In pancreatic carcinoma, dual EGFR/HER2 targeting with cetuximab/trastuzumab is more effective than treatment with trastuzumab/erlotinib or lapatinib alone: implication of receptors down-regulation and dimers disruption . Neoplasia. 2012; ; 14 : :121.–130. 17.
Larbouret C, Robert B, Bascoul-Mollevi C, et al. Combined cetuximab and trastuzumab are superior to gemcitabine in the treatment of human pancreatic carcinoma xenografts . Ann Oncol. 2010; ; 21 : :98.–103. 18.
Assenat E, Azria D, Mollevi C, et al. Dual targeting of HER1/EGFR and HER2 with cetuximab and trastuzumab in patients with metastatic pancreatic cancer after gemcitabine failure: results of the therapy phase 1-2 trial . Oncotarget. 2015; ; 5 (sous presse).. 19.
Bodmer A, Goetsch L, Favet L, et al. Anticorps et tumeurs solides : cibles établies et pistes prometteuses . Med Sci (Paris). 2009; ; 25 : :1090.–1098. 20.
Montagne R, Furla A, Kherrouche Z, Tulasne D. Le récepteur Met fête ses 30 ans . Med Sci (Paris). 2014; ; 30 : :864.–873. |