| |
| Med Sci (Paris). 2015 June; 31(6-7): 581–583. Published online 2015 July 7. doi: 10.1051/medsci/20153106002.Nouvelle voie métabolique de la pluripotence Lien entre glycolyse (effet Warburg), acétyl-CoA et acétylation des histones Daniel Aberdam1* 1Inserm U976, université Paris-Diderot, hôpital Saint-Louis, 1, avenue Claude Vellefaux, 75475Paris Cedex 10, France MeSH keywords: Acétyl coenzyme A, Animaux, Différenciation cellulaire, Cellules souches embryonnaires, Gènes switch, Glycolyse, Humains, Voies et réseaux métaboliques, Phosphorylation oxydative, Cellules souches pluripotentes, physiologie, génétique, métabolisme |
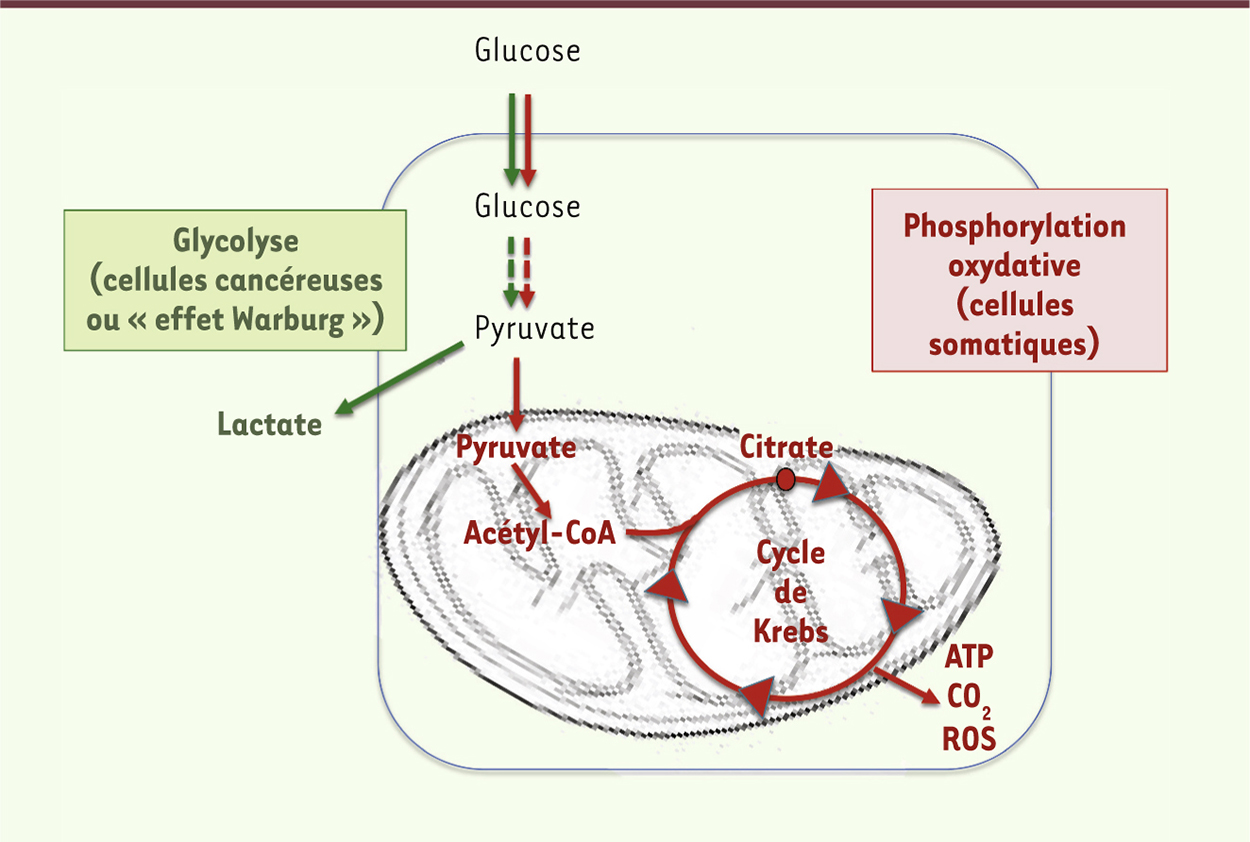
Voies métaboliques distinctes pour les cellules somatiques et les cellules souches En présence d’oxygène, les cellules somatiques métabolisent le glucose en énergie (ATP) par la voie de la phosphorylation oxydative (PhosOx), qui couple la conversion en pyruvate à la respiration mitochondriale via le cycle de Krebs (Figure 1). En l’absence d’oxygène, le glucose est métabolisé en lactate par la voie de la glycolyse anaérobie et la production d’ATP est faible. En revanche, les cellules cancéreuses utilisent le glucose par glycolyse aérobie et accumulation de lactate, même en présence d’oxygène. Ce métabolisme, qui réduit considérablement l’activité mitochondriale, est appelé « effet Warburg » depuis sa description par Otto Warburg en 1923 [1]. Les cellules souches pluripotentes, embryonnaires (CSE) ou reprogrammées (iPSC, induced pluripotent stem cells) partagent cette particularité métabolique avec les cellules tumorales [2, 3]. En revanche, en se différenciant, les cellules souches pluripotentes abandonnent la glycolyse pour la PhosOx des cellules somatiques. Cette conversion est également observée dans l’autre sens, au cours de la reprogrammation cellulaire en iPSC [2]. Il a été proposé récemment que les propriétés métaboliques des cellules souches et des cellules tumorales seraient importantes pour leur identité [4]. Cependant, les mécanismes qui permettent le maintien du métabolisme de glycolyse aérobie dans les cellules pluripotentes et sa conversion en respiration mitochondriale (PhosOx) lors de la différenciation de ces dernières sont largement inconnus. Des études récentes associent le statut métabolique des cellules souches à l’état indifférencié ou différencié à des modifications épigénétiques des histones. La chromatine des cellules souches pluripotentes est décondensée et l’activité transcriptionnelle hyperactive, par acétylation des histones et méthylation des histones et du génome [5]. Les métabolites sont les substrats de ces modifications chromatiniennes, permettant des changements rapides fonctionnels de la cellule, régulation particulièrement étudiée en cancérologie [6, 7]. Les preuves de ce lien entre épigénétique et métabolisme pour le contrôle de l’autorenouvellement ou la différenciation des cellules souches pluripotentes ont été dévoilées très récemment [3, 8].
 | Figure 1.
En présence d’oxygène, les cellules somatiques métabolisent le glucose en énergie (ATP) par la voie de la phosphorylation oxydative qui couple la conversion en pyruvate à la respiration mitochondriale via le cycle de Krebs.
|
|
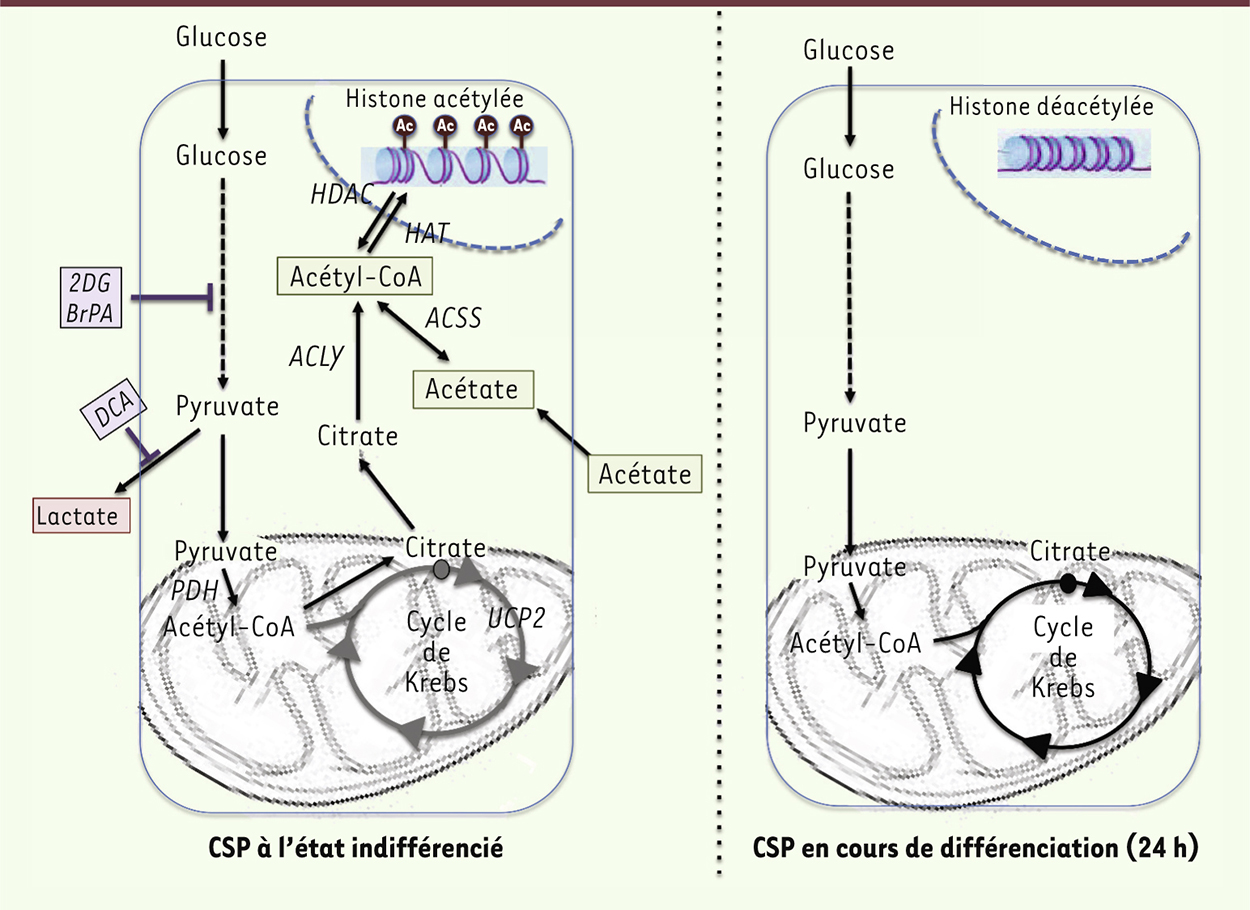
Rôle central de l’acétyl-CoA : une troisième voie pour la pluripotence Par une étude comparative des « métabolomes » intracellulaire et sécrété de cellules souches pluripotentes cultivées à l’état indifférencié et rapidement (24 et 48 h) après l’induction de leur différenciation, nous venons de découvrir qu’un niveau élevé d’acétate dans le milieu de culture est nécessaire et suffisant au maintien de la pluripotence [3] (Figure 2). L’acétate est un précurseur de l’acétyl-CoA, résidu nécessaire à l’acétylation des histones. Nous démontrons que l’acétate bloque l’engagement des cellules souches embryonnaires dans la différenciation en empêchant la déacétylation des histones par la conversion de l’acétyl-CoA via l’activation de la glycolyse. De manière remarquable, l’acétate est capable de ramener à l’état indifférencié les cellules souches pluripotentes dont le processus de différenciation est engagé. Le blocage de la glycolyse en amont de l’acétyl-CoA par des inhibiteurs pharmacologiques provoque la différenciation des cellules souches pluripotentes et la conversion de la glycolyse en PhosOx, alors qu’un inhibiteur en aval de l’acétyl-CoA freine leur différenciation. De plus, l’inhibition de l’ATP citrate lyase (ACLY), enzyme de conversion du citrate en acétyl-CoA, induit un défaut rapide de l’acétylation des histones et une différenciation précoce des cellules souches pluripotentes. Nos résultats suggèrent donc que, dans ces cellules souches, l’acétate extracellulaire permet le maintien d’un réservoir cytoplasmique d’actéyl-CoA via la glycolyse. Il a été suggéré que la réduction de PhosOx dans ces cellules indifférenciées est due à l’inactivation des enzymes PDH (pyruvate déshydrogénase) [9] ou UCP2 (uncoupling protein 2) [10], nécessaires à l’entrée de la glycolyse dans le cycle de Krebs (Figure 2). Nos résultats montrent au contraire un niveau normal de ces enzymes, quel que soit le stade de différenciation des cellules souches pluripotentes. En accord avec nos observations, nous montrons que le DCA, inhibiteur de PDK (pyruvate déshydrogénase kinase) et donc activateur de la PDH, stabilise la pluripotence des cellules. Comme DCA est un inhibiteur de la reprogrammation cellulaire [11] et qu’il agit comme un anti-tumoral [12], nos résultats suggèrent fortement que la régulation métabolique de la pluripotence des cellules souches pluripotentes et celle de la reprogrammation cellulaire sont distinctes. Cela corrobore le fait que la voie de la glycolyse est activée par les cellules en cours de reprogrammation, bien avant qu’elles acquièrent la pluripotence. De même, les changements épigénétiques des iPSC en cours de formation (remodelage global des histones et méthylation de l’ADN) sont différents de ceux qui permettent le maintien de la pluripotence (acétylation des histones) [13]. Alors que l’axe glycolyse-lactate était considéré comme essentiel aux cellules souches, nous montrons l’importance de l’axe glycolyse-acétyl-CoA-histone acétylation dans le maintien de la pluripotence. Cette troisième voie est donc distincte de la glycolyse aérobie (effet Warburg) attribuée aux cellules cancéreuses, et de la phosphorylation oxydative des cellules somatiques. Dans ce sens, il a été montré que l’acétate agit comme source majeure d’énergie dans les cellules cancéreuses in vivo, et que son absence provoque une asphyxie de la tumeur [14].
 | Figure 2.
Un niveau élevé d’acétate dans le milieu de culture est nécessaire et suffisant au maintien de la pluripotence. CSP : cellules souches pluripotentes. |
|
Conclusions et perspectives Le métabolisme cellulaire est de plus en plus considéré comme le curseur (sensor) essentiel de l’état « souche » et de la reprogrammation cellulaire. Notre étude et d’autres récentes démontrent que le profil métabolique d’une cellule souche n’est pas que le produit passif d’une signalisation cellulaire, mais une force active (driving force) influençant son état de différenciation. Parmi les acides aminés produits par la cellule, seule la thréonine a été identifiée comme essentielle à la pluripotence des cellules souches, par son rôle dans la méthylation des histones [12, 15]. Puisque la dégradation de la thréonine en glycine provoque également la conversion de la co-enzyme A en acétyl-CoA, nous proposons que la dépendance des cellules souches pluripotentes vis-à-vis de la thréonine résulte de l’augmentation d’acétyl-CoA, responsable de l’acétylation des histones [3]. Que l’acétate contrôle aussi finement l’autorenouvellement et l’acétylation des histones des cellules souches pluripotentes suggère qu’il puisse devenir un facteur bon marché pour le maintien in vitro de la pluripotence de ces cellules. Nos résultats montrent que, contrairement au dogme actuel, le métabolisme utilisé par les cellules souches pluripotentes est différent de l’effet Warburg attribué depuis des années aux cellules cancéreuses, mais aussi de celui emprunté par les cellules en cours de reprogrammation. Enfin, notre étude confirme l’importance du microenvironnement dans la modulation épigénétique de la cellule et de son devenir. Des changements mineurs de la concentration locale de métabolites pourraient ainsi être responsables d’effet entre cellules voisines, mais également à distance (paracrine, bystander) entre cellules et tissus. Identifier d’autres métabolites capables de moduler le devenir des cellules souches pluripotentes, et d’induire un engagement cellulaire ciblé sans manipulation génique aurait un intérêt considérable pour la médecine régénératrice. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Razungles J, Cavaillès V, Jalaguier S, Teyssier C. L’effet Warburg : de la théorie du cancer aux applications thérapeutiques en cancérologie . Med Sci (Paris). 2013; ; 29 : :1026.–1033. 2.
Shyh-Chang N, Daley GQ, Cantley LC. Stem cell metabolism in tissue development and aging . Development. 2013; ; 140 : :2535.–2547. 3.
Moussaieff A, Rouleau M, Kitsberg D, et al. Glycolysis-mediated changes in acetyl-coA and histone acetylation control the early differentiation of embryonic stem cells . Cell Metab. 2015; ; 21 : :392.–402. 4.
Rafalski VA, Mancini E, Brunet A. Energy metabolism and energy-sensing pathways in mammalian embryonic and adult stem cell fate . J Cell Sci. 2012; ; 125 : :5597.–5608. 5.
Melcer S, Hezroni H, Rand E, et al. Histone modifications and lamin A regulate chromatin protein dynamics in early embryonic stem cell differentiation . Nat Commun. 2012; ; 3 : :910.. 6.
Wellen KE, Hatzivassiliou G, Sachdeva UM, et al. ATP-citrate lyase links cellular metabolism to histone acetylation . Science. 2009; ; 324 : :1076.–1080. 7.
Kaelin WG Jr, McKnight SL. Influence of metabolism on epigenetics and disease . Cell. 2013; ; 153 : :56.–69. 8.
Carey BW, Finley LW, Cross JR, et al. Intracellular alpha-ketoglutarate maintains the pluripotency of embryonic stem cells . Nature. 2015; ; 518 : :413.–416. 9.
Varum S, Rodrigues AS, Moura MB, et al. Energy metabolism in human pluripotent stem cells and their differentiated counterparts . PLoS One. 2011; ; 6 : :e20914.. 10.
Zhang J, Khvorostov I, Hong JS, et al. UCP2 regulates energy metabolism and differentiation potential of human pluripotent stem cells . EMBO J. 2011; ; 30 : :4860.–4873. 11.
Folmes CD, Nelson TJ, Martinez-Fernandez A, et al. Somatic oxidative bioenergetics transitions into pluripotency-dependent glycolysis to facilitate nuclear reprogramming . Cell Metab. 2011; ; 14 : :264.–271. 12.
Mashimo T, Pichumani K, Vemireddy V, et al. Acetate is a bioenergetic substrate for human glioblastoma and brain metastases . Cell. 2014; ; 159 : :1603.–1614. 13.
Mattout A, Meshorer E. Chromatin plasticity and genome organization in pluripotent embryonic stem cells . Curr Opin Cell Biol. 2010; ; 22 : :334.–341. 14.
Meissen JK, Yuen BT, Kind T, et al. Induced pluripotent stem cells show metabolomic differences to embryonic stem cells in polyunsaturated phosphatidylcholines and primary metabolism . PLoS One. 2012; ; 7 : :e46770.. 15.
Wang J, Alexander P, Wu L, et al. Dependence of mouse embryonic stem cells on threonine catabolism . Science. 2009; ; 325 : :435.–439. |