| |
| Med Sci (Paris). 2015 June; 31(6-7): 584–586. Published online 2015 July 7. doi: 10.1051/medsci/20153106003.Cibler l’activité de l’ostéoclaste Une nouvelle piste pour lutter contre la destruction osseuse Anne Blangy1* 1Centre de recherche de biochimie macromoléculaire (CRBM), CNRS UMR5237, université de Montpellier, 1919, route de Mende, 34293Montpellier Cedex 5, France MeSH keywords: Animaux, Résorption osseuse, Facteurs d'échange de nucléotides guanyliques, Humains, Thérapie moléculaire ciblée, Ostéoclastes, Ostéogenèse, Ostéoporose, génétique, antagonistes et inhibiteurs, physiologie, méthodes, tendances, effets des médicaments et substances chimiques, traitement médicamenteux |
Maintenir la formation osseuse tout en luttant contre l’ostéoporose : un enjeu thérapeutique L’os est un tissu très dynamique, il est détruit et reconstruit en permanence. Cette dynamique est assurée par l’action coordonnée des cellules qui détruisent le « vieil » os, les ostéoclastes, et de celles qui le reconstruisent, les ostéoblastes. Mais, dans certaines maladies, l’activité des ostéoclastes prend le dessus sur celle des ostéoblastes, le remplacement de l’os détruit est alors incomplet entraînant une perte osseuse progressive. Il en résulte une fragilisation du squelette, que l’on observe par exemple après la ménopause, ou en cas de métastases osseuses - en particulier chez les patientes atteintes de cancer du sein -, ou dans certaines maladies inflammatoires comme la poly-arthrite rhumatoïde. L’ostéoporose est une maladie qui progresse rapidement, en raison notamment du vieillissement des populations. Les douleurs et les fractures qu’elle occasionne, qui peuvent conduire à une impotence, sont à l’origine d’une forte diminution de la qualité de vie et d’une augmentation de la mortalité. En effet, 20 à 50 % des personnes victimes d’une fracture du col du fémur décèdent dans l’année qui suit, en fonction de l’âge auquel survient l’accident. La prévention de la perte osseuse est donc un problème de santé publique majeur (Figure 1).
 | Figure 1.
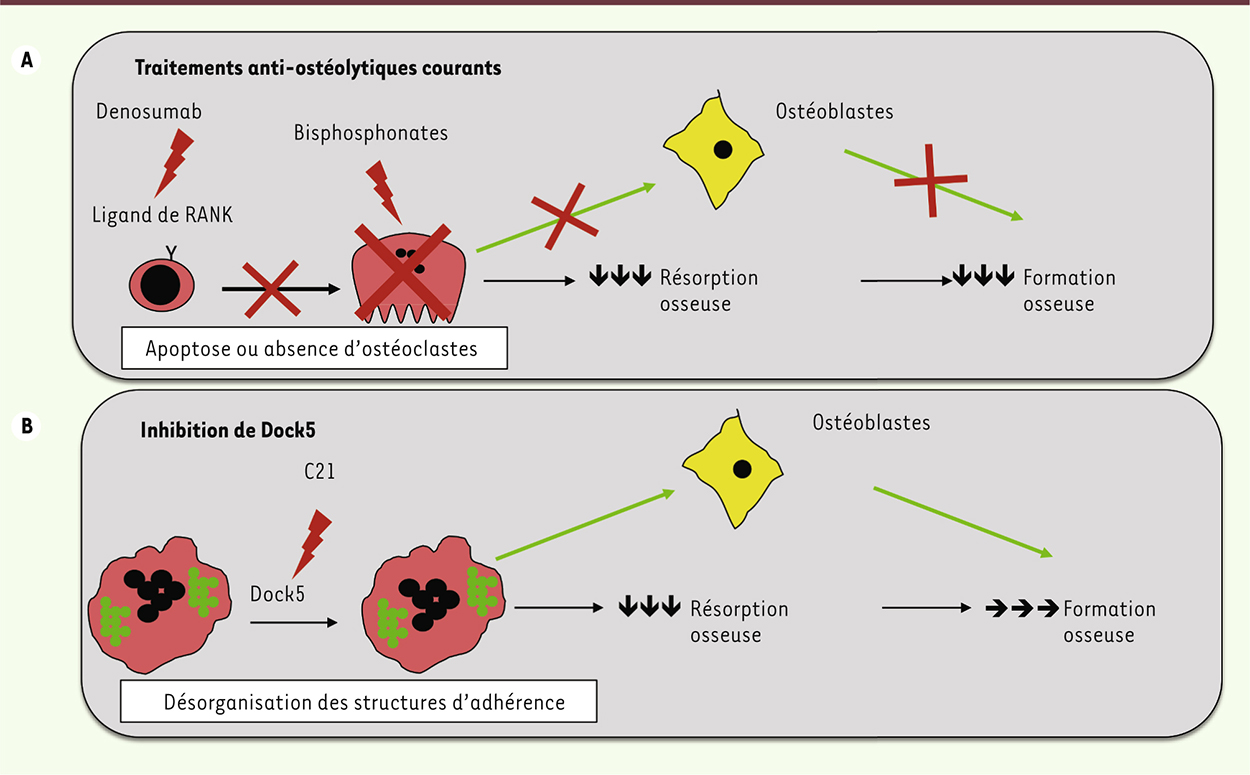
Inhiber Dock5 permet de protéger contre l’ostéolyse tout en maintenant la formation osseuse. A. Les traitements actuels de l’ostéoporose ciblent les ostéoclastes en entraînant leur apoptose (bisphosphonates) ou en empêchant leur différenciation (Denosumab, anticorps monoclonal humain de type IgG2 qui cible le ligand de RANK). L’élimination des ostéoclastes permet de diminuer très fortement la perte osseuse, mais supprime en même temps leur action stimulatrice des ostéoblastes, ce qui freine secondairement la formation osseuse. B. Dans le cas de l’inhibiteur de Dock5, C21, les ostéoclastes sont préservés, seule leur activité de résorption osseuse est atteinte, en raison de la perturbation de l’organisation des podosomes et de la zone de scellement. Ainsi, la perte osseuse est enrayée alors que la formation osseuse est maintenue. RANK : receptor activator of nuclear factor kappa-B.
|
L’enjeu thérapeutique est de contrôler l’activité des ostéoclastes pour éviter une trop grande destruction de l’os conduisant à l’ostéoporose. Or, l’activité des ostéoblastes est stimulée par la présence des ostéoclastes, qui sécrètent des facteurs stimulant la formation osseuse [1]. Les principaux traitements actuels de l’ostéoporose, en particulier les bisphosphonates, parce qu’ils éliminent les ostéoclastes, entraînent donc secondairement une diminution progressive de la formation osseuse. Il est donc important de maintenir la formation de l’os par les ostéoblastes tout en empêchant sa résorption par les ostéoclastes. Une possibilité serait de trouver des molécules qui bloquent l’activité des ostéoclastes sans affecter leur viabilité, afin de conserver l’activité ostéoblastique. Pour résorber la matrice osseuse, les ostéoclastes forment une structure d’adhérence particulière au contact de l’os - la zone de scellement - qui est formée par un anneau de podosomes. Au sein de cette structure, la cellule sécrète des protons et des ions chlore qui acidifient le milieu et dissolvent le minéral osseux. Les protéines de la matrice osseuse deviennent accessibles aux protéases sécrétées par l’ostéoclaste. En l’absence de cette zone de scellement, la résorption osseuse est inefficace. |
Dock5 : une nouvelle cible pour lutter contre l’ostéoporose sans affecter la formation osseuse Nos travaux depuis une dizaine d’années nous ont conduits à identifier un composant essentiel à l’organisation des podosomes de l’ostéoclaste : il s’agit de Dock5, un facteur d’échange de la GTPase Rac [2, 3]. Les ostéoclastes dépourvus de Dock5 sont en effet incapables de former l’anneau de podosomes et ainsi de résorber l’os. Nous avons identifié un petit composé chimique, nommé C21, un inhibiteur de l’activation de Rac par Dock5, qui mime l’effet de l’absence de Dock5 sur l’activité des ostéoclastes. Dock5 n’a pas d’effet sur la viabilité des ostéoclastes : les souris Dock5
−/-
ont un nombre d’ostéoclastes normal, mais comme ceux-ci ne résorbent pas l’os efficacement, la masse osseuse des souris est accrue. Hormis l’augmentation de la masse osseuse, les animaux ne présentent pas d’autre anomalie, leur fertilité ainsi que leur croissance sont normales [4]. Il était donc possible d’envisager un effet bénéfique d’une inhibition de Dock5 dans le contexte d’une perte osseuse exacerbée. Nous avons testé cette hypothèse en administrant par voie systémique aux souris le petit composé chimique C21, qui n’a pas d’effet toxique connu chez l’animal [5]. Nous avons utilisé différents modèles murins de perte osseuse exacerbée : un modèle d’ostéoporose post-ménopausique (des souris ovariectomisées), un modèle d’inflammation articulaire, mimant la polyarthrite rhumatoïde, et un modèle de métastases osseuses. Nous avons constaté que l’administration de C21 permettait de protéger les animaux de la perte osseuse, quel que soit le contexte, déficit hormonal, inflammation ou présence de cellules cancéreuses dans la moelle osseuse [5]. Il est donc possible d’empêcher la perte osseuse par l’administration systémique d’un inhibiteur de Dock5. Dans le cas de métastases osseuses, il se met en place un cercle vicieux de stimulation réciproque entre cellules cancéreuses et ostéoclastes : non seulement les cellules tumorales sécrètent différents facteurs activant la résorption de l’os, mais, de plus, les ostéoclastes libèrent de la matrice osseuse des facteurs de croissance qui favorisent la prolifération des cellules tumorales. Or, nous avons constaté que C21 ralentissait également la croissance des métastases osseuses, mais pas celle des métastases pulmonaires. L’inhibition de Dock5, via le blocage de l’activité des ostéoclastes, pourrait donc enrayer le cercle vicieux de la formation des métastases osseuses [5]. Nous avons enfin constaté une densité normale d’ostéoclastes à la surface de l’os des animaux recevant C21, ce qui indique que l’inhibiteur de Dock5, s’il interfère avec leur activité de résorption osseuse, n’empêche pas la survie des ostéoclastes. De fait, la formation osseuse n’est pas affectée chez les souris traitées avec C21 par voie systémique, qu’il s’agisse de souris saines ou d’animaux ovariectomisés dont la perte osseuse est exacerbée [5]. |
Les traitements actuels de l’ostéoporose suppriment les ostéoclastes et entraînent secondairement une forte diminution de la formation osseuse. Nos travaux montrent qu’un petit composé chimique ciblant l’activité de Dock5, nécessaire à l’organisation des podosomes de l’ostéoclaste, inhibe l’activité de dégradation osseuse des ostéoclastes et empêche ainsi la perte osseuse pathologique. De plus, le processus de formation osseuse est maintenu, ce qui constitue un avantage par rapport aux traitements actuels ciblant les ostéoclastes. Le développement d’inhibiteurs de Dock5 pourrait donc aboutir à de nouvelles stratégies thérapeutiques de lutte contre l’ostéoporose. |
Anne Blangy est inventeur des brevets US 2013/0165523 et WO2010/020647 sur le développement d’inhibiteurs de Dock5.
|
Ce travail a été soutenu par des subventions de l’Institut national du cancer (INCa-4361) et de l’Agence nationale de la recherche (ANR-2011-BLAN-006).
|
1.
Teti A. Mechanisms of osteoclast-dependent bone formation . Bonekey Rep. 2013; ; 2 : :449.. 2.
Brazier H, Stephens S, Ory S, et al. Expression profile of RhoGTPases and RhoGEFs during RANKL-stimulated osteoclastogenesis: identification of essential genes in osteoclasts . J Bone Miner Res. 2006; ; 21 : :1387.–1398. 3.
Vives V, Laurin M, Cres G, et al. The Rac1 exchange factor Dock5 is essential for bone resorption by osteoclasts . J Bone Miner Res. 2011; ; 26 : :1099.–1110. 4.
Touaitahuata H, Cres G, de Rossi S, et al. The mineral dissolution function of osteoclasts is dispensable for hypertrophic cartilage degradation during long bone development and growth . Dev Biol. 2014; ; 393 : :57.–70. 5.
Vives V, Cres G, Richard C, et al. Pharmacological inhibition of Dock5 prevents osteolysis by affecting osteoclast podosome organization while preserving bone formation . Nat Commun. 2015 ; :6218.. |