| |
| Med Sci (Paris). 2015 June; 31(6-7): 586–588. Published online 2015 July 7. doi: 10.1051/medsci/20153106004.Rôle de certains additifs alimentaires dans l’apparition d’une inflammation intestinale et du syndrome métabolique chez la souris Benoit Chassaing1* 1Institute for Biomedical Sciences, Center for Inflammation, Immunity, and Infection, Georgia State University, 100 Piedmont ave SE, Petit Science Center, Atlanta, GA30303, États-Unis MeSH keywords: Animaux, Maladie chronique, Émulsifiants, Additifs alimentaires, Industrie alimentaire, Gastroentérite, Humains, Maladies inflammatoires intestinales, Intestins, Souris, Microbiote, effets indésirables, normes, induit chimiquement, anatomopathologie, effets des médicaments et substances chimiques, microbiologie |
Les maladies inflammatoires chroniques de l’intestin et le syndrome métabolique Les maladies inflammatoires chroniques de l’intestin (MICI), comprenant la maladie de Crohn et la rectocolite hémorragique, sont caractérisées par un état d’hyperactivation du système immunitaire intestinal, et font intervenir des prédispositions génétiques et des facteurs environnementaux [1]. Ces maladies sévères et invalidantes affectent plus d’un million de personnes aux États-Unis et un million en Europe, dont 200 000 en France. Elles touchent principalement l’adulte jeune (15-30 ans) et ont un impact délétère sur la vie personnelle et professionnelle des malades, en raison de la fréquence des poussées, des complications, et du recours parfois nécessaire à la chirurgie. La répartition des MICI dans le monde est très inégale : la maladie de Crohn et la rectocolite hémorragique sont surtout fréquentes en Europe et en Amérique du Nord, alors qu’elles sont rares dans l’hémisphère Sud, à l’exception des populations blanches d’Australie, de Nouvelle-Zélande et d’Afrique du Sud [2, 3]. Le syndrome métabolique désigne l’ensemble des problèmes liés à l’obésité et il est considéré comme un état précurseur de maladies sévères, telles que le diabète de type 2, les maladies cardiovasculaires et les pathologies hépatiques [4]. Une des principales caractéristiques communes aux MICI et au syndrome métabolique est une altération de la localisation et de la composition du microbiote intestinal1 [5–10]. La fréquence des MICI et du syndrome métabolique a considérablement augmenté depuis le milieu du xx
e siècle [3], et cette forte augmentation a eu lieu malgré une génétique stable, ce qui suggère un rôle primordial joué par un/des facteur(s) environnemental/aux. Nous démontrons dans une étude récente publiée dans le journal Nature [11] que les agents émulsifiants peuvent modifier la localisation et la composition du microbiote, conduisant à une inflammation intestinale à l’origine de colites et de syndromes métaboliques. |
Industrie agroalimentaire et additifs alimentaires Parmi les additifs alimentaires largement utilisés par l’industrie agroalimentaire, les agents émulsifiants sont ajoutés à de nombreux produits transformés (crèmes glacées, gâteaux emballés, sauces, etc.) afin d’améliorer la texture de ces produits et en prolonger la durée de vie. Cette pratique d’ajout d’agents émulsifiants dans les aliments transformés corrèle avec l’augmentation de l’incidence des MICI et du syndrome métabolique depuis le milieu du xx
e siècle. Or, il a précédemment été montré que ces additifs favorisaient la translocation bactérienne à travers certaines cellules épithéliales intestinales [12], et semblaient induire une inflammation iléale chez la souris [13]. Les aliments interagissent de manière très étroite avec notre microbiote intestinal et il est donc envisageable que certains procédés de l’agroalimentaire, notamment l’utilisation d’additifs, puissent altérer ce dernier. |
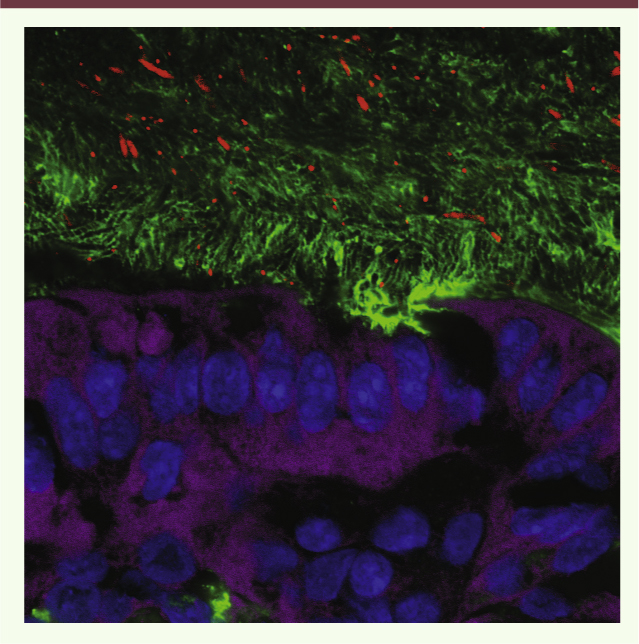
Implication des agents émulsifiants dans l’apparition d’une inflammation intestinale et du syndrome métabolique Nous avons fait l’hypothèse que les agents émulsifiants étaient impliqués dans la survenue d’inflammation intestinale et de syndrome métabolique. Pour tester cette hypothèse, des souris (jeunes ou adultes) ont été traitées avec deux agents émulsifiants largement utilisés, le polysorbate-80 et le carboxyméthylcellulose, à des doses (1 % maximum) mimant celles que consommerait l’homme dans les différents aliments transformés. La consommation de ces agents émulsifiants (dilués dans l’eau de boisson ou incorporés dans la nourriture) par les souris a eu pour conséquence une modification drastique des espèces bactériennes composant le microbiote intestinal des souris, rendant ce dernier pro-inflammatoire [11]. Ce microbiote qualitativement altéré s’est révélé avoir une capacité accrue à digérer et à infiltrer le mucus2 qui recouvre l’intestin, et qui est normalement dépourvu de bactéries (Figure 1) [14]. Cette modification de l’écosystème bactérien intestinal est également caractérisée par une diminution de la diversité bactérienne et par la présence de bactéries qui expriment fortement la flagelline et le lipopolysaccharide, protéines connues pour activer l’expression de cytokines pro-inflammatoires par le système immunitaire de l’hôte.
 | Figure 1.
Visualisation du microbiote à la surface de la muqueuse intestinale. Visualisation des bactéries composant le microbiote intestinal (en rouge) par hybridation à l’aide d’une sonde fluorescente. Les noyaux des cellules sont colorés en bleu (Hoechst), les cellules épithéliales intestinales en mauve, et la couche de mucus en vert. |
La consommation de polysorbate-80 ou de carboxyméthylcellulose favorise le développement de colites chroniques chez des souris génétiquement prédisposées à développer cette pathologie (souris dépourvues d’interleukine 10 par invalidation génique, IL10
-/-
). Chez des souris non génétiquement prédisposées, la consommation d’agents émulsifiants induit une inflammation intestinale modérée, comme le révèle l’élévation du marqueur d’inflammation intestinale lipocalin-2 dans les fécès [15], avec pour conséquence l’apparition d’un syndrome métabolique caractérisé, entre autres, par une augmentation de la masse du tissu adipeux et une hyperglycémie [11]. |
Rôle du microbiote intestinal dans l’effet délétère des agents émulsifiants Dans le but d’étudier le rôle du microbiote intestinal altéré dans la survenue de ces pathologies, des expériences similaires ont été conduites avec des souris axéniques (souris dépourvues de microbiote intestinal). Chez ces souris, les agents émulsifiants n’entraînent aucun des effets identifiés chez les souris porteuses d’un microbiote, démontrant ainsi que l’altération du microbiote intestinal induite par la consommation d’agents émulsifiants est nécessaire à la survenue de l’inflammation intestinale et du syndrome métabolique. De plus, le transfert du microbiote intestinal d’une souris traitée par un agent émulsifiant à une souris axénique semble suffisant pour induire chez cette dernière une inflammation intestinale modérée, ainsi que certaines caractéristiques du syndrome métabolique. Cela confirme le rôle central joué par l’altération du microbiote intestinal dans le développement des effets néfastes des agents émulsifiants. |
Conclusion et perspectives En conclusion, l’ingestion d’agents émulsifiants contenus dans de nombreux produits de l’industrie agroalimentaire pourrait altérer notre microbiote intestinal et son interaction avec notre intestin, avec pour conséquence l’apparition de maladies intestinales inflammatoires et de syndromes métaboliques. Il avait été précédemment observé que les souris IL10
-/-
développent de sévères colites lorsqu’elles sont exposées à un régime riche en graisses saturées, via un mécanisme impliquant le microbiote intestinal et l’expansion de la bactérie Bilophila wadsworthia [16]. De manière similaire, les nouvelles données que nous apportons aujourd’hui sur les agents émulsifiants illustrent bien l’origine multifactorielle d’une inflammation intestinale chronique, associant des facteurs génétiques, environnementaux, et un rôle central joué par le microbiote intestinal. Il est important de noter que ces résultats ne sont pas en désaccord avec l’hypothèse générale selon laquelle la suralimentation est une cause principale de l’obésité et du syndrome métabolique. Ils renforcent plutôt le concept selon lequel une inflammation intestinale modérée, liée à un microbiote intestinal altéré, pourrait être une cause sous-jacente de suralimentation. L’altération de la composition du microbiote intestinal qui suit l’ingestion de polysorbate-80 et de carboxyméthylcellulose semble jouer un rôle central dans la survenue de l’inflammation intestinale et du syndrome métabolique. Le traitement de souris axéniques par les agents émulsifiants ne semble affecter ni la structure ni l’intégrité de la couche de mucus recouvrant l’épithélium intestinal. Cependant, un potentiel effet direct des agents émulsifiants sur cette couche de mucus (indépendamment du microbiote) reste à étudier. Nos résultats [11] suggèrent que les tests actuellement réalisés avant l’autorisation d’utilisation d’additifs alimentaires par l’industrie agroalimentaire ne sont pas suffisants pour prévenir l’usage de produits pouvant favoriser les maladies liées à une inflammation intestinale modérée et/ou qui induisent une pathologie chez des individus génétiquement prédisposés. En lien avec ce concept, il est important de noter qu’une récente étude avait mis en évidence que certains édulcorants artificiels entraînaient le développement d’une intolérance au glucose, via un mécanisme impliquant lui aussi le microbiote intestinal [17]. Ces travaux encouragent la poursuite des tests d’autres agents émulsifiants, comme la lécithine de soja, fréquemment retrouvée dans les produits de l’industrie agroalimentaire. De plus, les effets des agents émulsifiants sont également en cours d’investigation chez l’homme. Si des résultats similaires sont obtenus, cela suggèrera que ces additifs alimentaires jouent un rôle dans l’apparition d’obésité, de syndrome métabolique, mais également de maladies inflammatoires chroniques de l’intestin. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Benoit Chassaing reçoit un financement de la Crohn and Colitis Foundation of America.
|
Footnotes |
1.
Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease . Nature. 2007; ; 448 : :427.–434. 2.
Economou M, Filis G, Tsianou Z, et al. Crohn’s disease incidence evolution in North-western Greece is not associated with alteration of NOD2/CARD15 variants . World J Gastroenterol. 2007; ; 13 : :5116.–5120. 3.
Molodecky NA, Soon IS, Rabi DM, et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review . Gastroenterology. 2012; ; 142 : :46.–54, e42 ; quiz e30.. 4.
Kaur J., A comprehensive review on metabolic syndrome . Cardiol Res Pract. 2014; ; 2014 : :943162.. 5.
Chassaing B, Ley RE, Gewirtz AT. Intestinal epithelial cell toll-like receptor 5 regulates the intestinal microbiota to prevent low-grade inflammation and metabolic syndrome in mice . Gastroenterology. 2014; ; 147 : :1363.–1377, e17.. 6.
Vijay-Kumar M, Aitken JD, Carvalho FA, et al. Metabolic syndrome and altered gut microbiota in mice lacking Toll-like receptor 5 . Science. 2010; ; 328 : :228.–231. 7.
Carvalho FA, Koren O, Goodrich JK, et al. Transient inability to manage proteobacteria promotes chronic gut inflammation in TLR5-deficient mice . Cell Host Microbe. 2012; ; 12 : :139.–152. 8.
Caricilli AM, Picardi PK, de Abreu LL, et al. Gut microbiota is a key modulator of insulin resistance in TLR 2 knockout mice . PLoS Biol. 2011; ; 9 : :e1001212.. 9.
Henao-Mejia J, Elinav E, Jin C, et al. Inflammasome-mediated dysbiosis regulates progression of NAFLD and obesity . Nature. 2012; ; 482 : :179.–185. 10.
Elinav E, Strowig T, Kau AL, et al. NLRP6 inflammasome regulates colonic microbial ecology and risk for colitis . Cell. 2011; ; 145 : :745.–757. 11.
Chassaing B, Koren O, Goodrich JK, et al. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome . Nature. 2015; ; 519 : :92.–96. 12.
Roberts CL, Keita AV, Duncan SH, et al. Translocation of Crohn’s disease Escherichia coli across M-cells: contrasting effects of soluble plant fibres and emulsifiers . Gut. 2010; ; 59 : :1331.–1339. 13.
Swidsinski A, Ung V, Sydora BC, et al. Bacterial overgrowth and inflammation of small intestine after carboxymethylcellulose ingestion in genetically susceptible mice . Inflamm Bowel Dis. 2009; ; 15 : :359.–364. 14.
Johansson ME, Phillipson M, Petersson J, et al. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria . Proc Natl Acad Sci USA. 2008; ; 105 : :15064.–15069. 15.
Chassaing B, Srinivasan G, Delgado MA, et al. Fecal lipocalin 2, a sensitive and broadly dynamic non-invasive biomarker for intestinal inflammation . PLoS One. 2012; ; 7 : :e44328.. 16.
Devkota S, Wang Y, Musch MW, et al. Dietary-fat-induced taurocholic acid promotes pathobiont expansion and colitis in Il10-/- mice . Nature. 2012; ; 487 : :104.–108. 17.
Suez J, Korem T, Zeevi D, et al. Artificial sweeteners induce glucose intolerance by altering the gut microbiota . Nature. 2014; ; 514 : :181.–186. |