| |
| Med Sci (Paris). 2015 June; 31(6-7): 607–609. Published online 2015 July 7. doi: 10.1051/medsci/20153106011.Des plaquettes au secours de la réparation des dents Anne Baudry,1 Jean-Marie Launay,2,3 Michel Goldberg,1 Benoit Schneider,1 and Odile Kellermann1* 1Université Paris Descartes, Inserm UMR-S 1124, Sorbonne Paris Cité, centre universitaire des Saints-Pères, 45, rue des Saints-Pères, 75270Paris Cedex 06, France 2AP-HP, service de biochimie, Inserm UMR-S 942, Paris, France 3Pharma Research Department, Hoffmann La Roche, Bâle, Suisse MeSH keywords: Adulte, Animaux, Plaquettes, Pulpe dentaire, Embryon de mammifère, Humains, Activation plaquettaire, Rats, Cellules souches, Dent, Cicatrisation de plaie, physiologie, cytologie |
Des cellules souches pulpaires réparatrices Chez l’adulte, des cellules souches permettent le renouvellement cellulaire pendant toute la vie de l’individu et/ou la réparation tissulaire en réponse à une lésion. Leur petit nombre les rend très peu accessibles. Faute de marqueurs spécifiques pour les isoler, nos connaissances sur l’identité des cellules souches somatiques adultes restent très limitées. C’est vrai même des cellules souches hématopoïétiques, pourtant très étudiées, mais dont l’organisation de la niche dans la moelle osseuse et la nature des signaux qui contrôlent leur division/différenciation restent encore mal connus [1]. Les dents une fois cassées ne peuvent pas se régénérer, et pourtant il existe, dans la pulpe, la partie vitale innervée et vascularisée de la dent, des cellules souches [2] dont le taux d’autorenouvellement est très faible en l’absence de lésion. On les considère même comme « dormantes ». La pulpe est protégée par la dentine qui est synthétisée par les odontoblastes au cours du développement embryonnaire et tôt après la naissance lors de l’édification de la racine de la dent [10] (→).
 | Figure 1.
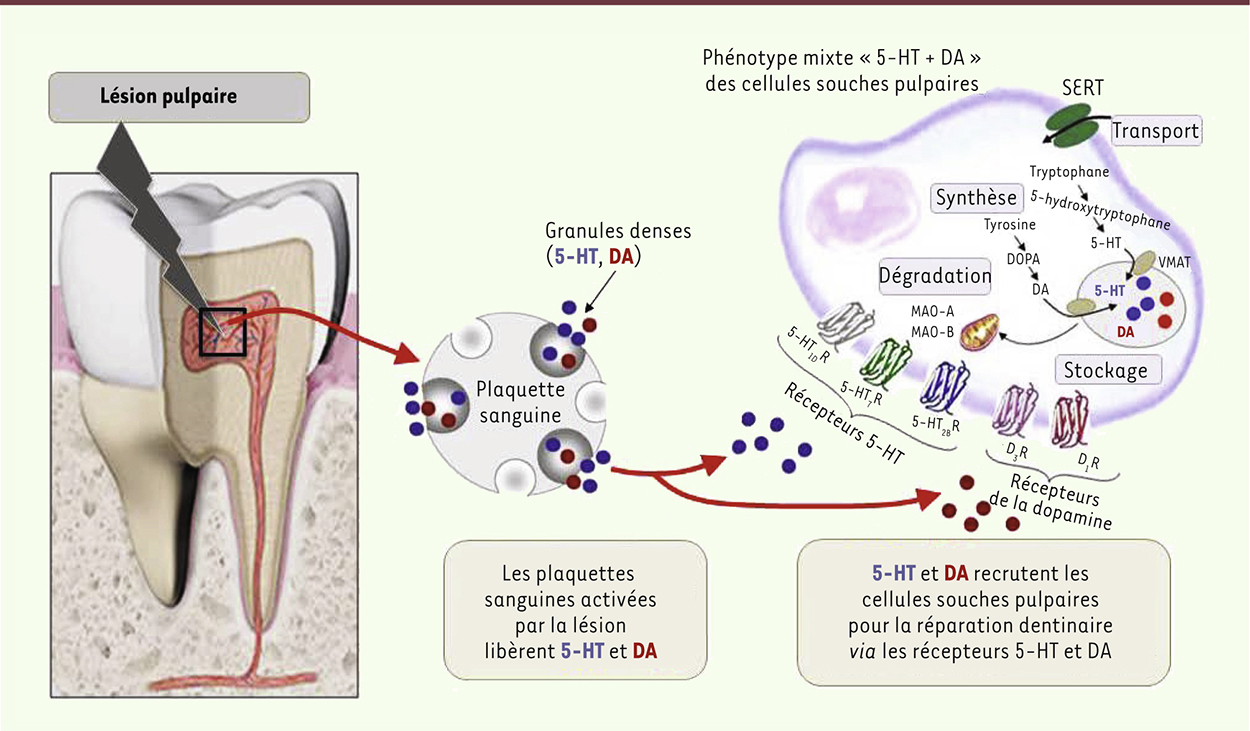
Caractérisation des cellules souches pulpaires. Les cellules souches pulpaires possèdent l’ensemble des fonctions de neurones sérotoninergiques et des neurones dopaminergiques. Elles synthétisent, recaptent et stockent ensemble la sérotonine (5-HT) et la dopamine (DA). Le phénotype mixte 5-HT + dopamine est confirmé au niveau des récepteurs exprimés à la surface des cellules : trois récepteurs sérotoninergiques (5-HT1DR, 5-HT7R, 5-HT2BR) et deux récepteurs dopaminergiques (D1, D3). La 5-HT et la dopamine libérées par les plaquettes activées lors d’une lésion sont les signaux d’alarme nécessaires pour recruter les cellules souches pulpaires impliquées dans la réparation de la dent. |
(→) Voir la Synthèse de J.C. Maurin et al., m/s n° 3, mars 2013, page 293
Les odontoblastes sont des cellules polarisées postmitotiques qui dérivent de cellules de la crête neurale à l’origine du bourgeon de la dent chez l’embryon [3]. Les corps cellulaires des odontoblastes forment une seule couche de cellules à la frontière entre la chambre pulpaire et la dentine. La dentine est perméable, elle est traversée sur toute son épaisseur par des canalicules (≈ 20 000/mm2) contenant l’extension cytoplasmique des odontoblastes, ce qui favorise les infections bactériennes de la pulpe quand la carie a traversé l’émail. Lorsque les lésions carieuses sont modérées, l’activité sécrétrice des odontoblastes est stimulée et ceux-ci élaborent une dentine réactionnelle, qui épaissit la dentine [4]. Les odontoblastes peuvent donc continuer à fabriquer de la dentine tout au long de la vie, mais quand la palissade d’odontoblastes est lésée, ils meurent et ne sont pas remplacés. Ce sont les cellules souches pulpaires et leur descendance qui sont alors mobilisées pour obturer le site de la lésion en synthétisant de la dentine réparatrice ou ostéodentine, dont la structure diffère de celle de la dentine tubulaire originelle. Après une effraction de la pulpe (caries, fracture de la couronne, etc.) les cliniciens tentent de préserver cette dernière en pratiquant un coiffage. Le but est le scellement étanche du complexe pulpo-dentinaire par un matériel de substitution (Ca[OH]2), gels de silicate, etc.). Les agents de coiffage ont un effet antiseptique (pH alcalin), ils sont surtout conçus pour minimiser la percolation bactérienne vers la pulpe. Toutefois, leurs mécanismes d’action sont empiriques et ils ne sont pas conçus pour mobiliser le pouvoir de cicatrisation des cellules souches résidentes de la pulpe [5]. Identifier les propriétés fonctionnelles des cellules souches de la pulpe et découvrir les signaux qui les recrutent sont donc des enjeux majeurs pour les thérapies dentaires. |
Lignées de cellules souches pulpaires Des lignées de cellules ayant les propriétés de cellules souches ont été établies à partir de pulpe de molaires d’embryons de souris (jour 18) [6]. Ces cellules portent la signature du lignage odontogénique, elles expriment Lhx6 et Lhx7, deux gènes homéotiques qui spécifient la région du premier arc branchial où le bourgeon de la dent se forme pendant l’embryogenèse [7]. La lignée A4 a ainsi contribué à démontrer la présence de cellules souches multipotentes dans la pulpe. Selon la nature des inducteurs et la géométrie des contacts intercellulaires (3D versus 2D), les cellules A4 se différencient in vitro vers les voies ostéogénique, chondrogénique, adipocytaire ou odontogénique. Une autre lignée, H8, a un potentiel de différenciation restreint au lignage ostéo-odontogénique. Lorsqu’elles sont implantées dans une molaire de rat, les cellules A4 ou H8 participent à une réparation spatialement contrôlée en élaborant une matrice minéralisée d’ostéodentine qui obture totalement la lésion pulpaire [8]. Ces lignées stables et homogènes offraient des outils fort utiles pour étudier les fonctions spécifiques de ces cellules souches pulpaires, caractériser les récepteurs exprimés, les signaux auxquels elles sont sensibles lors d’une lésion, et explorer la source de ces signaux. |
Les cellules souches pulpaires synthétisent sérotonine et dopamine et expriment les récepteurs correspondants Sachant que chez l’embryon, la sérotonine (5-hydroxytryptamine, 5-HT) est impliquée dans la migration des cellules de la crête neurale à l’origine des odontoblastes et participe à la morphogenèse craniofaciale, nous avons analysé dans ces lignées les profils d’expression des neuromédiateurs, de leurs récepteurs, et les fonctions associées à ces neuromédiateurs. Les lignées A4 (multipotente) et H8 (unipotente) expriment les enzymes permettant de synthétiser et cataboliser la sérotonine et la dopamine. Elles sont capables de recapter et de stocker ensemble la sérotonine et la dopamine dans des vésicules. Aucune trace d’autres neuromédiateurs n’a été détectée. De façon surprenante, les cellules souches pulpaires possèdent donc l’ensemble des fonctions des neurones sérotoninergiques et des neurones dopaminergiques. Un tel phénotype mixte sérotonine + dopamine n’a jamais été décrit dans l’organisme. Il existe 15 types de récepteurs sérotoninergiques (5-HTR). Il est intéressant de remarquer que les lignées pulpaires expriment à leur surface les 3 types de 5-HTR détectés durant l’embryogenèse précoce : le 5-HT1DR et le 5-HT7R présents dans l’embryon pré-implantatoire ; le 5-HT2BR impliqué dans la migration et la prolifération des cellules de crêtes neurales. Parmi les 5 sous-types de récepteurs dopaminergiques, les lignées expriment sélectivement les récepteurs D1 et D3. Ces récepteurs sont tous fonctionnels, couplés aux protéines G (GPCR). L’existence d’un répertoire aussi spécifique de récepteurs sérotoninergiques et dopaminergiques à la surface des cellules A4 et H8 confère à ces cellules la capacité de répondre à ces deux neuromédiateurs, en particulier circulants. Mais la question se posait : ce profil d’expression des neuromédiateurs et de leurs récepteurs identifié dans les lignées reflète-t-il celui des cellules souches résidentes de la pulpe ? Si tel était le cas, les monoamines sérotonine et dopamine pourraient-elles représenter le signal d’alarme déclenchant la réparation dentinaire ? |
La réparation de la dent dépend de la sérotonine et de la dopamine libérées par les plaquettes sanguines activées par une lésion La pulpe est très vascularisée, et des données récentes sur la localisation des niches tissulaires des cellules souches ont révélé la proximité de ces niches et des vaisseaux [9]. Or, la très grande majorité de la 5-HT et de la dopamine circulantes est stockée dans les plaquettes, qui libèrent ces monoamines dès qu’elles sont activées par une lésion vasculaire. Mais comment prouver que les plaquettes participent à la réparation dentinaire ? Nous avons tiré parti de deux modèles de rats dont les plaquettes ne stockent plus ni la 5-HT ni la dopamine ; lorsqu’une lésion de la dent est créée chez ces rats, aucune réparation n’est observée [7]. Dans une seconde approche, nous avons introduit, chez des rats normaux, des antagonistes des récepteurs 5-HT/dopamine dans la pulpe de molaires ayant subi une lésion. Dans l’étude précédente, parmi les cinq récepteurs bioaminergiques présents sur les lignées A4 et H8, quatre se révélaient très impliqués dans le processus de réparation. In vivo, le blocage d’un seul d’entre eux suffit à empêcher la réparation dentaire. La sérotonine et la dopamine libérées par les plaquettes sont donc bien des signaux d’alerte qui recrutent les cellules souches de la pulpe pour réparer la dent. La carie dentaire est l’une des maladies infectieuses les plus répandues dans le monde, elle touche près de 100 % des adultes. Notre observation d’un dialogue moléculaire entre les plaquettes sanguines et les cellules souches pulpaires offre une voie de recherche pour développer des stratégies thérapeutiques visant à amplifier le pouvoir naturel de réparation de la dent. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ces travaux sont issus d’une fructueuse collaboration avec V. Mutel, K. Coutant, N. Pieri et M. Bühler (Hoffmann-LaRoche, Bâle).
|
1.
Charbord P, Jaffredo T, Durand C. Le cœur moléculaire de la fonction de la niche des cellules souches hématopoïétiques . Med Sci (Paris). 2015; ; 31 : :12.–14. 2.
Mao JJ, Prockop DJ. Stem cells in the face: tooth regeneration and beyond . Cell Stem Cell. 2012; ; 11 : :291.–301. 3.
Thesleff I. Epithelial-mesenchymal signalling regulating tooth morphogenesis . J Cell Sci. 2003; ; 116 : :1647.–1648. 4.
Goldberg M. Reactionary and reparative dentin-like structures . In : Goldberg M, ed. The dental pulp . Berlin Heidelberg: : Springer Verlag; , 2014 : :141.–154. 5.
Schmalz G, Smith AJ. Pulp development, repair, and regeneration: challenges of the transition from traditional dentistry to biologically based therapies . J Endod. 2014; ; 40 : :S2.–S5. 6.
Lacerda-Pinheiro S, Dimitrova-Nakov S, Harichane Y, et al. Concomitant multipotent and unipotent dental pulp progenitors and their respective contribution to mineralised tissue formation . Eur Cell Mater. 2012; ; 23 : :371.–386. 7.
Baudry A, Alleaume-Butaux A, Dimitrova-Nakov S, et al. Essential roles of dopamine and serotonin in tooth repair: functional interplay between odontogenic stem cells and platelets . Stem Cells. 2015 (sous presse).. 8.
Harichane Y, Hirata A, Dimitrova-Nakov S, et al. Pulpal progenitors and dentin repair . Adv Dent Res. 2011; ; 23 : :307.–312. 9.
Doan PL, Chute JP. The vascular niche: home for normal and malignant hematopoietic stem cells . Leukemia. 2012; ; 26 : :54.–62. 10.
Maurin JC, Couble ML, Thivichon-Prince B, Magloire H. L’odontoblaste : un acteur incontournable de la perception de la douleur dentinaire . Med Sci (Paris). 2013; ; 29 : :293.–299. |