| |
| Med Sci (Paris). 2015 June; 31(6-7): 609–612. Published online 2015 July 7. doi: 10.1051/medsci/20153106012.Enregistrer l’activité unitaire des neurones sans pénétrer le cerveau Dion Khodagholy1 and George G. Malliaras2* 1NYU neuroscience institute, school of medicine, New York university, New York, États-Unis 2Département de bioélectronique, centre microélectronique de Provence, École Nationale Supérieure des Mines de Saint-Étienne, 880, route de Mimet, 13541Gardanne, France MeSH keywords: Potentiels d'action, Cartographie cérébrale, Humains, Microélectrodes, Neurones, Techniques de patch-clamp, Analyse sur cellule unique, physiologie, instrumentation, méthodes |
Le cerveau humain est composé de plus de 80 milliards de neurones, organisés en réseaux communicants nous permettant d’interagir avec notre environnement et donnant accès à des fonctions de plus haut niveau telles que la pensée abstraite. Comprendre le cerveau humain représente l’un des plus défis intellectuels majeurs de l’humanité. Outre l’intérêt fondamental associé à cette entreprise, l’étude du cerveau peut permettre de déterminer l’origine de pathologies liées aux changements de connectivité au sein de ces réseaux de neurones, comme l’épilepsie. De nouvelles méthodes thérapeutiques reposent sur la capacité à stimuler électriquement des réseaux neuronaux par l’utilisation d’électrodes implantables. Cette méthode, appelée stimulation intracrânienne, est à l’étude pour le contrôle des symptômes de la maladie de Parkinson.
 | Figure 1.
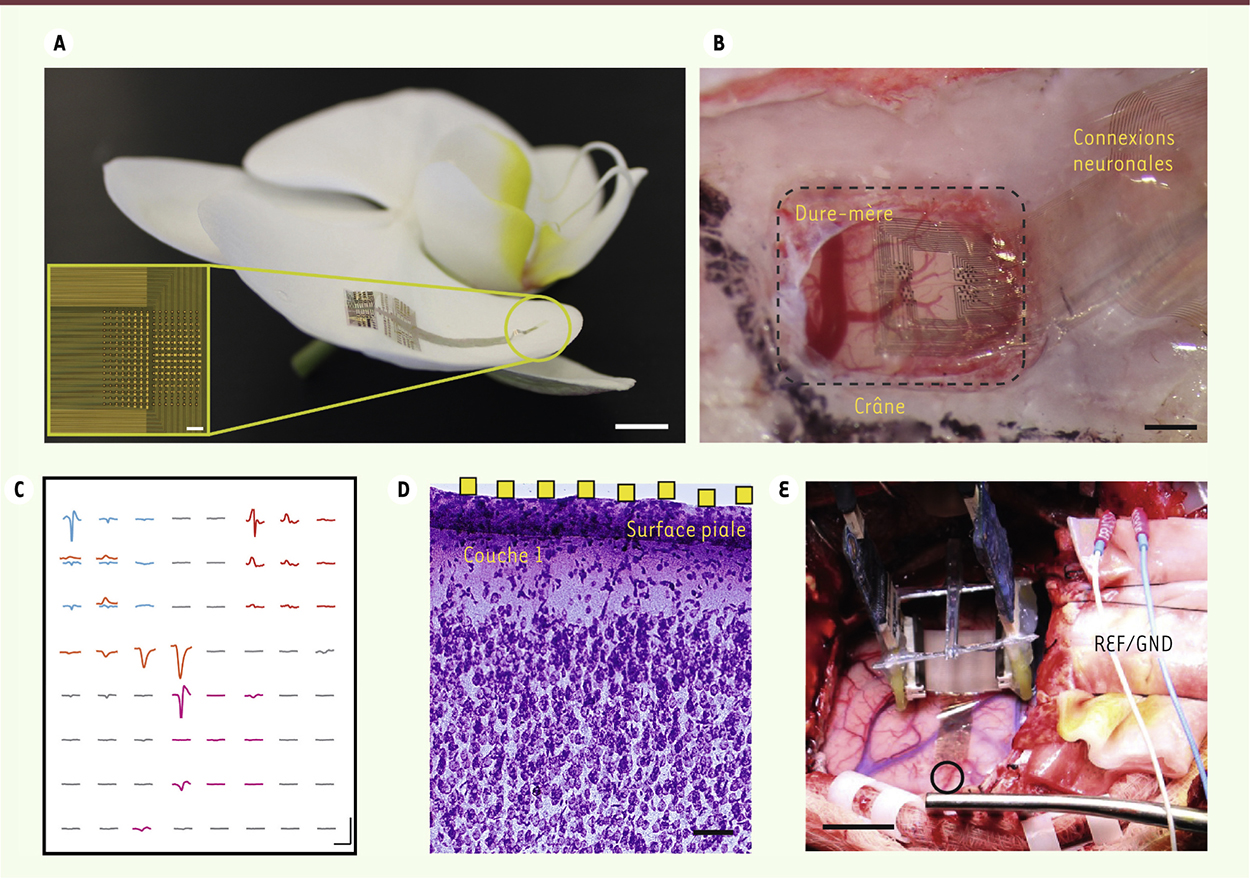
Principe de fonctionnement du NeuroGrid. A. Le NeuroGrid est d’une forme et d’une surface équivalentes à celles d’un pétale d’orchidée (échelle = 5 mm). Microscopie optique (insert) d’un système NeuroGrid à 256 électrodes (échelle = 100 μm). B. Le système NeuroGrid s’adapte à la surface du cortex d’un rat. Le bord de la dure-mère précédemment retirée est visible sur le coin supérieur gauche de la craniotomie (échelle = 1 mm). C. Exemples de potentiels d’action extracellulaires mesurés dans le cortex grâce à la technologie NeuroGrid (échelle = 1,5 ms par 50 μV). D. Coloration de Nissl de section frontale de cortex et du placement du système NeuroGrid. La localisation estimée de l’électrode est indiquée en jaune (électrodes non à l’échelle, échelle = 100 μm ; pyr = pyramidal). E. Placement chirurgical du système NeuroGrid sur la surface d’un cerveau humain (cercle ouvert). L’électronique d’acquisition est suspendue au-dessus de la surface corticale (échelle = 2 mm). |
|
Enregistrements électrophysiologiques de l’activité neuronale : de l’EEG à l’électrocorticographie L’activité électrique des neurones dans le cerveau peut prendre, entre autres, la forme de potentiels d’action ou d’activité synaptique, et résulte en la création ou la modulation de courants ioniques dans la matrice extracellulaire du cerveau. La sommation spatiale des courants ioniques à une position spécifique se caractérise par un potentiel électrique (le potentiel de champ local - LFP) qui peut être mesuré par une électrode [1]. De tels enregistrements électrophysiologiques sont des outils inestimables dans les domaines de la neurophysiologie et de la neuropathologie. Les premiers enregistrements électrophysiologiques de l’activité neuronale de l’homme ont été réalisés par Berger en 1924, grâce à l’utilisation d’électrodes cutanées. Ces mesures ont donné naissance à la technique de l’électroencéphalographie (EEG), utilisée désormais en routine en clinique pour le diagnostic de différentes pathologies telles que l’épilepsie, l’apoplexie ou encore dans le cadre de la détection de tumeurs. Parce que les signaux EEG sont enregistrés loin des sources des courants ioniques, ils correspondent à la sommation spatiale de l’activité neuronale d’un large volume du cerveau situé sous l’électrode, et ne peuvent donc pas fournir d’informations sur l’activité d’un neurone spécifique. Insérer l’électrode à l’intérieur du cerveau peut permettre d’obtenir une information plus locale. Il s’agit de la technique d’électroencéphalographie stéréotaxique (sEEG), utilisée en clinique pour localiser précisément les zones épileptogènes situées dans les structures profondes comme l’hippocampe. Dans ce cas, l’électrode pénétrante est insérée directement au cœur du cerveau. Ces dispositifs enregistrent des potentiels de champs locaux provenant des neurones au voisinage de l’électrode. Plus l’électrode est petite, plus le volume enregistré est réduit, et on augmente alors les chances d’enregistrer une activité neuronale unitaire [1]. Pour des besoins de recherche, des dispositifs microfabriqués composés d’électrodes d’une dizaine de micromètres de diamètre (comparable à la taille du soma d’un neurone) sont utilisés pour obtenir des enregistrements à haute résolution spatiale. De tels dispositifs peuvent enregistrer des potentiels de champs locaux (LFP) comme l’activité unitaire des neurones environnants, et ont permis des découvertes remarquables sur les phénomènes liés au contrôle du mouvement, la perception, la mémoire, le langage et même la conscience [2]. Outre l’EEG et la sEEG, une troisième technique peut être utilisée pour explorer le cerveau. Il s’agit de l’électrocorticographie (ECoG). Après une craniotomie qui permet d’exposer une partie du cerveau, une matrice d’électrodes est positionnée, souvent en dessous de la dure-mère. Une idée reçue veut que puisque les électrodes ECoG ne pénètrent pas le cerveau, elles ne peuvent enregistrer que des potentiels de champs locaux. Par sa nature, l’ECoG est considérée comme une technologie très proche de l’EEG, permettant une meilleure résolution spatiale en raison de l’absence de l’atténuation due au crâne. Une question reste néanmoins très ouverte : comment quantifier la qualité des signaux de l’ECoG par rapport à ceux enregistrés en EEG ? |
Conception de matrices d’électrodes pour l’enregistrement non invasif de neurones unitaires On peut caractériser les performances d’une électrode par son impédance1 électrique, proportionnelle à sa surface. Cela signifie que quand la surface de l’électrode diminue, son impédance augmente, ce qui rend plus difficile l’enregistrement de l’activité cérébrale. Plusieurs stratégies ont été développées par les spécialistes des sciences des matériaux afin d’améliorer cette interface. L’utilisation de nanomatériaux tels que les nanotubes de carbone, permet d’augmenter significativement la surface effective de l’électrode, et ainsi d’en diminuer l’impédance [3]. L’une des approches les plus efficaces est l’utilisation de polymères conducteurs [4]. Ces matériaux peuvent être pénétrés par les ions de l’environnement extracellulaire, permettant des interactions en trois dimensions avec les électrons de l’électrode. Cela se traduit par une faible impédance électrique d’interface : de très petites électrodes sont alors capables d’enregistrer l’activité cérébrale. De plus, les polymères conducteurs sont des matériaux généralement plus mous que les matériaux standards utilisés pour les électrodes, ce qui réduira ainsi la réponse immunitaire gliale après leur insertion dans le cerveau. Enfin, ces matériaux sont compatibles avec les supports mécaniques flexibles, permettant la fabrication de matrices d’électrodes ultra-conformables qui offrent un excellent contact avec la surface du cerveau et permettent l’enregistrement de signaux avec un rapport signal/bruit très élevé [5]. Nous avons fabriqué des matrices d’électrodes à base du polymère conducteur PEDOT : PSS2, disponible commercialement sous forme de dispersion, habituellement déposé sur un substrat par procédés humides. Nous avons utilisé des techniques de microfabrication pour intégrer, sur un substrat de parylène (un polymère) de 4 μm d’épaisseur, une matrice d’électrodes de 10 × 10 μm² [6]. Le résultat final, baptisé « NeuroGrid », consiste en une matrice d’électrodes qui épousent parfaitement à la surface du cerveau. Placées sur le cortex d’un rat, ces électrodes furent capables d’enregistrer des potentiels de champs locaux ainsi que l’activité unitaire de neurones. Cette dernière est révélatrice de plusieurs spécificités morphologiques, suggérant que l’enregistrement correspond à l’activité du niveau 1 d’interneurones, ainsi qu’à celle des cellules pyramidales et interneurones des niveaux inférieurs du cortex. Ces résultats impliquent que les électrodes peuvent enregistrer l’activité de neurones distants d’au moins 200 μm de la surface du cortex. De plus, l’activité de ces mêmes neurones a été enregistrée pendant plus d’une semaine sur des animaux sans contrainte de déplacement, démontrant ainsi que la nature non pénétrante et très malléable de ce matériau nous permet d’envisager prochainement l’enregistrement en continu et sur du long terme de neurones unitaires. Ceci est pour l’instant difficile à obtenir avec des électrodes implantables, principalement en raison du traumatisme créé par l’insertion de l’électrode et qu’aggravent les micromouvements de celle-ci. |
Le futur : du contrôle des exosquelettes à l’enregistrement des structures profondes du cerveau NeuroGrid constitue donc un outil innovant et puissant pour les recherches en neurosciences. La possibilité d’enregistrer de l’activité unitaire et des potentiels de champs locaux de manière non invasive devrait permettre de nombreux enregistrements de longue durée, et générer ainsi l’obtention de données indispensables à une meilleure compréhension du fonctionnement du cerveau. La flexibilité mécanique de cette matrice pourrait permettre des enregistrements au sein des sulci (sillons), zones du cerveau pour l’instant relativement inexplorées parce qu’inaccessibles aux électrodes actuelles. Un exemple d’application pourrait être la conception d’une interface haute densité cerveau/machine, qui permettrait un contrôle extrêmement précis d’un exosquelette. Le potentiel translationnel de cette technologie a été démontré en réalisant un enregistrement peropératoire chez deux patients lors d’une intervention chirurgicale visant à traiter leur épilepsie [6]. Enfin, dans le cas des rongeurs, ces enregistrements, à la fois de potentiels de champs locaux et d’activité unitaire, ont montré le premier palier d’une relation de phases entre les oscillations observées dans les potentiels de champs locaux. La principale limitation du NeuroGrid est qu’il ne peut enregistrer que des neurones des niveaux corticaux. L’étape suivante pourrait inclure l’utilisation de microtransistors en remplacement des microélectrodes comme systèmes d’acquisition. En effet, une étude réalisée par l’Ecole des Mines de Saint-Étienne et l’Institut de neurosciences des systèmes (Inserm UMR1106) de Marseille a montré que l’utilisation de transistors à base de polymères conducteurs permet un meilleur rapport signal/bruit que dans le cas des électrodes, et peut permettre d’enregistrer de l’information provenant de structures plus profondes du cerveau [7]. La question devient alors : jusqu’où peut-on mesurer de l’information depuis la surface du cerveau ? |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Buzsáki G, Anastassiou CA, Koch C. The origin of extracellular fields and currents: EEG, ECoG, LFP and spikes . Nat Rev Neurosci. 2012; ; 13 : :407.–420. 2.
Engel AK, Moll CK, Fried I, Ojemann GA. Invasive recordings from the human brain: clinical insights and beyond . Nat Rev Neurosci. 2005; ; 6 : :35.–47. 3.
Wallace GG, Moulton SE, Clark GM. Electrode-cellular interface . Science. 2009; ; 324 : :185.–186. 4.
Aregueta-Robles UA, Woolley AJ, Poole-Warren LA, et al. Organic electrode coatings for next-generation neural interfaces . Front Neuroeng. 2014; ; 7 : :15.. 5.
Khodagholy D, Doublet T, Gurfinkel M, et al. Highly conformable conducting polymer electrodes for in vivo recordings . Adv Mater. 2011; ; 23 : :H268.–H272. 6.
Khodagholy D, Gelinas JN, Thesen T, et al. NeuroGrid: recording action potentials from the surface of the brain . Nat Neurosci. 2015; ; 18 : :310.–315. 7.
Khodagholy D, Doublet T, Quilichini P, et al. In vivo recordings of brain activity using organic transistors . Nat Commun. 2013; ; 4 : :1575.. |