| |
| Med Sci (Paris). 2015 June; 31(6-7): 647–653. Published online 2015 July 7. doi: 10.1051/medsci/20153106018.Les lymphocytes B IgM+IgD+CD27+ chez l’homme Un rôle essentiel dans la défense contre les bactéries encapsulées Sandra Weller1* and Marc Descatoire1 1Institut Necker-Enfants malades (INEM), Inserm U1151, CNRS UMR 8253, université Paris Descartes, Sorbonne Paris Cité, faculté de médecine, site Broussais, 14, rue Maria Helena Viera Da Silva, 75993Paris Cedex 14, France |
Les lymphocytes B jouent un rôle clé dans l’immunité humorale en produisant des immunoglobulines (Ig) ou anticorps de différentes classes ou différents isotypes (Ig-M, -D,-G, -A et -E) en réponse à des antigènes (Ag). Exprimés à la membrane, les anticorps constituent le récepteur des cellules B (BCR), qui confère à chaque lymphocyte B une spécificité antigénique unique. Selon le type d’Ag, on distingue les réponses T-dépendantes et T-indépendantes qui vont aboutir, in fine, à une différenciation des lymphocytes B activés en plasmocytes sécrétant des anticorps dirigés contre l’Ag activateur (Figure 1). Cependant, seules les réponses T-dépendantes, qui impliquent une collaboration entre cellules T et B spécifiques du même antigène, permettent la formation de centres germinatifs (CG) au sein desquels sont enclenchés les mécanismes d’hypermutation somatique et de commutation isotypique1 dans les gènes codant les Ig des cellules B. À l’inverse des réponses T-indépendantes, les réponses T-dépendantes se caractérisent donc par l’émergence de cellules B mémoires exprimant des Ig mutées, de haute affinité pour l’Ag.
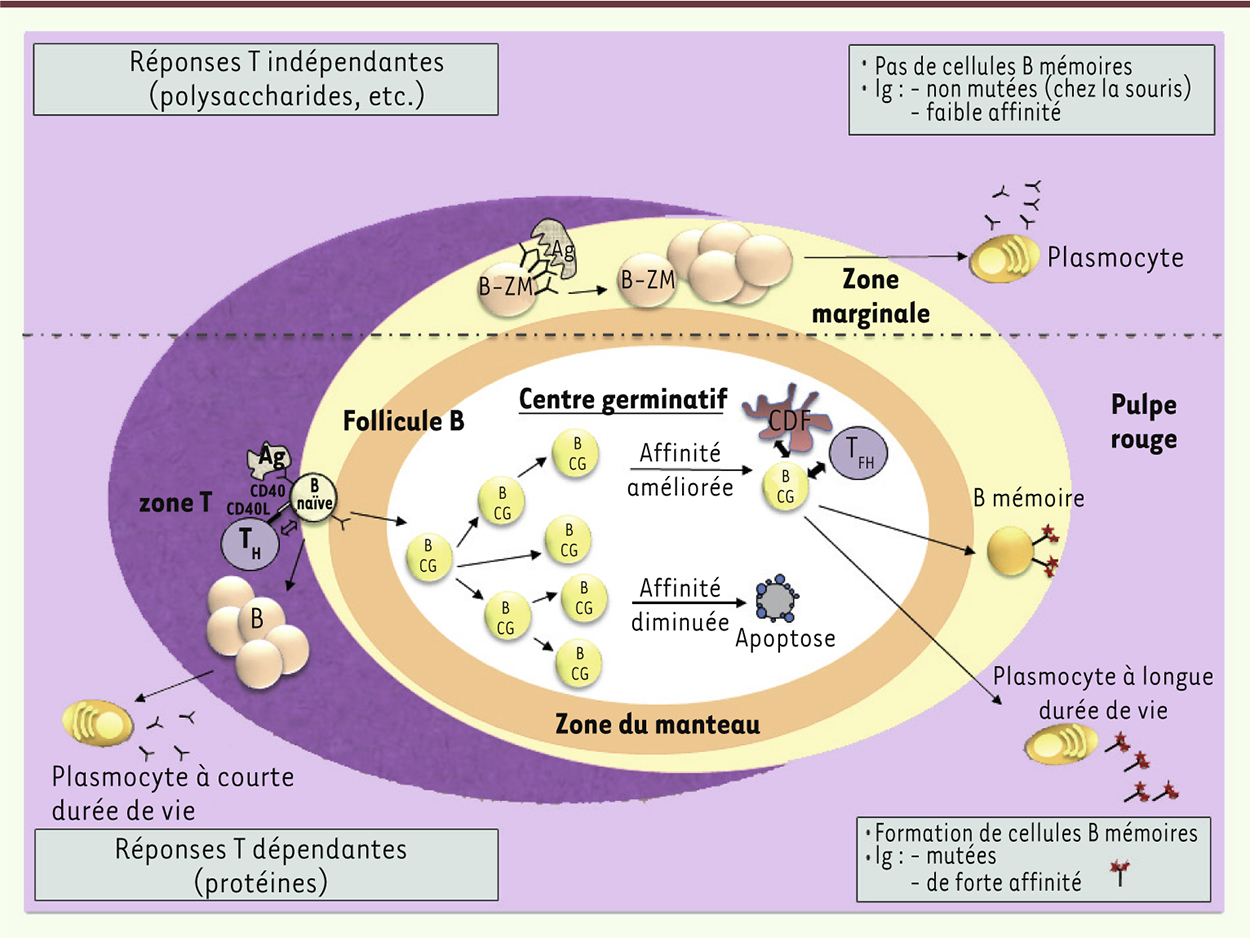
 | Figure 1.
Schéma simplifié des réponses T-dépendantes et T-indépendantes. Les lymphocytes B naïfs IgM +IgD +, après reconnaissance d’un Ag T-dépendant (protéines), vont le présenter aux cellules T auxiliaires (T H) spécifiques de ce même Ag, et ce sous la forme de peptides associés aux molécules du complexe majeur d’histocompatibilité (CMH)-II. Une étroite collaboration T-B se noue, et l’engagement des molécules CD40 exprimées par les lymphocytes B par le CD40-ligand induit sur les lymphocytes T H CD4 + activés est un évènement essentiel. Après une première vague de différenciation de cellules B en plasmocytes producteurs d’IgM de faible affinité (réaction extra-folliculaire), les interactions T-B vont aboutir à la formation de centres germinatifs (CG) dans les follicules B des organes lymphoïdes secondaires (ganglions, rate, etc.). Au sein des centres germinatifs, deux mécanismes dépendant de l’enzyme AID ( activation induced cytidine deaminase) et ciblant les locus réarrangés des gènes d’Ig sont enclenchés : l’hypermutation somatique des segments codant pour les régions variables des Ig et la commutation isotypique permettant la production de différentes classes d’Ig [ 28]. Au sein des centres germinatifs, lieu d’une intense prolifération cellulaire et d’une sélection par l’Ag, les mutations somatiques introduites dans les régions V (variables) des gènes d’Ig vont permettre une maturation d’affinité des anticorps. Poursuivie jusqu’à son terme, la réaction du centre germinatif permet la production de cellules B mémoires ou de plasmocytes portant ou sécrétant des anticorps mutés de forte affinité et généralement d’isotype IgG ou IgA après la commutation isotypique, un processus régulé par des cytokines sécrétées par les cellules T H. Les cellules B mémoires peuvent recirculer et persister pendant de longues périodes ; elles sont capables, en cas de réexposition à l’Ag, de se différencier rapidement en plasmocytes sécrétant des anticorps de haute affinité. En ce qui concerne les réponses aux Ag T indépendants (par exemple des polysaccharides capsulaires du pneumocoque) qui n’induisent la formation ni de centres germinatifs, ni de cellules B mémoires, elles sont assurées essentiellement par les cellules B de la zone marginale splénique (B-ZM). Les Ag T indépendants sont de nature non protéique et ne sont pas présentés par les molécules du CMH : ils contiennent des motifs structuraux répétés et peuvent activer directement les lymphocytes B sans aide des lymphocytes T H, grâce à une agrégation massive des récepteurs des cellules B (BCR). Ce puissant signal de prolifération agit de concert avec l’action de cytokines ou de ligands qui stimulent la sécrétion d’anticorps et la commutation isotypique vers les isotypes IgG et IgA. Certains ligands ou cytokines sont produits par des cellules T H, qui jouent un rôle régulateur dans les réponses T-indépendantes et/ou par d’autres types cellulaires, en particulier les cellules dendritiques. Ces dernières pouvant induire une commutation isotypique CD40-indépendante par le biais des ligands BAFF (a -proliferation-inducing ligand) et APRIL ( B-cell activating factor) (non figurés). CDF : cellules dendritiques folliculaires ; Ig : immunoglobuline ; B CG : cellule B du centre germinatif ; B-ZM : cellules B de la zone marginale ; T H : T helper; T FH : T follicular helper. |
|
Une seconde voie de diversification des cellules B chez l’homme Chez l’homme, la molécule CD27 est exprimée par les lymphocytes B portant des Ig mutées. Elle a donc été proposée comme un marqueur des cellules B mémoires générées dans les centres germinatifs [1]. Il a cependant été montré que ce marqueur pouvait être exprimé par des cellules B très immatures, et qu’à l’inverse, certaines sous-populations B mémoires ne l’exprimaient pas [2, 3]. Quoi qu’il en soit, les lymphocytes B CD27+ exprimant des Ig mutées (~ 40 % des lymphocytes B du sang) se répartissent en plusieurs sous-populations : les cellules IgG+ ou IgA+CD27+ (de phénotype IgM-IgD-CD27+; ~ 20 %), les cellules IgM+IgD-CD27+ dites IgM-only (~ 1 %), et enfin les cellules IgM+IgD+CD27+ (~ 20 %), souvent nommées « IgM mémoires » [4]. Dans le sang de patients atteints des syndromes hyper IgM (causés par des mutations géniques invalidant les molécules CD40 ou CD40L, cruciales pour la formation et le maintien des centres germinatifs), les cellules IgG+CD27+, IgA+CD27+ et IgM-only CD27+ sont absentes, ce qui confirme qu’il s’agit bien de cellules mémoires post-centres germinatifs. En revanche, des cellules IgM+IgD+CD27+ exprimant des Ig mutées sont présentes chez ces patients, bien qu’en nombre plus restreint. Ceci suggère que, chez des individus sains, les cellules IgM+IgD+CD27+ - ou au moins une partie d’entre elles - ne sont pas des cellules B mémoires. Nous avons donc proposé l’existence chez l’homme, d’une seconde voie de diversification des gènes d’Ig, indépendante des centres germinatifs, et analogue à celle qui est décrite chez le mouton [5] (Figure 2).
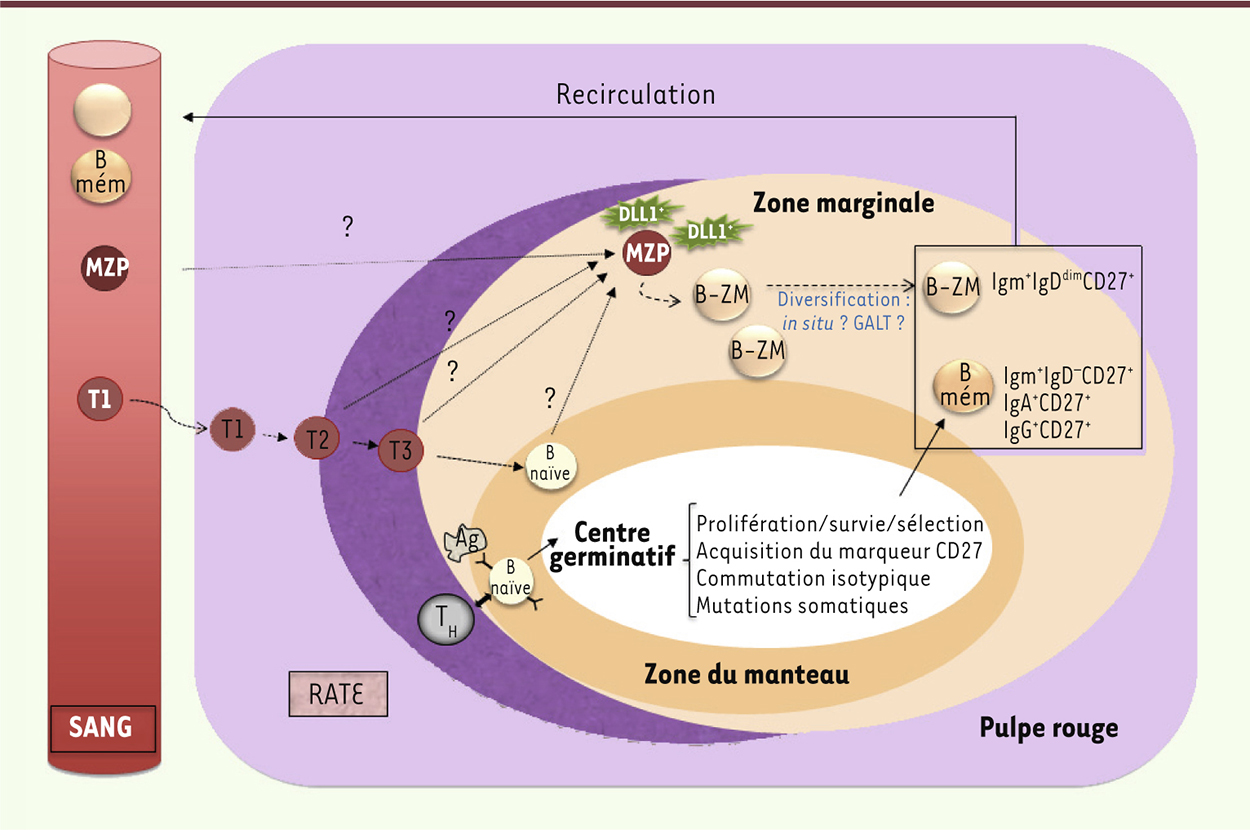
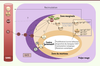 | Figure 2.
Modèle proposé de différenciation des cellules B de la zone marginale à partir des cellules MZP (marginal zone precursor). Les cellules MZP putatives sont présentes dans la rate où elles pourraient recevoir un signal d’activation de la voie Notch2, délivré par les cellules DLL1 + localisées dans la zone marginale splénique, et entraînant une différenciation en cellules B de la zone marginale. D’autres signaux, dont la nature reste à préciser, sont probablement nécessaires à cette différenciation (un rôle de signaux transmis par le BCR - comme pour la souris - étant très probable). La diversification des gènes d’Ig dans les cellules B-ZM pourrait avoir lieu dans la zone marginale, et/ou dans d’autres sites anatomiques, en particulier les tissus lymphoïdes associés à l’intestin (GALT) [ 29]. Chez la souris, les cellules B immatures quittent la moelle osseuse au stade transitionnel T1, et migrent dans la rate pour y achever leur différenciation. Le développement des cellules transitionnelles a été bien étudié chez la souris, mais de grandes zones d’ombre subsistent chez l’homme où l’équivalent de cellules T1, T2 et T3 a cependant pu être observé, à la fois dans le sang et la rate. On peut supposer que chez l’homme, les cellules T1 passeraient par les stades successifs T2 et T3 dans la rate avant de se différencier en cellules B matures naïves (dites B folliculaires). Chez la souris, le choix de lignage B-ZM versus B naïves folliculaires se fait au stade des cellules T2, qui, après avoir reçu des signaux Notch2 et BCR-dépendants, se différencient d’abord en MZP puis B-ZM [ 26]. Il reste à déterminer si les cellules T2 (ainsi que les cellules T3 et naïves) peuvent donner lieu à des cellules MZP chez l’homme dans la rate, et/ou si les MZP sont produites ailleurs et migrent ensuite dans la rate pour y achever leur différenciation. B mém : B mémoires ; T1, T2 et T3 : cellules B transitionnelles 1, 2 et 3. |
|
Les cellules IgM +IgD +CD27 + représentent l’équivalent circulant des cellules B de la zone marginale splénique et sont impliquées dans les réponses T-indépendantes Nous avons émis l’hypothèse selon laquelle les cellules IgM+IgD+CD27+ pouvaient être impliquées dans les réponses T-indépendantes, dirigées notamment contre les antigènes polysaccharidiques présents à la surface de bactéries encapsulées (pneumocoque, méningocoque, etc.). Chez la souris, les cellules B de la zone marginale splénique (ou B-ZM), localisées en périphérie des follicules B de la rate, jouent un rôle majeur dans ce type de réponse [6]. La comparaison des cellules IgM+IgD+CD27+ de la rate et du sang (en termes de phénotype, répertoire d’Ig, profil d’expression génique) indique que les cellules IgM+IgD+CD27+ du sang représentent la contrepartie circulante des cellules B de la zone marginale de la rate, qui expriment le phénotype IgMfortIgDfaibleCD21fortCD23neg/faibleCD1cfort. Il faut souligner que cette capacité à recirculer en périphérie et à présenter des Ig mutées est propre aux cellules B de la zone marginale de la rate chez l’homme, et n’est pas observée chez la souris et le rat. Nous avons montré que des clones B issus de la population IgM+IgD+CD27+ pouvaient subir une expansion dans le sang et dans la rate, en réponse à une vaccination par le Pneumo23 (vaccin pneumococcique polyosidique, polyosides de Streptococcus pneumoniae de différents sérotypes), ce qui suggère une mobilisation de ces cellules au cours de la réponse T-indépendante induite par ce vaccin [7]. Par ailleurs, les données de la littérature suggèrent un rôle important des cellules IgM+IgD+CD27+ dans les réponses T-indépendantes, en particulier dans la réponse aux polysaccharides du pneumocoque, même s’il n’est pas exclu que d’autres populations B puissent aussi répondre à ce type d’antigène. En effet, dans plusieurs groupes d’individus présentant un risque accru d’infections invasives par le pneumocoque (personnes âgées, splénectomisées, aspléniques ou présentant un déficit immunitaire commun variable2), une diminution significative du pourcentage des cellules IgM+IgD+CD27+ a été rapportée, qui s’associe à une réponse IgM anti-pneumococcale réduite par rapport à la réponse de sujets sains après vaccination par le Pneumo23 [8]. Cependant, une diminution des cellules IgM-IgD-CD27+ est également constatée, quoique moins marquée. Il a été montré de plus que des cellules IgM+IgD+CD27+ des amygdales et du sang périphérique peuvent sécréter in vitro des IgM et IgG spécifiques des polysaccharides du Pneumo23, et ce après différents types de stimulation [9]. Enfin, chez des souris immunodéficientes SCID (severe combined immunodeficiency) greffées avec des cellules IgM+IgD+CD27+ humaines et immunisées par le Pneumo23, des IgM et IgG d’origine humaine, dirigées contre les polysaccharides du vaccin, sont observées [8]. Plus récemment, des polysaccharides (sérotypes 14 et 23F) couplés à des fluorochromes ont été utilisés pour marquer et analyser le phénotype des cellules B spécifiques des polysaccharides pneumococcaux avant et après vaccination par le pneumo23. Les résultats montrent que la majorité des cellules B spécifiques des polysaccharides 14 et 23F après vaccination expriment un phénotype IgM+CD27+ [10]. En résumé, l’ensemble de ces données suggèrent un rôle prépondérant des cellules IgM+IgD+CD27+ dans les réponses à des antigènes bactériens T-indépendantes. |
Les cellules IgM +IgD +CD27 + : l’équivalent fonctionnel des cellules B1 et de la zone marginale de la rate réunies ? Chez la souris, les cellules B de la zone marginale de la rate sont impliquées dans les réponses aux antigènes T-indépendants. Elles sont cependant assistées par les cellules B1, localisées principalement dans les cavités péritonéale et pleurale [11]. Les cellules B1 murines sont IgM+ et comprennent les cellules B1a (CD5+) et B1b (CD5-). Elles ont la capacité de sécréter spontanément des anticorps naturels, de faible affinité, qui représentent l’essentiel des IgM et une large portion des IgA sériques. Les Ig dérivant des cellules B1 forment un répertoire sélectionné et autoréactif, et jouent un rôle crucial dans les étapes précoces des réponses antivirales et antibactériennes [12]. Chez l’homme, l’existence des cellules B1 reste controversée, et le marqueur CD5 exprimé sur diverses populations B ne constitue pas un marqueur caractéristique des cellules B1. Or, récemment, il a été proposé que chez l’homme, les cellules CD20+CD27+CD43+CD70- du sang de cordon ou du sang périphérique adulte correspondent aux cellules B1 murines, dont elles présentent les caractéristiques (par ex. la sécrétion spontanée d’IgM, la stimulation efficace des cellules T, un signal tonique spontané du BCR) [13]. Cependant, si on examine les proportions des cellules CD27+CD43+ par rapport aux cellules CD27+ totales rapportées dans ce travail, il apparaît que la quasi-totalité des cellules IgM+IgD+CD27+ seraient en réalité des cellules B1. Deux équipes, dont la nôtre, ont montré que les cellules CD20+CD3−CD27+CD43+ ne représentent en réalité que 2 à 3 % du compartiment total des cellules B, et expriment un phénotype IgD+ ou IgD- (incluant des cellules IgG+ ou IgA+), remettant en question leur équivalence avec des cellules B1 [14, 15]. En outre, l’existence des B1 chez l’homme, du moins selon la définition proposée, est de plus en plus controversée puisque la caractérisation de ces cellules B1 présumées révèle en réalité un phénotype préplasmablastique correspondant à un stade précoce de la différenciation plasmocytaire [16]. Il est cependant intéressant de noter que les cellules B spécifiques de la phosphorycholine (PC) se trouvent de façon prédominante, quoique non exclusive, parmi les cellules IgM+IgD+CD27+ [17]. Or, chez la souris, la production d’anticorps naturels anti-PC, exprimant l’idiotype T15 ou M167, est attribuée aux cellules B1 ou B de la zone marginale respectivement, ces 2 types cellulaires unissant leur force dans la réponse précoce aux antigènes T-indépendants du sang. Il est donc tentant de proposer que les cellules IgM+IgD+CD27+ humaines assurent à elles seules les mêmes fonctions que celles des cellules murines B1 et B de la zone marginale réunies. |
Les cellules IgM +IgD +CD27 + diversifient leurs Ig pendant leur développement et indépendamment de l’antigène Les cellules IgM+IgD+CD27+ sont présentes dans le sang et expriment des Ig diversifiées dans des situations connues de déficit des réponses T-indépendantes (enfants de moins de 2 ans, patients aspléniques [7]). Nous avons donc émis l’hypothèse selon laquelle, au cours de leur développement, ces cellules diversifient leurs gènes d’Ig, avant de répondre aux antigènes T-indépendants. Une analyse du répertoire Ig de différentes sous-populations de cellules B spléniques et périphériques présentes chez de très jeunes enfants a permis d’étayer cette hypothèse, De fait, avant 2 ans, les réponses T-indépendantes sont peu ou pas fonctionnelles, alors que les réponses T-dépendantes sont déjà effectives (et mises à profit lors des nombreuses vaccinations des nourrissons). Ce contexte est idéal pour poser la question de la diversification des cellules IgM+IgD+CD27+, sans interférence des réponses T-indépendantes au cours desquelles le mécanisme d’hypermutation somatique pourrait être (re)activé. En partant du principe que les cellules IgM+IgD+CD27+ accumulent des mutations suivant un programme de développement préétabli, la logique veut que leur répertoire Ig soit différent de celui des cellules IgM-IgD-CD27+, puisque ces dernières résultent de réactions induisant la formation de centres germinatifs dans lesquels le processus de mutation est couplé à une sélection intense par l’Ag. De fait, les résultats montrent que le répertoire Ig des cellules IgM-IgD-CD27+ présente une diversité restreinte et de larges expansions clonales caractéristiques d’une diversification dépendante de l’antigène. À l’inverse, le répertoire Ig des cellules IgM+IgD+CD27+ est polyclonal et comparable à celui des lymphocytes B naïfs. Il ne présente aucun signe d’expansions clonales caractéristiques d’une réponse à l’antigène, alors même que les cellules IgD+IgM+CD27+ ont des Ig mutées. L’ensemble de ces résultats renforcent notre proposition selon laquelle les cellules B IgM+IgD+CD27+ ne dérivent pas des centres germinatifs, mais appartiennent à un lignage spécifique qui prédiversifie ses Ig au cours d’un programme de développement, et non pas au cours d’une réaction immunitaire [18, 19]. Les cellules IgM+IgD+CD27+ pourraient ainsi présenter un répertoire élargi face à des antigènes T-indépendants filtrés dans la zone marginale splénique, et constituer une première ligne de défense vis-à-vis de bactéries encapsulées, grâce à leur capacité à se différencier rapidement en plasmocytes sécrétant des IgM mutées (et des IgG après commutation isotypique). Il existe un paradoxe dans le fait que des vaccins polysaccharidiques T-indépendants entraînent la production d’anticorps mutés, alors qu’ils ne peuvent pas induire la formation de centres germinatifs. L’interprétation classique qui est faite est que ces anticorps sont produits par des cellules B mémoires ayant subi une activation antérieure dans les centres germinatifs. Notre proposition pour résoudre ce paradoxe est que ces anticorps soient produits par les cellules B de la zone marginale de la rate dont le répertoire est prédiversifié [20]. |
Un rôle des récepteurs Toll- like (TLR) dans le développement et/ou l’homéostasie des cellules IgM +IgD +CD27 +
L’inflammation et/ou des signaux relayés par les TLR peuvent induire une prolifération T-indépendante et l’accumulation de mutations somatiques dans des cellules B immatures murines. Le groupe de R. Carsetti a montré chez l’homme que l’activation in vitro de cellules B immatures par un signal TLR9 induit la prolifération d’une fraction des cellules qui acquièrent certains marqueurs des cellules B de la zone marginale (par ex. elles sont CD27+, CD24+, CD38-) et un faible taux de mutations somatiques [21, 22]. Ainsi, pour évaluer le rôle des TLR dans le développement et/ou la diversification des cellules IgM+IgD+CD27+, nous avons étudié des patients présentant un défaut sélectif des TLR ou de molécules impliquées directement ou indirectement dans leur signalisation (IRAK4, MyD88, TLR3, UNC-93B, TIRAP3) [23]. À l’exception du TLR3, tous les autres TLR requièrent MyD88 et IRAK-4 pour relayer leur signal. TLR4 et TLR2 (qui forme des hétérodimères avec TLR1, TLR6 et peut être avec TLR10) requièrent en outre l’adaptateur TIRAP. Enfin UNC-93B est nécessaire pour la localisation intracellulaire adéquate des TLR-3, -7, -8 et -9. Les cellules IgM+IgD+CD27+, mais pas les cellules mémoires IgG+ et IgA+CD27+, sont en proportions significativement réduites chez les patients déficients en MyD88, IRAK-4 et TIRAP, alors qu’aucune altération n’est observée chez les patients déficients en TLR3 et UNC-93B. Les fréquences de mutations somatiques sont normales chez tous ces patients. Alors que TLR9 paraît facultatif, un rôle plus spécifique des TLR dépendant de TIRAP (TLR-1, -2, -6 et -10) pour le développement et/ou la maintenance des cellules B IgM+IgD+CD27+ a donc été proposé [23]. Il faut souligner que le TLR10, dont l’expression est plus forte sur les cellules IgM+IgD+CD27+, pourrait jouer un rôle particulier dans la physiologie de ces cellules. |
Une origine des cellules IgM +IgD +CD27 + toujours controversée : nouveaux résultats en faveur de l’existence d’un lignage « zone marginale » Notch2-dépendant L’origine des cellules IgM+IgD+CD27+ du sang et de la rate reste controversée. Ainsi, le groupe de R. Küppers affirme avoir apporté la preuve que les cellules IgM+IgD+CD27+ représentent toutes des cellules mémoires post-centre germinatif puisque environ 20 % des cellules IgM+IgD+CD27+ et 30 % des IgG+CD27+ du sang portent des mutations dans le gène Bcl6 (un des gènes maîtres du programme transcriptionnel des centres germinatifs). Il dit aussi avoir mis en évidence des relations clonales entre ces deux populations [24]. Toutefois, une autre étude, utilisant le séquençage à haut débit des Ig de différentes sous-populations B sanguines, n’a pas permis de mettre en évidence de relations clonales entre cellules IgM+IgD+CD27+ et IgG+/IgA+CD27+ [25]. Chez la souris, les cellules B de la zone marginale représentent un lignage distinct, généré dans la rate à partir d’un précurseur appelé MZP (marginal zone precursor) qui se différencie sous le contrôle de la voie NOTCH2 [26]. Comme nous avons proposé que chez l’homme, les cellules IgM+IgD+CD27+ du sang forment la contrepartie circulante des cellules B-ZM, nous avons donc cherché à identifier un tel précurseur. Nous avons ainsi identifié dans la rate humaine d’éventuelles cellules MZP qui représentent environ 5 % des cellules B spléniques totales chez de jeunes enfants. Elles arborent le phénotype IgMfortIgDfortCD27-ABCB1+CD24intCD1cint et se distinguent de cellules naïves par leur expression d’un variant O-glycosylé de la molécule CD45RB. Après activation de la voie NOTCH2 in vitro, une fraction des cellules MZP deviennent CD27+. Elles présentent des caractéristiques proches des cellules B de la zone marginale (B-ZM like) comme l’attestent, d’une part, l’expression augmentée de marqueurs classiques des B de la zone marginale (par ex. CD1c, CD21, TLR10), d’autre part, l’acquisition d’un profil d’expression génique proche de celui des cellules B de la zone marginale, et, enfin, leur niveau d’expression des gènes « diagnostiques » SOX7, TOX, COCH et HOPX4,. Nous désignons ainsi les gènes qui discriminent le plus les cellules IgM+IgD+CD27+ des cellules mémoires IgG+/IgA+CD27+. La présence de cellules non lymphoïdes exprimant le Delta-like 1 ligand ou DLL1 (un des ligands de NOTCH2) dans la zone marginale splénique a pu être mise en évidence. Ces cellules sont souvent en contact avec des cellules IgDfort qui pourraient être les MZP. Enfin, l’analyse du sang de trois patients présentant une mutation inactivatrice d’un allèle du gène NOTCH2 (atteints d’un sous-type du syndrome d’Alagille5 [27]) a montré une diminution spécifique des cellules IgM+IgD+CD27+, mais pas des cellules mémoire IgG+/IgA+CD27+, un phénotype similaire à celui qui est observé chez des souris haplo-insuffisantes pour Notch2. Ce résultat, ainsi que l’identification d’un précurseur des cellules B de la zone marginale, apportent donc de nouveaux arguments en faveur de l’existence d’un lignage « zone marginale » distinct chez l’homme [28]. |
Bien qu’il existe des données montrant une filiation directe entre certaines cellules IgM+IgD+CD27+ et des cellules IgG+/IgA+CD27+ du sang chez l’adulte, ces populations se distinguent sur le plan de leur ontogenèse et des signaux responsables de leur survie et de leur sélection. La controverse quant à l’origine des cellules B de la zone marginale spléniques et sanguines pourrait néanmoins être résolue en supposant une certaine hétérogénéité du compartiment IgM+IgD+CD27+ chez l’adulte. La caractérisation d’autres marqueurs phénotypiques permettra probablement d’identifier un jour les cellules IgM mémoires bona fide au sein de ce compartiment. Au-delà d’un aspect purement fondamental, l’étude des cellules IgM+IgD+CD27+ et de leur mode d’activation présente un intérêt certain dans le domaine de la vaccination antipneumococcique. De fait, les infections causées par le pneumocoque (Pnc) sont responsables de plus d’un million de décès dans le monde chaque année, et les enfants de moins de 2 ans sont particulièrement touchés. Pour prévenir ces infections, des vaccins constitués de polysaccharides de la capsule sont utilisés pour induire une réponse anticorps protectrice. On dénombre plus de 90 sérotypes pneumococcaux selon la structure des polysaccharides capsulaires. Le Pneumo23 (un vaccin 23-valent c’est-à-dire incluant 23 sérotypes) est l’un d’entre eux : il induit une réponse T-indépendante chez l’adulte, mais pas chez l’enfant avant 2 ans. Pour pallier ce problème, les vaccins dits « conjugués », tel le Prévenar (13-valent), ont été développés et impliquent un couplage des polysaccharides à des protéines vectrices, couplage qui permet d’induire une réponse T-dépendante classique chez le jeune enfant. Cependant, pour des raisons techniques (et de formulation), ce couplage difficile et très onéreux ne sera probablement pas possible pour un nombre plus élevé de sérotypes, ce qui à l’évidence limite la couverture vaccinale et risque d’augmenter la fréquence des infections dues à certains sérotypes non vaccinaux [20]. Or, nous avons montré que les cellules IgM+IgD+CD27+ étaient déjà présentes dans la zone marginale splénique et mutées avant l’âge de deux ans. À cet égard, une « immaturité » de la zone marginale per se (en terme de présence et/ou de fonctionnalité de populations de cellules accessoires, par exemple macrophages ou cellules dendritiques) est souvent évoquée. Il est donc tentant de spéculer qu’en présence de signaux adéquats (en d’autres termes, avec des adjuvants spécifiques), les cellules IgM+IgD+CD27+ de nourrissons pourraient répondre à des vaccins polysaccharidiques non couplés, tel le Pneumo23. Un tel résultat pourrait permettre une plus large couverture vaccinale, à moindre coût, y compris dans les pays en voie de développement. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Klein U, Rajewsky K, Kuppers R. Human immunoglobulin (Ig)M+IgD+ peripheral blood B cells expressing the CD27 cell surface antigen carry somatically mutated variable region genes: CD27 as a general marker for somatically mutated (memory) B cells . J Exp Med. 1998; ; 188 : :1679.–1689. 2.
Fecteau JF, Cote G, Neron S. A new memory CD27-IgG+ B cell population in peripheral blood expressing VH genes with low frequency of somatic mutation . J Immunol. 2006; ; 177 : :3728.–3736. 3.
Nilsson A, de Milito A, Mowafi F, et al. Expression of CD27-CD70 on early B cell progenitors in the bone marrow: implication for diagnosis and therapy of childhood ALL . Exp Hematol. 2005; ; 33 : :1500.–1507. 4.
Jacquot S, Boyer O. Hétérogénéité et fonctions des lymphocytes B chez l’homme . Med Sci (Paris). 2006; ; 22 : :1075.–1080. 5.
Weller S, Faili A, Garcia C, et al. CD40-CD40L independent Ig gene hypermutation suggests a second B cell diversification pathway in humans . Proc Natl Acad Sci USA. 2001; ; 98 : :1166.–1170. 6.
Martin F, Kearney JF. Marginal-zone B cells . Nat Rev Immunol. 2002; ; 2 : :323.–335. 7.
Weller S, Braun MC, Tan BK, et al. Human blood IgM memory B cells are circulating splenic marginal zone B cells harboring a prediversified immunoglobulin repertoire . Blood. 2004; ; 104 : :3647.–3654. 8.
Moens L, Wuyts M, Meyts I, et al. Human memory B lymphocyte subsets fulfill distinct roles in the anti-polysaccharide and anti-protein immune response . J Immunol. 2008; ; 181 : :5306.–5312. 9.
Takizawa M, Sugane K, Agematsu K. Role of tonsillar IgD+CD27+ memory B cells in humoral immunity against pneumococcal infection . Hum Immunol. 2006; ; 67 : :966.–975. 10.
Khaskhely N, Mosakowski J, Thompson RS, et al. Phenotypic analysis of pneumococcal polysaccharide-specific B cells . J Immunol. 2012; ; 188 : :2455.–2463. 11.
Martin F, Oliver AM, Kearney JF. Marginal zone and B1 B cells unite in the early response against T-independent blood-borne particulate antigens . Immunity. 2001; ; 14 : :617.–629. 12.
Baumgarth N. The double life of a B-1 cell: self-reactivity selects for protective effector functions . Nat Rev Immunol. 2011; ; 11 : :34.–46. 13.
Griffin DO, Holodick NE, Rothstein TL. Human B1 cells in umbilical cord and adult peripheral blood express the novel phenotype CD20+ CD27+ CD43+ CD70 . J Exp Med. 2011; ; 208 : :67.–80. 14.
Descatoire M, Weill JC, Reynaud CA, Weller S. A human equivalent of mouse B-1 cells? J Exp Med. 2011; ; 208 : :2563.–2564. 15.
Perez-Andres M, Grosserichter-Wagener C, Teodosio C, et al. The nature of circulating CD27+CD43+ B cells . J Exp Med. 2011; ; 208 : :2565.–2566. 16.
Covens K, Verbinnen B, Geukens N, et al. Characterization of proposed human B-1 cells reveals pre-plasmablast phenotype . Blood. 2013; ; 121 : :5176.–5183. 17.
Fiskesund R, Steen J, Amara K, et al. Naturally occurring human phosphorylcholine antibodies are predominantly products of affinity-matured B cells in the adult . J Immunol. 2014; ; 192 : :4551.–4559. 18.
Weller S, Mamani-Matsuda M, Picard C, et al. Somatic diversification in the absence of antigen-driven responses is the hallmark of the IgM+ IgD+ CD27+ B cell repertoire in infants . J Exp Med. 2008; ; 205 : :1331.–1342. 19.
Weller S, Reynaud CA, Weill JC. Splenic marginal zone B cells in humans: where do they mutate their Ig receptor? Eur J Immunol. 2005; ; 35 : :2789.–2792. 20.
Weller S, Reynaud CA, Weill JC. Vaccination against encapsulated bacteria in humans: paradoxes . Trends Immunol. 2005; ; 26 : :85.–89. 21.
Aranburu A, Ceccarelli S, Giorda E, et al. TLR ligation triggers somatic hypermutation in transitional B cells inducing the generation of IgM memory B cells . J Immunol. 2010; ; 185 : :7293.–7301. 22.
Han JH, Akira S, Calame K, et al. Class switch recombination and somatic hypermutation in early mouse B cells are mediated by B cell and Toll-like receptors . Immunity. 2007; ; 27 : :64.–75. 23.
Weller S, Bonnet M, Delagreverie H, et al. IgM+IgD+CD27+ B cells are markedly reduced in IRAK-4-, MyD88-, and TIRAP- but not UNC-93B-deficient patients . Blood. 2012; ; 120 : :4992.–5001. 24.
Seifert M, Kuppers R. Molecular footprints of a germinal center derivation of human IgM+(IgD+)CD27+ B cells and the dynamics of memory B cell generation . J Exp Med. 2009; ; 206 : :2659–.
69. 25.
Wu YC, Kipling D, Leong HS, et al. High-throughput immunoglobulin repertoire analysis distinguishes between human IgM memory and switched memory B-cell populations . Blood. 2010; ; 116 : :1070.–1078. 26.
Pillai S, Cariappa A. The follicular versus marginal zone B lymphocyte cell fate decision . Nat Rev Immunol. 2009; ; 9 : :767.–777. 27.
Penton AL, Leonard LD, Spinner NB. Notch signaling in human development and disease . Semin Cell Dev Biol. 2012; ; 23 : :450.–457. 28.
Descatoire M, Weller S, Irtan S, et al. Identification of a human splenic marginal zone B cell precursor with NOTCH2-dependent differentiation properties . J Exp Med. 2014; ; 211 : :987.–1000. 29.
Weill JC, Weller S, Reynaud CA. Human marginal zone B cells . Annu Rev Immunol. 2009; ; 27 : :267.–285. 30.
Catalan N, Imai K, Revy P, et al. Deux Ans Apres, L’activation Induced Cytidine Deaminase N’a Pas Livre Tous Ses Secrets . Med Sci (Paris). 2003; ; 19 : :139.–141. |