| |
| Med Sci (Paris). 2015 August; 31(8-9): 712–714. Published online 2015 September 4. doi: 10.1051/medsci/20153108003.Les cellules acineuses différenciées se dupliquent pour régénérer les acinus salivaires Claudie Lemercier1,2,3* 1Inserm, UMR_S 1038, BGE, 17, rue des Martyrs, 38054Grenoble Cedex 9, France 2CEA, iRTSV, biologie à grande échelle, 38054Grenoble, France 3Université Grenoble-Alpes, 38000Grenoble, France MeSH keywords: Cellules acineuses, Différenciation cellulaire, Prolifération cellulaire, Humains, Régénération, Glandes salivaires, cytologie, croissance et développement, physiologie |
Jusqu’à aujourd’hui, il était supposé que l’homéostasie des glandes salivaires était dépendante d’un renouvellement à partir de cellules souches. Des travaux portant sur le renouvellement des cellules acineuses (qui sécrètent la salive) lors de l’homéostasie, la croissance et la régénération des glandes salivaires viennent de bousculer ce dogme [1]. En effet, un suivi durant 6 mois de cellules uniques, marquées génétiquement, a montré que les cellules acineuses différenciées des glandes salivaires se renouvelaient essentiellement par duplication et expansion clonale de cellules acineuses différenciées, et non à partir de cellules souches comme on le pensait. Ce résultat permet d’envisager de nouvelles stratégies pour les patients souffrant de graves déficits au niveau des glandes salivaires. |
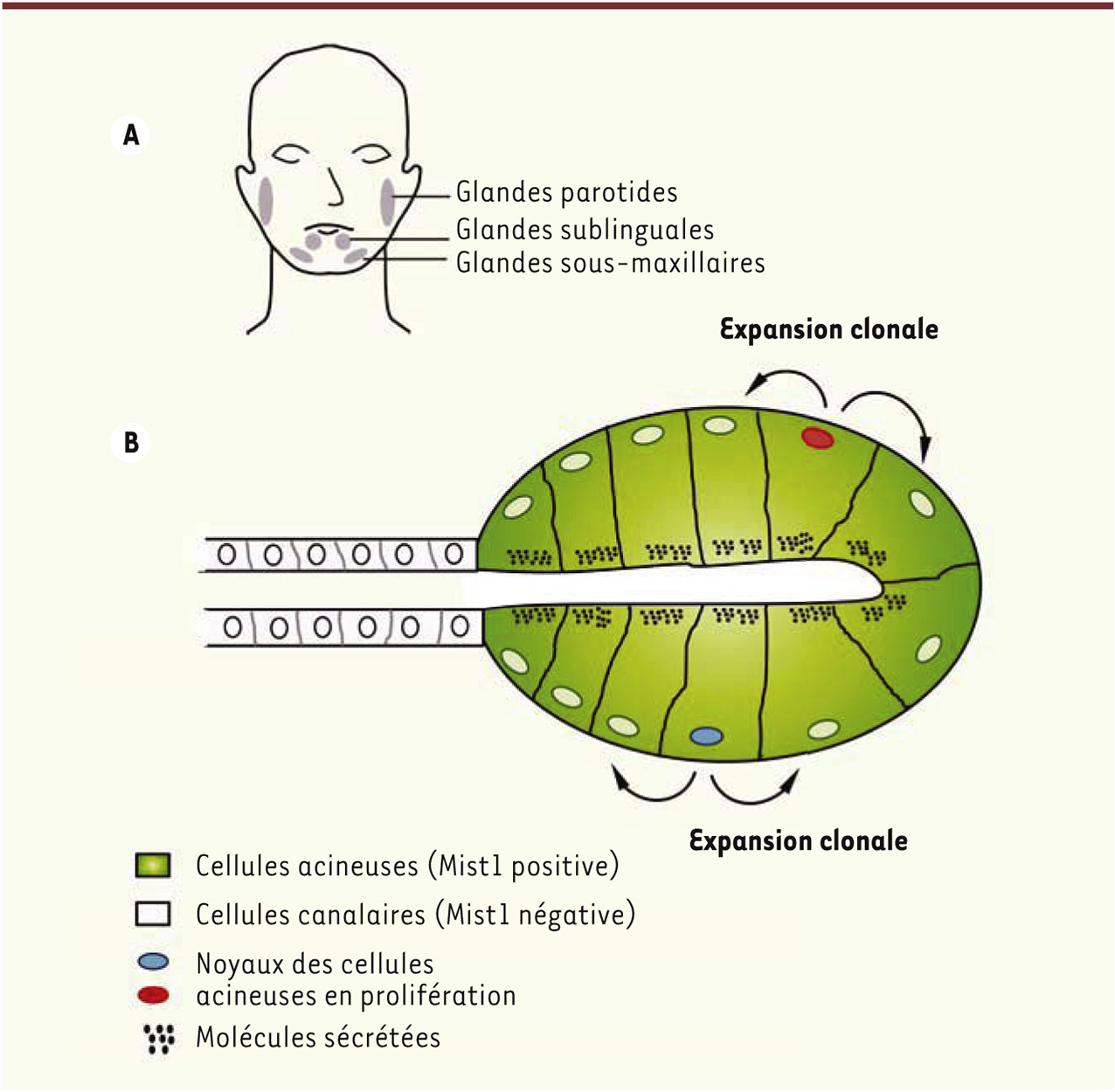
Les glandes salivaires, des structures extrêmement radiosensibles Trois paires de glandes salivaires produisent la majeure partie de la salive. Il s’agit des glandes parotides, sous-maxillaires et sublinguales (Figure 1A). Ces glandes sont de type acineux, avec des acinus produisant des sécrétions (eau, électrolytes, protéines, mucus, métabolites), collectées et véhiculées par les cellules canalaires (Figure 1B). Ces glandes salivaires sont particulièrement radiosensibles. Il est donc fréquent, après une radiothérapie pour traiter un cancer du cou ou de la gorge, de voir apparaître un dessèchement de la bouche à la suite d’une baisse de production de salive, parfois accompagné d’infections de la cavité buccale, de caries dentaires et d’autres effets débilitants. Ces effets secondaires résultent de la destruction irréversible des cellules acineuses. La régénération des glandes salivaires constitue donc un enjeu important pour les patients touchés par ce déficit acquis [2–4]. Mais comment les glandes salivaires se renouvellent-elles ?
 | Figure 1.
Duplication des cellules acineuses différenciées dans les glandes salivaires. A. Localisation des glandes salivaires principales (parotides, sublinguales et sous-maxillaires). Il existe également des petites glandes salivaires accessoires, non représentées, qui tapissent toute la cavité buccale. La salive joue un rôle dans la digestion, le goût, la protection de l’émail, et elle a des propriétés antibactériennes et antifongiques. B. Représentation d’un acinus et d’un canal sécréteur, adaptée de [ 1]. Les acinus produisent la salive (mucus, eau, électrolytes, protéines, métabolites), les cellules canalaires collectent et véhiculent les sécrétions. L’homéostasie des glandes salivaires est maintenue essentiellement par duplication de cellules acineuses différenciées et expansion clonale. |
|
Marquage des cellules acineuses salivaires par pulse-chase génétique Pour remonter à l’origine des cellules acineuses salivaires, Aure et collaborateurs [1] ont utilisé une technique permettant de marquer des cellules acineuses uniques afin de suivre leur évolution au cours du temps. De manière plus précise, ils ont utilisé une forme inductible de la recombinase Cre, insérée sur l’un des allèles du locus Mist de souris. Mist1, un facteur de transcription spécifiquement exprimé dans les cellules acineuses de l’embryon et de l’adulte, contribue à la différenciation terminale des cellules [5–7]. Ces souris ont été croisées avec une autre lignée exprimant le gène rapporteur LacZ [7]. En présence d’un inducteur, le tamoxifène, la Cre produite dans les cellules acineuses permet l’expression du gène rapporteur et la production de β-galactosidase. Une détection biochimique de cette enzyme permet par la suite de repérer dans le temps et l’espace les cellules acineuses bleues exprimant le rapporteur, et de réaliser un dénombrement précis des cellules marquées. Ce système mime un pulse-chase génétique (technique permettant de marquer une certaine génération de cellules afin de suivre son évolution), durant lequel se produit le renouvellement de toutes les cellules acineuses, leur turnover étant compris entre 2 et 4 mois. |
Renouvellement des acinus des glandes salivaires : les cellules différenciées prolifèrent Les glandes salivaires ont été prélevées à différents temps après le traitement par le tamoxifène. Six mois après l’induction de la Cre, la majorité des cellules acineuses des glandes salivaires sont bleues, premier indice suggérant que les nouvelles cellules acineuses ne proviennent pas de cellules souches non marquées mais des cellules marquées initialement [1]. D’autre part, des marquages permettant de visualiser la prolifération cellulaire ont mis en évidence qu’une petite fraction des cellules acineuses différenciées se multipliaient, une capacité rarement mise en évidence pour des cellules considérées comme post-mitotiques. Enfin, un suivi in vivo chez la souris adulte de cellules individuelles marquées par différents fluorophores a révélé que les acinus étaient formés de clones de cellules acineuses juxtaposés les uns près des autres (Figure 1B). Le renouvellement des acinus s’effectue donc à partir de cellules acineuses différenciées, et plus particulièrement grâce à une expansion clonale des cellules. Ainsi chaque acinus peut être constitué de plusieurs clones [1]. |
Mise en place des glandes salivaires et régénération après lésion Le développement des glandes salivaires débute chez l’embryon puis s’achève après la naissance. Une semaine après la naissance, le principal mécanisme de croissance des acinus est déjà la duplication des cellules acineuses existantes et leur expansion clonale. Un cas particulier est observé pour les glandes sublinguales, pour lesquelles des cellules acineuses uniques, à durée de vie très longue, ont été mises en évidence (voir ci-dessous). Pour étudier la régénération des acinus après lésion, la ligature du canal sécréteur principal d’une des deux glandes sous-maxillaires a été réalisée, entraînant la disparition des acinus, mais laissant les canaux sécréteurs intacts. La glande fonctionnelle située du côté opposé servait de témoin. Deux semaines après le retrait de la ligature, il est possible d’observer que des acinus se régénèrent dans la glande partiellement détruite, à partir de cellules acineuses survivantes qui se dupliquent et prolifèrent de façon clonale pour former de nouveaux acinus [1]. |
Le cas des glandes salivaires sublinguales Le renouvellement des cellules acineuses semble identique dans les glandes parotides et sous-maxillaires. En revanche, dans les glandes sublinguales, deux cas de figure sont observés: des acinus bien marqués formés par expansion clonale, et des cellules acineuses marquées uniques, qui ne se multiplient pas ou peu [1]. Certaines de ces cellules uniques expriment Sox2, un facteur essentiel pour l’autorenouvellement des cellules souches. Une partie des acinus des glandes sublinguales pourrait donc se renouveler à partir de cellules progénitrices adultes [1]. Une deuxième population de cellules uniques, négatives pour Sox2, a également été identifiée. Ces cellules ont une durée de vie très longue et leur fonction reste pour le moment hypothétique. |
Conclusions et espoirs pour le futur Un nouveau modèle est proposé pour expliquer l’homéostasie des glandes salivaires. Celle-ci serait basée majoritairement sur la duplication des cellules acineuses différenciées existantes plutôt que sur la prolifération de cellules souches. Les glandes salivaires, ainsi que le foie et le pancréas, sont donc des tissus dont la maintenance et la croissance ne sont pas directement dépendantes des cellules souches. La susceptibilité exacerbée des glandes salivaires à l’irradiation était considérée jusqu’à présent comme anormale. Mais le fait que des cellules post-mitotiques y prolifèrent pourrait désormais expliquer la destruction des cellules acineuses à la suite des dommages radio-induits de leur ADN, et donc l’impossibilité de régénérer des acinus. Ces nouvelles informations pourraient contribuer à l’élaboration de méthodes thérapeutiques moins délétères pour les cellules acineuses. De nombreuses stratégies de régénération tissulaire font appel à des cellules souches, délicates à obtenir, fastidieuses à maintenir en culture et à différencier dans le type cellulaire recherché, en particulier chez l’homme. Dans l’avenir, une alternative pourrait provenir de la prolifération des cellules acineuses elles-mêmes, lorsque le mécanisme de prolifération de ces cellules différenciées aura été décrypté. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Aure MH, Konieczny SF, Ovitt CE. Salivary gland homeostasis is maintained through acinar cell self-duplication . Dev Cell. 2015; ; 33 : :1.–7. 2.
Sood AJ, Fox NF, O’Connell BP, et al. Salivary gland transfer to prevent radiation-induced xerostomia: a systematic review and meta-analysis . Oral Oncol. 2014; ; 50 : :67.–83. 3.
Jensen DH, Oliveri RS, Trojahn Kølle SF, et al. Mesenchymal stem cell therapy for salivary gland dysfunction and xerostomia: a systematic review of preclinical studies . Oral Surg Oral Med Oral Pathol Oral Radiol. 2014; ; 117 : :335.–342. 4.
Ogawa M, Oshima M, Imamura A, et al. Functional salivary gland regeneration by transplantation of a bioengineered organ germ . Nat Commun. 2013; ; 4 : :2498.. 5.
Lemercier C, To RQ, Swanson BJ, et al. Mist1: a novel basic helix-loop-helix transcription factor exhibits a developmentally regulated expression pattern . Dev Biol. 1997; ; 182 : :101.–113. 6.
Pin CL, Rukstalis JM, Johnson C, et al. The bHLH transcription factor Mist1 is required to maintain exocrine pancreas cell organization and acinar cell identity . J Cell Biol. 2001; ; 155 : :519.–530. 7.
Shi G, Zhu L, Sun Y, et al. Loss of the acinar-restricted transcription factor Mist1 accelerates Kras-induced pancreatic intraepithelial neoplasia . Gastroenterology. 2009; ; 136 : :1368.–1378. |