| |
| Med Sci (Paris). 2015 August; 31(8-9): 728–730. Published online 2015 September 4. doi: 10.1051/medsci/20153108009.L’adénocarcinome pancréatique : une tumeur dépendante des lipoprotéines Sophie Vasseur1,2,3,4* and Fabienne Guillaumond1,2,3,4** 1Inserm U1068, Centre de recherche en cancérologie de Marseille, F-13288Marseille, France 2Institut Paoli-Calmettes, F-13009Marseille, France 3CNRS, UMR7258, F-13009Marseille, France 4Université Aix-Marseille, F-13009Marseille, France MeSH keywords: Adénocarcinome, Cholestérol, Humains, Lipoprotéines, Tumeurs du pancréas, étiologie, physiologie |
L’adénocarcinome canalaire pancréatique (ADKP) est un cancer de mauvais pronostic du fait de son diagnostic tardif et de sa résistance intrinsèque aux thérapies antitumorales existantes [1, 11]. À un stade avancé de la maladie, les patients développent un syndrome cachectique irréversible réduisant l’efficacité des thérapies anticancéreuses et dégradant leur qualité de vie ; seulement 5 % survivent au-delà de 5 ans. Cette cachexie cancéreuse, résultant d’un dialogue étroit et bidirectionnel entre les tissus métaboliques de l’hôte et la tumeur pancréatique, engendre des troubles métaboliques se caractérisant principalement par une protéolyse musculaire importante et des anomalies affectant aussi le métabolisme lipidique (lipolyse) et glucidique (néoglucogenèse) [2]. La tumeur pancréatique se caractérise par un stroma important, peu vascularisé, encerclant les cellules cancéreuses, les privant ainsi d’un apport suffisant en oxygène et en nutriments. Les cellules tumorales en expansion sont donc contraintes d’effectuer une reprogrammation métabolique pour pallier leurs besoins excessifs en énergie et en nutriments. |
L’adénocarcinome pancréatique : un cancer unique en son genre Le modèle expérimental murin Pdx1-Cre;K-RasG12D;Ink4a/Arffl/fl (PKI), reproduit fidèlement les caractéristiques de la pathologie humaine. Ce modèle, porteur d’une invalidation du locus Cdkn2a, codant pour deux suppresseurs de tumeur (Ink4a et Arf) et d’une activation constitutive de K-Ras spécifiquement dans le pancréas (sous l’effet de la recombinase Cre dirigée par l’expression de Pdx1, un gène maître de l’identité pancréatique), développe spontanément des adénocarcinomes canalaires pancréatiques [3]. Ces deux mutations sont retrouvées chez 80 à 95 % des patients atteints de cette tumeur. Les régions hypoxiques, disséminées dans ces tumeurs murines, représentent en moyenne 20 % de la surface totale de la tumeur. Un tiers de ces régions est occupé par des cellules épithéliales tumorales présentant des changements phénotypiques caractéristiques de la transition épithélio-mésenchymateuse (EMT), qui leur confèrent des propriétés invasives [4]. Sur le plan métabolique, ces cellules hypoxiques ont un statut majoritairement glycolytique, elles produisent en excès du lactate, qui peut lui-même servir de substrat métabolique alternatif au glucose pour les cellules tumorales normoxiques avoisinantes. Dans le compartiment hypoxique, cette activité glycolytique exacerbée, associée à une dégradation de la glutamine, permet l’activation d’une 3e voie métabolique, celle des hexosamines, stabilisant les protéines protumorales grâce à des processus de O-N-acétylglucosaminylation [4]. Il existe donc une hétérogénéité métabolique intratumorale révélant la complexité de la reprogrammation métabolique qui ne se limite sûrement pas à une activation exacerbée de la glycolyse et de la glutaminolyse. L’accessibilité restreinte des cellules tumorales aux nutriments et à l’oxygène, due au proéminent stroma, et l’activation constitutive de K-Ras oncogénique, induisent des modifications métaboliques essentielles à l’expansion des cellules tumorales [5]. Définir précisément les mécanismes de reprogrammation métabolique constitue alors un véritable défi pour la découverte de nouvelles stratégies thérapeutiques. |
L’avidité des cellules tumorales pancréatiques pour les lipoprotéines en général et le cholestérol en particulier Grâce à l’utilisation des souris PKI décrites ci-dessus, nous avons défini la signature transcriptionnelle de l’adénocarcinome canalaire pancréatique, signature à partir de laquelle une cartographie des voies métaboliques altérées dans cette tumeur a pu être établie. De manière surprenante, les voies impliquées dans le métabolisme lipidique sont les plus activées dans la tumeur, et en particulier celles qui sont associées au catabolisme des lipoprotéines (Figure 1A) [6]. Les lipoprotéines LDL (low-density lipoprotein), principaux réservoirs de cholestérol circulant de l’organisme, sont capturées par les cellules tumorales qui surexpriment à leur surface le récepteur des LDL, le LDLR (LDL receptor). Celui-ci est exprimé par les cellules tumorales pancréatiques quel que soit leur degré de différenciation. Par ailleurs, son expression est très supérieure à celle de l’enzyme limitante de la voie de synthèse du cholestérol, HMGCR (3-hydroxy-3-methylglutaryl-CoA reductase) [6]. Par conséquent, l’adénocarcinome canalaire pancréatique satisfait ses besoins en cholestérol en activant majoritairement la capture du cholestérol exogène au détriment de la voie de synthèse endogène. L’inhibition de la voie de synthèse, par les statines, ne serait donc qu’un coup d’épée dans l’eau pour limiter le contenu en cholestérol des cellules tumorales pancréatiques, face à l’entrée massive de cholestérol via le LDLR. D’ailleurs, aucun bénéfice thérapeutique des statines associées à la chimiothérapie par la gemcitabine1 n’a pu être observé chez des patients atteints d’adénocarcinome canalaire pancréatique avancé [7]. Nous avons montré que les tumeurs des patients atteints de ce cancer avec un risque élevé de récurrence tumorale ou métastatique expriment fortement le LDLR, ce qui signe un besoin massif en cholestérol des tumeurs les plus agressives [6].
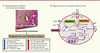 | Figure 1.
Adénocarcinome canalaire pancréatique et avidité pour les lipides. A. Reprogrammation lipidique de la tumeur pancréatique. Coloration HPS (hématoxyline, phloxine et safran) d’une coupe de tumeur pancréatique. Les glandes tumorales (délimitées par un trait pointillé vert) sont entourées par une barrière stromale (annotée par *) dense et peu vascularisée qui restreint la diffusion de l’O2 et l’apport en nutriments aux cellules tumorales. En réponse aux stress, hypoxique et nutritif, les cellules tumorales pancréatiques modifient leur activité métabolique pour survivre et proliférer dans cet environnement hostile. Le métabolisme lipidique joue un rôle prépondérant dans cette reprogrammation, comme en témoignent les nombreuses voies altérées dans la tumeur pancréatique par rapport aux pancréas normaux. Ici sont mentionnés quelques exemples de ces voies lipidiques. B. Régulations post-transcriptionnelles du LDLR par IDOL et PCSK9. IDOL, activé transcriptionnellement par le récepteur nucléaire LXR (liver X receptor), induit l’ubiquitination de l’extrémité carboxy-terminale du LDLR puis sa dégradation dans le lysosome. La protéine PCSK9, activée transcriptionnellement par SREBP (sterol regulatory element binding protein), est sécrétée et se lie au domaine extracellulaire du LDLR membranaire. Le complexe LDLR/PCSK9, internalisé par endocytose, empêche le recyclage du LDLR des endosomes vers la membrane plasmique et facilite sa dégradation dans le compartiment lysosomal. |
Quelles sont les causes de cette surexpression du LDLR dans ces tumeurs ? Ce récepteur étant finement régulé, des études plus poussées sont nécessaires pour définir les mécanismes moléculaires qui modifient sa stabilité dans la tumeur pancréatique. Différents régulateurs post-transcriptionnels du LDLR ont récemment été découverts : d’une part les protéines ZFP36L1 et ZFP36L2, qui, par leur liaison aux régions non traduites en 3’du Ldlr, diminuent sa demi-vie [8], et, d’autre part, les ubiquitine ligases de type E3 spécifiques du LDLR, IDOL (inducible degrader of the LDLR), qui induisent son ubiquitination, puis sa dégradation [9] (Figure 1B). Enfin, les protéines sécrétées PCSK9 (proprotein convertase subtilisin/kexin 9), en se fixant sur la partie extracellulaire du récepteur, entravent, après l’internalisation de ce dernier, son recyclage de l’endosome vers la membrane plasmique, et favorisent sa dégradation dans le compartiment lysosomal [10] (Figure 1B). Quel que soit le processus à l’origine de l’expression massive du LDLR dans l’adénocarcinome canalaire pancréatique, nous avons démontré que son extinction bouleverse le ratio de cholestérol libre (forme active) et de cholestérol estérifié (forme stockée) dans la cellule tumorale [6]. La surcharge en cholestérol libre résultant de ce déséquilibre est associée à un ralentissement de la progression tumorale. De plus, cette perturbation métabolique induite par l’inhibition du LDLR sensibilise les cellules tumorales à la chimiothérapie. En conclusion, le ciblage du LDLR ouvre donc une nouvelle fenêtre thérapeutique pour combattre l’adénocarcinome canalaire pancréatique. L’identification d’outils thérapeutiques déstabilisant le LDLR, ou bloquant son activité, constitue de réelles options pour le développement de nouveaux essais cliniques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Hidalgo M. New insights into pancreatic cancer biology . Ann Oncol. 2012; ; 23 : (suppl 10) :x135.–x138. 2.
Argiles JM, Busquets S, Stemmler B, Lopez-Soriano FJ Cancer cachexia: understanding the molecular basis . Nat Rev Cancer. 2014; ; 14 : :754.–762. 3.
Aguirre AJ, Bardeesy N, Sinha M, et al. Activated Kras and Ink4a/Arf deficiency cooperate to produce metastatic pancreatic ductal adenocarcinoma . Genes Dev. 2003; ; 17 : :3112.–3126. 4.
Guillaumond F, Leca J, Olivares O, et al. Strengthened glycolysis under hypoxia supports tumor symbiosis and hexosamine biosynthesis in pancreatic adenocarcinoma . Proc Natl Acad Sci USA. 2013; ; 110 : :3919.–3924. 5.
Bryant KL, Mancias JD, Kimmelman AC, Der CJ KRAS: feeding pancreatic cancer proliferation . Trends Biochem Sci. 2014; ; 39 : :91.–100. 6.
Guillaumond F, Bidaut G, Ouaissi M, et al. Cholesterol uptake disruption, in association with chemotherapy, is a promising combined metabolic therapy for pancreatic adenocarcinoma . Proc Natl Acad Sci USA. 2015; ; 112 : :2473.–2478. 7.
Hong JY, Nam EM, Lee J, et al. Randomized double-blinded, placebo-controlled phase II trial of simvastatin and gemcitabine in advanced pancreatic cancer patients . Cancer Chemother Pharmacol. 2014; ; 73 : :125.–130. 8.
Adachi S, Homoto M, Tanaka R, et al. ZFP36L1 and ZFP36L2 control LDLR mRNA stability via the ERK-RSK pathway . Nucleic Acids Res. 2014; ; 42 : :10037.–10049. 9.
Zelcer N, Hong C, Boyadjian R, Tontonoz P LXR regulates cholesterol uptake through Idol-dependent ubiquitination of the LDL receptor . Science. 2009; ; 325 : :100.–104. 10.
Wang Y, Huang Y, Hobbs HH, Cohen JC Molecular characterization of proprotein convertase subtilisin/kexin type 9-mediated degradation of the LDLR . J Lipid Res. 2012; ; 53 : :1932.–1943. 11.
Bournet B, Dufresne M, Selves J, et al. Oncogène Kras et cancer du pancréas : trente ans plus tard . Med Sci (Paris). 2013; ; 29 : :991.–997. |