| |
| Med Sci (Paris). 2015 August; 31(8-9): 777–783. Published online 2015 September 4. doi: 10.1051/medsci/20153108017.Nouvelles stratégies d’analyse endoscopique des maladies digestives Lucille Quénéhervé,1,2** Michel Neunlist,2 Stanislas Bruley des Varannes,1,2 Guillermo Tearney,3 and Emmanuel Coron1,2* 1Institut des maladies de l’appareil digestif, CHU de Nantes, hôpital Hôtel-Dieu, 1, place Alexis Ricordeau, F-44093Nantes, France 2Inserm U913, F-44093Nantes, France 3Harvard medical school et Wellman center for photo-medicine, Massachusetts general hospital, 55 Fruit street, Boston, MA02114, États-Unis |
L’exploration du tube digestif par endoscopie permet de visualiser la muqueuse de différents organes et de réaliser des biopsies, voire des gestes thérapeutiques, au cours de l’examen. Malgré d’importants progrès (haute définition, zooms, etc.), cette endoscopie « classique » reste limitée à un niveau de grossissement relativement faible, en surface, et sans possibilité d’analyse fonctionnelle fine du tissu exploré. Or, l’étude de la paroi du tube digestif et de ses constituants est centrale dans l’établissement du diagnostic et du pronostic des maladies de l’appareil digestif, et nécessite des développements technologiques dans trois grands types de pathologies. Premièrement, la détection des lésions précancéreuses de l’épithélium digestif est un enjeu majeur en santé publique, car ces lésions augmentent fortement le risque de développer un cancer. Ainsi, le risque de développer un cancer du côlon, qui est le 3e cancer le plus fréquent dans le monde (et touche en France 34 000 nouveaux patients chaque année), est multiplié par quatre en cas d’adénome colique. Moins connu mais de pronostic plus sévère, l’adénocarcinome œsophagien a vu son incidence être multipliée par six au cours des 20 dernières années. Cela souligne l’importance de détecter précocement les patients atteints d’endobrachyœsophage, lésion précancéreuse reconnue de l’adénocarcinome œsophagien, et surtout de stratifier ceux qui sont à risque de développer, ou non, un cancer. Deuxièmement, au-delà du terrain de développement des lésions précancéreuses, le tube digestif doit être considéré comme une véritable interface entre le milieu extérieur et l’organisme. En effet, il favorise l’absorption des nutriments tout en limitant le passage des pathogènes et toxines, ce qui suppose que la couche de cellules épithéliales qui le tapisse ait un rôle de barrière finement régulée. De nombreuses pathologies digestives et extradigestives sont caractérisées par une augmentation de la perméabilité de cette barrière épithéliale intestinale, comme au cours des infections par des microorganismes pathogènes [1]. Certaines pathologies inflammatoires du tube digestif sont également caractérisées par des troubles de la perméabilité, bien que les mécanismes physiopathologiques mis en jeu soient en réalité complexes et multiples (terrain génétique, environnement, flore intestinale, etc.). Une meilleure compréhension des mécanismes mis en jeu, notamment via une meilleure caractérisation de l’atteinte fonctionnelle in vivo, permettrait probablement de mieux prédire la réponse thérapeutique et l’évolution clinique des patients. Cela concerne non seulement les atteintes dysimmunitaires comme la maladie de Crohn ou la rectocolite hémorragique, mais également les atteintes inflammatoires induites par des traitements tels que les chimiothérapies ou la greffe de moelle osseuse. Troisièmement, le tube digestif possède également son système nerveux propre, le système nerveux entérique (SNE). Ce système s’étend sur toute la longueur du tube digestif et régit, de manière autonome, non seulement la motricité digestive, mais également les fonctions de sécrétion, de vascularisation et d’immunomodulation de la barrière épithéliale. Ainsi, plusieurs études ont démontré que des altérations du système nerveux entérique sont associées à des dysfonctionnements de la barrière épithéliale. L’exploration du système nerveux entérique est donc nécessaire pour mieux comprendre les implications de ce nouvel acteur dans la physiopathologie de ces maladies, et développer de nouvelles approches thérapeutiques. Dans cette revue, nous détaillerons les enjeux des développements en endoscopie diagnostique, ainsi que les nouvelles stratégies d’analyse endoscopique (Figure 1), en les illustrant par différents exemples concrets de pathologies digestives concernant chacun de ces trois grands domaines.
 | Figure 1.
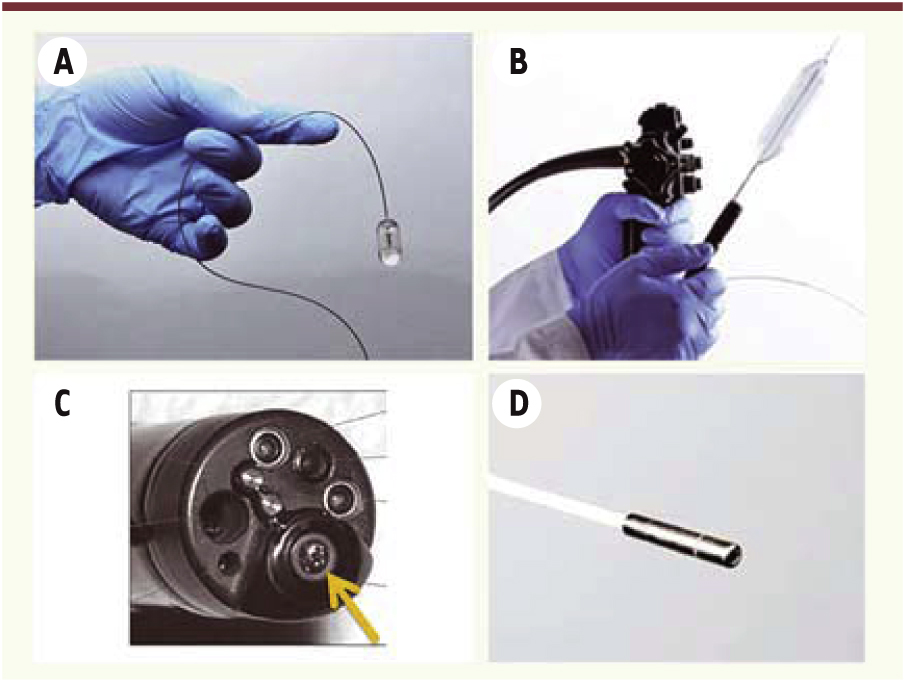
Nouvelles modalités développées pour l’exploration endoscopique chez l’homme afin de permettre une exploration microscopique in vivo et en temps réel (A-D). Technique dite d’optical frequency domain imaging (OFDI) développée sous la forme de vidéocapsule (A) ou de ballon (B) pour l’exploration de l’œsophage. Endomicroscopie confocale laser intégrée à l’endoscope (C). Endomicroscopie confocale laser fibrée destinée à passer par le canal opérateur d’un endoscope standard ou une aiguille de ponction (C). |
|
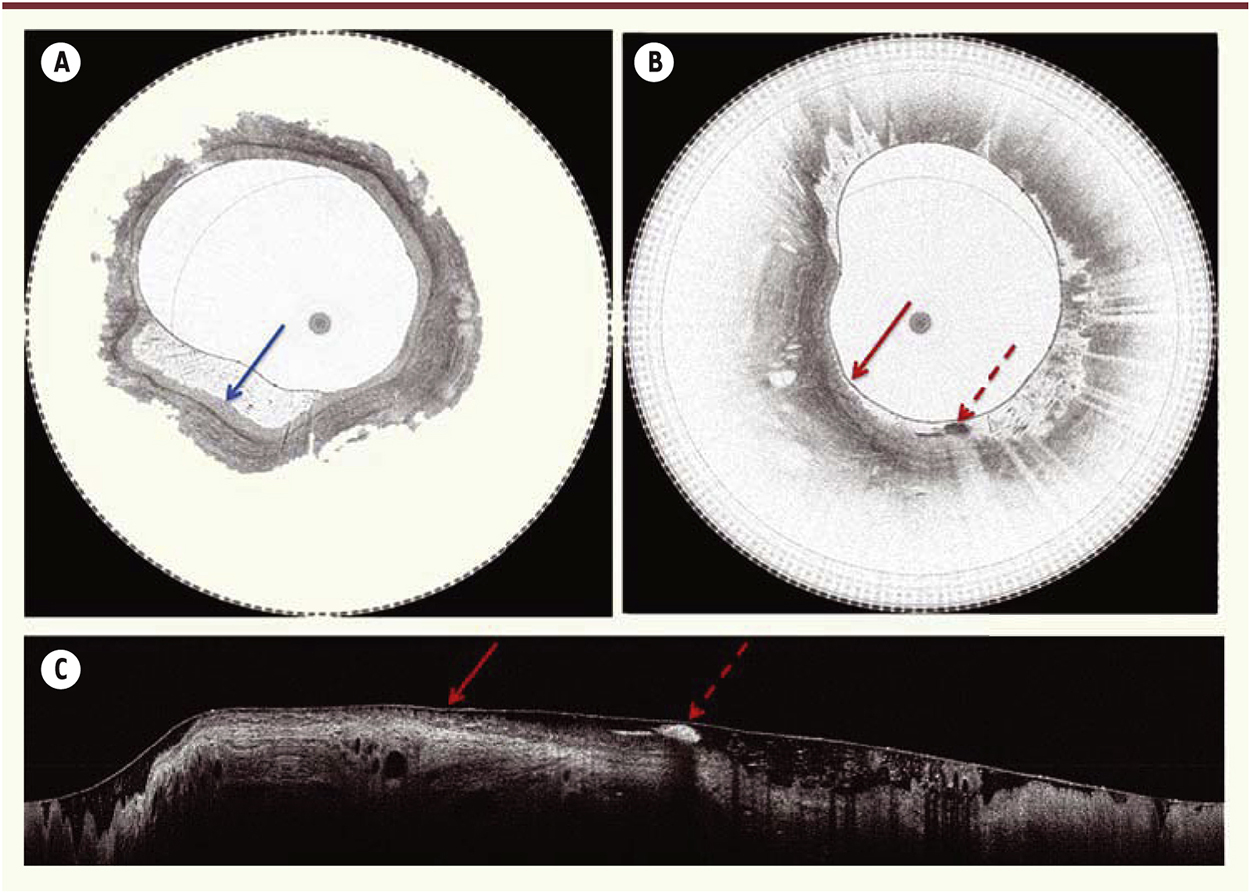
L’endobrachyœsophage : un modèle de pathologie précancéreuse L’endobrachyœsophage se définit par le remplacement de la muqueuse malpighienne de l’œsophage distal par une muqueuse glandulaire, aussi appelée métaplasie. Sa survenue est associée à l’existence d’un reflux gastro-œsophagien ancien. La surveillance endoscopique de l’endobrachyœsophage est recommandée afin de dépister précocement la survenue de lésions néoplasiques et de proposer au patient une prise en charge curative la moins invasive possible [2]. Un problème majeur est que la plupart des endobrachyœsophages ne sont pas diagnostiqués. En effet, une grande partie des patients sont asymptomatiques, et, chez ceux qui ont des symptômes de reflux gastro-œsophagien, un traitement empirique est souvent préféré à la réalisation d’une endoscopie. Il est donc important de développer des outils très peu invasifs tels que la vidéocapsule et les techniques qui en sont inspirées. Ainsi l’optical frequency domain imaging (OFDI) est une méthode dérivée de la tomographie par cohérence optique (OCT) qui permet, en temps réel, d’obtenir des images de la microstructure d’un tissu à la fois en surface et en profondeur. Incorporée dans une capsule ingérable par le patient (Figure 1A), elle a récemment été utilisée par une équipe du Massachusetts general hospital (Boston) chez 24 patients [3, 4]. L’examen durait en moyenne cinq minutes. Il permettait d’obtenir des images de bonne qualité dans 93 % des cas, corrélées avec les résultats des prélèvements obtenus par endoscopie, et n’entraînait aucune complication (Figure 2). Une étude réalisée avec une version antérieure du système, sur 45 images de muqueuse œsophagienne normale, de muqueuse gastrique et d’endobrachyœsophage, avait également montré qu’il était possible de distinguer l’endobrachyœsophage de la muqueuse œsophagienne normale avec une excellente concordance entre observateurs (kappa = 0,811 ; p < 0,0001) et intra-observateur (kappa = 0,975) [5]. Au total, ces résultats sont très prometteurs dans une perspective de dépistage en population, puisque cette technique peu invasive est facilement acceptable par le patient et a un coût modéré grâce à la réutilisation possible de la capsule après désinfection.
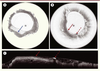 | Figure 2.
A-C. Images obtenues avec le ballon OFDI. Chez un patient ayant un œsophage normal, cette image montre un épithélium malpighien avec un aspect régulier de la surface épithéliale (flèche) (A). Chez un patient ayant un endobrachyœsophage (EBO) au stade de dysplasie de haut grade (DHG) (B), cette image montre la métaplasie glandulaire sous la forme d’un aspect crénelé de la surface épithéliale (flèche pleine) avec présence de 2 foyers de dysplasie de haut grade (flèche pointillée). C. Aspect en reconstruction longitudinale (dans le même axe que les coupes histologiques « standard ») de l’image précédente (B). |
Une fois l’endobrachyœsophage découvert, un deuxième problème est celui du suivi, limité par la difficulté à distinguer, en endoscopie classique à lumière blanche, les zones dysplasiques et cancéreuses. En effet, lors de la réalisation de biopsies aléatoires, le risque est important de prélever des zones saines et de négliger les zones atteintes (erreur d’échantillonnage). Plusieurs techniques existent, à différents stades de développement, pour tenter de limiter ce risque. On en distingue deux grands types : d’une part les techniques basées sur l’OFDI, qui permettent un examen en champ large et sont encore en cours de développement, et, d’autre part, les techniques d’endomicroscopie confocale (EMC), d’ores et déjà développées et en cours de validation clinique. Outre sous la forme d’une vidéocapsule, l’OFDI a été développée aussi sous la forme d’un ballon, une technique également appelée volumetric laser endomicroscopy (VLE) (Figure 1B). Ce ballon, placé dans l’œsophage au cours d’une endoscopie, permet de scanner l’ensemble de l’endobrachyœsophage afin de guider la réalisation de biopsies. Ainsi, dans une étude pilote portant sur 22 patients, il a été possible à la fois de visualiser la microstructure de l’endobrachyœsophage et de placer des marques en augmentant la puissance du laser utilisé pour l’OFDI. Cette technique permet de réaliser des biopsies ciblées sur les zones d’intérêt [6]. Cette modalité de marquage « intelligent » est particulièrement séduisante, car l’OFDI a déjà montré son intérêt dans une étude internationale américaine et française [5]. L’autre type de technologie est l’endomicroscopie confocale. Il s’agit d’une technique d’imagerie microscopique permettant une histologie en temps réel réalisée au cours d’une endoscopie digestive, soit en étant intégrée à l’endoscope, soit via une fibre passée par le canal opérateur de l’endoscope ou par une aiguille de ponction (Figure 1C–D). Contrairement à l’OFDI, qui ne nécessite aucun agent de contraste, l’EMC nécessite l’injection de fluorescéine intraveineuse au cours de l’examen afin de rendre les cellules fluorescentes et donc détectables par l’appareil. Ses performances diagnostiques sont excellentes et elle a prouvé son intérêt dans le dépistage de la dysplasie de haut grade et de l’adénocarcinome dans deux études multicentriques randomisées contrôlées. La première étude, menée dans plusieurs centres européens et américains, évaluait l’intérêt de l’EMC par minisonde chez 101 patients pour la détection de la dysplasie de haut grade ou d’adénocarcinome [7]. Alors que la sensibilité et la spécificité de l’examen en lumière blanche seule étaient respectivement de 34,2 % et de 92,7 %, elles atteignaient 68,3 % et 87,8 % (p < 0,05) lors de l’association à l’EMC. La seconde étude portait sur 192 patients et comparait l’examen en lumière blanche à l’association de ce dernier à l’EMC intégrée dans un endoscope dédié [8]. Le rendement diagnostique passait de 7 % à 34 % avec un plus faible nombre de biopsies muqueuses en cas d’association des deux examens. La sensibilité pour la détection de lésions néoplasiques passait de 40 % à 96 %, et l’EMC changeait la prise en charge thérapeutique chez 36 % des patients. En outre, la concordance entre observateurs est bonne (kappa = 0,72) pour le diagnostic d’endobrachyœsophage, de dysplasie de haut grade et de carcinome invasif comme cela a été démontré dans une autre étude internationale [9]. |
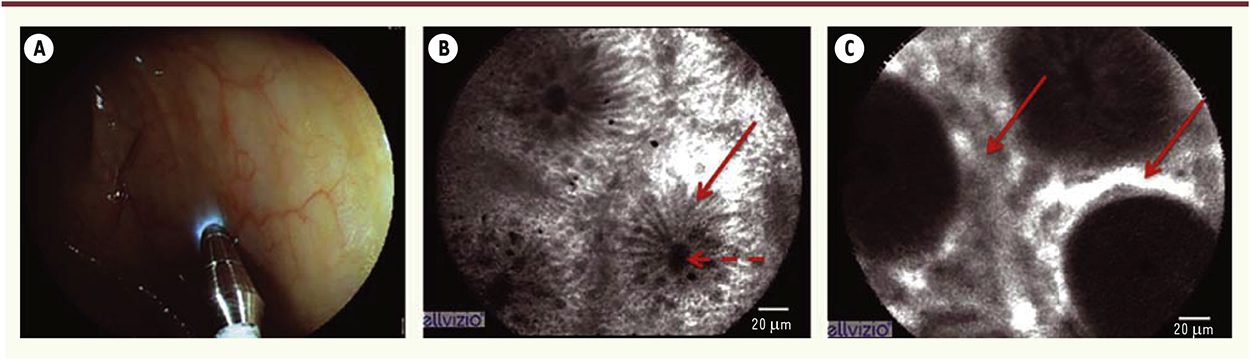
Les pathologies inflammatoires du tube digestif L’évaluation du niveau d’inflammation de la muqueuse digestive est un enjeu majeur dans de multiples pathologies digestives, car elle répond à un triple objectif : (1) permettre un diagnostic de sévérité, (2) prédire l’évolution de la maladie en termes de rechutes ou de risque de complications, et (3) guider le choix du traitement. Or, l’évaluation endoscopique selon les modalités classiques, c’est-à-dire en lumière blanche seule, a un faible rendement diagnostique. En effet, elle est pénalisée à la fois par une résolution insuffisante en termes d’imagerie et par la taille des segments digestifs explorés qui expose à un risque majeur d’erreur d’échantillonnage. Dès lors, il est nécessaire de proposer des techniques permettant à la fois une exploration à l’échelon microscopique et la réalisation d’une cartographie très rapide par un grand nombre de biopsies optiques. Les maladies inflammatoires chroniques de l’intestin (MICI) constituent évidemment le champ privilégié d’application de ces techniques nouvelles. En effet, les MICI, qui comportent la maladie de Crohn et la rectocolite hémorragique, touchent généralement des patients jeunes qui, du fait de l’évolution chronique par poussées de ces pathologies, devront bénéficier d’un suivi au long cours. On sait désormais que les rechutes et les complications de ces pathologies sont plus fréquentes lorsque persiste une inflammation résiduelle entre les poussées, même lorsque celle-ci est exempte de symptômes. La détection précoce de cette inflammation résiduelle pourrait dès lors justifier de l’intensification du traitement afin de parvenir à la cicatrisation de la muqueuse [10]. Pour répondre à l’objectif diagnostique, le concept d’évaluation du degré d’inflammation muqueuse par EMC peut s’envisager sous la forme d’une évaluation non seulement morphologique, mais également fonctionnelle. Ainsi, sur le plan morphologique, une étude française a permis d’identifier des critères quantitatifs (donc aisément reproductibles) d’évaluation de l’inflammation en EMC chez des patients atteints de maladie de Crohn en rémission clinique [11]. Cette analyse était basée sur la mesure des cryptes coliques (Figure 3). Chez les patients ayant une inflammation microscopique résiduelle, on observait une distorsion des cryptes en EMC avec une valeur-seuil établie à 1,7 (diamètre grand axe/petit axe) par rapport aux contrôles. Cette étude conforte donc, avec une nouvelle approche quantitative, les résultats d’autres études plus anciennes montrant les bonnes performances de l’EMC pour évaluer le degré d’inflammation dans les MICI [12].
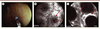 | Figure 3.
A-C. Endomicroscopie confocale par fibre chez un patient atteint de maladie de Crohn. L’application de la fibre d’endomicroscopie sur la muqueuse colique pendant la coloscopie (A) permet de visualiser l’épithélium (flèche pleine) ainsi que les orifices des glandes coliques (flèche pointillée) à l’échelon microscopique en temps réel (B). L’EMC permet également de visualiser les capillaires péricryptiques (flèche pleine) et d’analyser les flux vasculaires (C). |
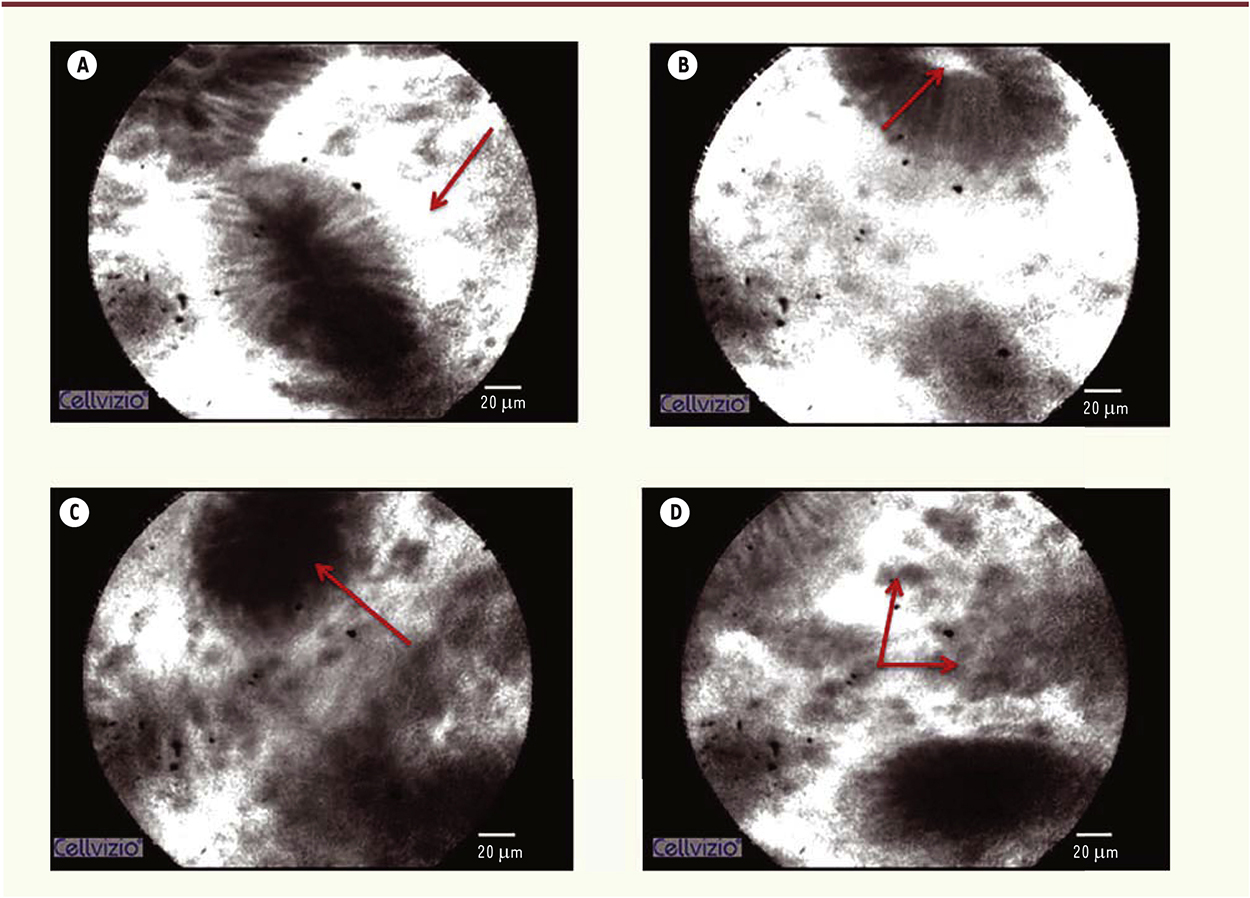
Sur le plan fonctionnel, il est intéressant de rappeler que les MICI sont caractérisées par une augmentation de la perméabilité intestinale, traduisant une altération de la barrière épithéliale. Cette perméabilité accrue est retrouvée chez les patients - en poussée ou non de leur maladie - et son apparition n’est donc pas conditionnée par l’inflammation seule. Son rôle dans la physiopathologie de la maladie est encore mal compris mais passe sans doute par un dysfonctionnement des interactions de la barrière avec le contenu digestif (pathogènes, microbiote, aliments, etc.). Dès lors, la mesure de la perméabilité intestinale in vivo comme reflet des fonctions de la barrière épithéliale est d’un grand intérêt. L’EMC, grâce à sa résolution et son caractère dynamique, est une technique très prometteuse pour réaliser cette évaluation fonctionnelle, pouvant aller jusqu’à la visualisation de phénomènes de desquamation de cellules épithéliales pendant le geste endoscopique (Figure 4). Ainsi, l’étude de Lim et al. a permis de mettre en évidence une augmentation de la desquamation, des espaces intercellulaires et de la fuite de fluorescéine, observées en EMC au niveau duodénal chez des patients atteints de maladie de Crohn et de rectocolite hémorragique [13]. Ces résultats suggèrent donc l’existence d’altérations diffuses de la barrière épithéliale intestinale au cours des MICI. Ils confirment également la capacité de l’EMC à évaluer in vivo ces altérations et son rôle potentiel quant à la prédiction de l’évolution clinique chez ces patients, ce qui correspond au deuxième objectif à atteindre au cours des MICI [14].
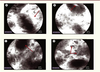 | Figure 4.
Altérations fonctionnelles de la barrière épithéliale intestinale au cours des maladies inflammatoires chroniques intestinales, visualisées par endomicroscopie confocale. Fuite de fluorescéine dans la lamina propria
(A) et dans la lumière des cryptes coliques (B), avec diminution des cellules caliciformes (C) et infiltrat cellulaire de la lamina propria
(D). |
Le troisième objectif, correspondant au choix du traitement, concerne principalement les biothérapies utilisant des anticorps monoclonaux dirigés contre des cytokines pro-inflammatoires, dont le TNF-α (tumor necrosis factor α) est le chef de file. En effet, l’évaluation de la réponse au traitement est cruciale pour adapter la stratégie thérapeutique, puisque certains patients ne répondent pas au traitement par anti-TNF-α et sont alors exposés à ses effets indésirables, sans bénéficier pour autant d’une cicatrisation de la muqueuse. La recherche de biomarqueurs prédictifs de la réponse thérapeutique a ainsi mené une équipe allemande à explorer le concept d’immunohistochimie in vivo par EMC. Cette équipe a appliqué un anticorps anti-TNF-α humanisé, l’adalimumab, couplé à un fluorochrome, sur la muqueuse colique de patients atteints de maladie de Crohn au cours d’une coloscopie [15]. L’EMC a permis de détecter et de quantifier les cellules cibles exprimant le TNF membranaire (mTNF+), dont la forme soluble est sécrétée après clivage protéolytique. Les patients ont ensuite été traités par adalimumab et la réponse clinique après trois mois a été évaluée. De façon intéressante, non seulement les patients ayant un fort taux de cellules mTNF+ répondaient beaucoup mieux au traitement par anti-TNF-α que les patients chez lesquels ce taux était faible (92 % de réponses contre 15 %), mais cette bonne réponse clinique se maintenait à 1 an. Un autre exemple de pathologie digestive pour laquelle l’évaluation de l’atteinte muqueuse est capitale est celui de la maladie du greffon contre l’hôte (graft-versus-host disease). Au cours de la maladie du greffon contre l’hôte, les cellules immunitaires provenant du greffon entraînent des lésions du tube digestif du patient receveur. Ces lésions sont difficiles à détecter, car elles atteignent de façon très aléatoire et souvent focale différents segments du tube digestif. De plus, ces patients fragiles sont exposés au caractère vulnérant des biopsies digestives (hémorragies, perforations) en raison de fréquents troubles de l’hémostase et de l’immunosuppression induite pour limiter le risque de rejet. Dès lors, il est capital d’utiliser les méthodes les moins invasives possibles pour en faire le diagnostic et guider le traitement. La combinaison de l’EMC à la vidéocapsule pourrait, par exemple, permettre à la fois d’explorer de larges segments du tube digestif et de réaliser une exploration minutieuse à l’échelon microscopique. Une étude pilote a suggéré les bonnes performances de cette combinaison pour détecter, avant la survenue des symptômes, l’existence de lésions évocatrices de maladie du greffon contre l’hôte et moduler ainsi le traitement immunosuppresseur de manière adéquate [16]. |
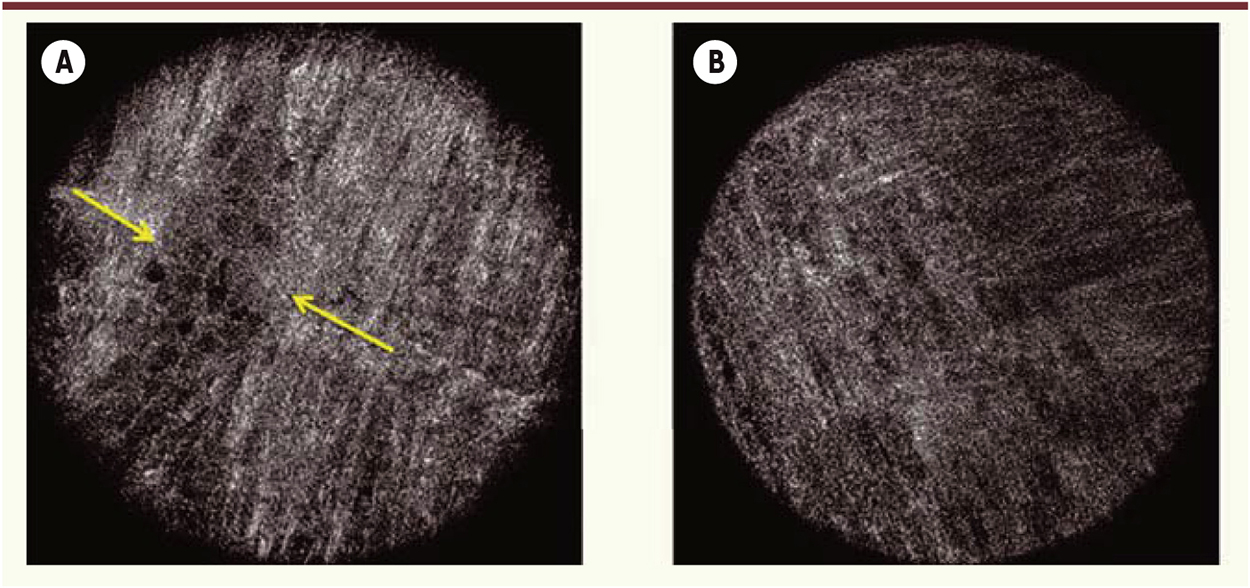
Les neuropathies entériques Au-delà de l’exploration de la muqueuse, l’un des enjeux majeurs de l’endoscopie innovante est d’améliorer la compréhension des pathologies digestives en permettant l’accès aux autres composantes de la paroi digestive, et notamment au système nerveux entérique. Véritable « cerveau dans l’intestin », ce dernier est un système nerveux autonome réparti tout le long du tube digestif et capable de réguler ses principales fonctions. L’élément clé de cette régulation est l’unité neuro-glio-épithéliale, qui associe étroitement les éléments cellulaires du système nerveux entérique (neurones et cellules gliales) et les cellules épithéliales digestives [17]. Or, même si elle n’est pas évaluée en pratique courante, cette unité neuro-glio-épithéliale est directement accessible au moyen de biopsies « de routine » prélevées au cours d’une coloscopie. Cette approche est susceptible de révolutionner non seulement la compréhension des maladies digestives, mais également des maladies neurologiques, en utilisant le système nerveux entérique comme une véritable « fenêtre sur le cerveau ». Par exemple, la maladie de Parkinson est caractérisée par la présence de lésions caractéristiques au niveau du système nerveux central, notamment les corps de Lewy. Or, il a récemment été mis en évidence que ces lésions existent également à un stade précoce au niveau du système nerveux entérique, et que la charge lésionnelle, à ce niveau, est corrélée à la réponse au traitement par la dopamine (déficiente dans la maladie de Parkinson). Ainsi, des études cliniques suggèrent l’utilité des biopsies coliques pour réaliser un diagnostic préclinique de la maladie de Parkinson et prédire la réponse au traitement [18, 19]. Ces biopsies de routine ne permettent qu’une exploration limitée au plexus sous-muqueux, qui est le plexus le plus superficiel du système nerveux entérique ; elles ne permettent pas d’accéder au plexus myentérique et à la jonction neuromusculaire. À l’heure actuelle, la méthode de référence pour étudier les maladies neuromusculaires gastro-intestinales repose donc sur la chirurgie afin d’obtenir des biopsies panpariétales. Cependant, de nouvelles techniques endoscopiques pourraient constituer une alternative très faiblement invasive à l’approche chirurgicale. Une première possibilité est la réalisation de biopsies panpariétales endoscopiques pour étudier le plexus myentérique de manière morphologique et fonctionnelle. La preuve de concept en a été récemment apportée par une étude française réalisée dans un modèle animal. En effet, la résection panpariétale par macrobiopsie endoscopique chez le porc permettait à la fois la caractérisation immunohistochimique des ganglions myentériques et l’évaluation fonctionnelle de la transmission neuromusculaire [20]. Malgré l’intérêt de cette approche morpho-fonctionnelle, l’application de cette technique à l’homme reste à ce jour incertaine en raison des risques de complications liées à la technique de résection. Une deuxième possibilité est donc l’exploitation des progrès optiques permettant l’obtention d’une imagerie du système nerveux entérique de manière très peu invasive et panpariétale. Par exemple, une nouvelle technique, la microscopie à cohérence optique plein champ (full-field optical coherence microscopy, FFOCM) associe les capacités de section axiale de l’OCT à la résolution transverse de la microscopie confocale [21]. Dans une étude franco-américaine, la FFOCM a permis, sans injection préalable de fluorophore, de visualiser les ganglions myentériques et d’autres constituants de la paroi colique (Figure 5) et de déterminer, dans un modèle murin de maladie de Hirschsprung1, l’extension de l’atteinte aganglionnaire [22]. À terme, si cette méthode était développée sous forme d’outils endoscopiques ou chirurgicaux, elle pourrait guider le geste chirurgical chez des patients ayant une atteinte myentérique.
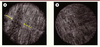 | Figure 5.
Microscopie par cohérence optique « plein champ ». Prototype développé au Wellman Center for Photomedicine (Massachusetts General Hospital, Boston, États-Unis) permettant de visualiser sans injection de fluorophore préablable un ganglion myentérique (entre les flèches) à l’interface des couches musculaires circulaire et longitudinale dans un tissu sain (A), comparativement à l’absence de ganglion visible dans cette zone dans un modèle murin de maladie de Hirschsprung (B). |
|
Ces nouvelles stratégies endoscopiques d’analyse optique de la muqueuse, qu’elles soient basées sur la fluorescence par laser (EMC) ou sur l’amélioration des techniques de cohérence optique (OFDI), sont susceptibles de révolutionner la prise en charge des pathologies digestives. Ainsi, elles permettront à terme d’améliorer le dépistage et la caractérisation des pathologies précancéreuses, d’identifier des biomarqueurs d’évolution dans les maladies inflammatoires et de guider le choix du traitement. Bien que toujours en cours d’évaluation dans des protocoles de recherche clinique, leur implantation en pratique courante est grandissante en raison des résultats positifs des essais publiés, de leur relative facilité d’utilisation et de leur bonne concordance inter-observateur. |
Emmanuel Coron déclare participer à des activités de conseil pour l’entreprise Mauna Kea Technologies.
Lucille Quénéhervé, Michel Neunlist, Stanislas Bruley des Varannes, Guillermo Tearney déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
|
EBO :
|
endobrachyoesophage |
|
EMC :
|
endomicroscopie confocale |
|
FFOCM :
|
full-field optical coherence microscopy |
|
GVHD :
|
graft versus host disease |
|
MC :
|
maladie de Crohn |
|
MICI :
|
maladies inflammatoires chroniques de l’intestin |
|
mTNF :
|
tumor necrosis factor membranaire |
|
OCT :
|
optical coherence tomography |
|
OFDI :
|
optical frequency domain imaging |
|
RCH :
|
rectocolite hémorragique |
|
SNE :
|
système nerveux entérique |
|
TNF-α :
|
tumor necrosis factor α |
|
VLE :
|
volumetric laser endomicroscopy |
|
Footnotes |
1.
Coron E, Flamant M, Aubert P, et al. Characterisation of early mucosal and neuronal lesions following Shigella flexneri infection in human colon . PLoS One. 2009; ; 4 : :e4713.. 2.
Coron E, Robaszkiewicz M, Chatelain D, et al. Advanced precancerous lesions in the lower oesophageal mucosa: high-grade dysplasia and intramucosal carcinoma in Barrett’s oesophagus . Best Pract Res Clin Gastroenterol. 2013; ; 27 : :187.–204. 3.
Gora MJ, Sauk JS, Carruth RW, et al. Imaging the upper gastrointestinal tract in unsedated patients using tethered capsule endomicroscopy . Gastroenterology. 2013; ; 145 : :723.–725. 4.
Gora MJ, Sauk JS, Carruth RW, et al. Tethered capsule endomicroscopy enables less invasive imaging of gastrointestinal tract microstructure . Nat Med. 2013; ; 19 : :238.–240. 5.
Sauk J, Coron E, Kava L, et al. Interobserver agreement for the detection of Barrett’s esophagus with optical frequency domain imaging . Dig Dis Sci. 2013; ; 58 : :2261.–2265. 6.
Suter MJ, Gora MJ, Lauwers GY, et al. Esophageal-guided biopsy with volumetric laser endomicroscopy and laser cautery marking: a pilot clinical study . Gastrointest Endosc. 2014; ; 79 : :886.–896. 7.
Sharma P, Meining AR, Coron E, et al. Real-time increased detection of neoplastic tissue in Barrett’s esophagus with probe-based confocal laser endomicroscopy: final results of an international multicenter, prospective, randomized, controlled trial . Gastrointest Endosc. 2011; ; 74 : :465.–472. 8.
Canto MI, Anandasabapathy S, Brugge W, et al. In vivo endomicroscopy improves detection of Barrett’s esophagus–related neoplasia: a multicenter international randomized controlled trial (with video) . Gastrointest Endosc. 2014; ; 79 : :211.–221. 9.
Wallace MB, Sharma P, Lightdale C, et al. Preliminary accuracy and interobserver agreement for the detection of intraepithelial neoplasia in Barrett’s esophagus with probe-based confocal laser endomicroscopy . Gastrointest Endosc. 2010; ; 72 : :19.–24. 10.
Peyrin-Biroulet L, Ferrante M, Magro F, et al. Results from the 2nd scientific workshop of the ECCO. I: impact of mucosal healing on the course of inflammatory bowel disease . J Crohns Colitis. 2011; ; 5 : :477.–483. 11.
Musquer N, Coquenlorge S, Bourreille A, et al. Probe-based confocal laser endomicroscopy: a new method for quantitative analysis of pit structure in healthy and Crohn’s disease patients . Dig Liver Dis. 2013; ; 45 : :487.–492. 12.
Kiesslich R, Goetz M, Lammersdorf K, et al. Chromoscopy-guided endomicroscopy increases the diagnostic yield of intraepithelial neoplasia in ulcerative colitis . Gastroenterology. 2007; ; 132 : :874.–882. 13.
Lim LG, Neumann J, Hansen T, et al. Confocal endomicroscopy identifies loss of local barrier function in the duodenum of patients with Crohn’s disease and ulcerative colitis . Inflamm Bowel Dis. 2014; ; 20 : :892.–900. 14.
Kiesslich R, Duckworth CA, Moussata D, et al. Local barrier dysfunction identified by confocal laser endomicroscopy predicts relapse in inflammatory bowel disease . Gut. 2012; ; 61 : :1146.–1153. 15.
Atreya R, Neumann H, Neufert C, et al. In vivo imaging using fluorescent antibodies to tumor necrosis factor predicts therapeutic response in Crohn’s disease . Nat Med. 2014; ; 20 : :313.–318. 16.
Coron E, Laurent V, Malard F, et al. Early detection of acute graft-versus-host disease by wireless capsule endoscopy and probe-based confocal laser endo-microscopy: results of a pilot study . United Eur Gastroenterol J. 2014; ; 2 : :206.–215. 17.
Neunlist M, Van Landeghem L, Mahé MM, et al. The digestive neuronal-glial-epithelial unit: a new actor in gut health and disease . Nat Rev Gastroenterol Hepatol. 2012; ; 10 : :90.–100. 18.
Lebouvier T, Neunlist MBruley des Varannes S,et al. Colonic biopsies to assess the neuropathology of Parkinson’s disease and its relationship with symptoms . PLoS One. 2010; ; 5 : :e12728.. 19.
Lebouvier T, Coron E, Chaumette T, et al. Routine colonic biopsies as a new tool to study the enteric nervous system in living patients . Neurogastroenterol Motil Off J Eur Gastrointest Motil Soc. 2010; ; 22 : :e11.–e14. 20.
Neunlist M, Coquenlorge S, Aubert P, et al. Colonic endoscopic full-thickness biopsies: from the neuropathological analysis of the myenteric plexus to the functional study of neuromuscular transmission . Gastrointest Endosc. 2011; ; 73 : :1029.–1034. 21.
Auksorius E, Bromberg YMotiejunait˙e R, et al. Dual-modality fluorescence and full-field optical coherence microscopy for biomedical imaging applications . Biomed Opt Express. 2012; ; 3 : :661.. 22.
Coron E, Auksorius E, Pieretti A, et al. Full-field optical coherence microscopy is a novel technique for imaging enteric ganglia in the gastrointestinal tract: FFOCM imaging of enteric ganglia . Neurogastroenterol Motil. 2012; ; 24 : :e611.–e621. |