| |
| Med Sci (Paris). 2015 October; 31(10): 841–852. Published online 2015 October 19. doi: 10.1051/medsci/20153110010.Aspects moléculaires des lymphomes T périphériques (1) Lymphome T angio-immunoblastique, lymphome T périphérique non spécifié et lymphome anaplasique à grandes cellules Lucile Couronné,1,2,3* Christian Bastard,4 Philippe Gaulard,5 Olivier Hermine,1,2,3 and Olivier Bernard6** 1Service d’hématologie adultes, Assistance publique-hôpitaux de Paris (APHP), hôpital Necker, Paris, France 2Inserm UMR1163, CNRS ERL 8254, Institut Imagine, Paris, France 3Université Paris Descartes-Sorbonne Paris Cité, Paris, France 4Service d’anatomo-pathologie, AP-HP, groupe hospitalier Henri Mondor-Albert Chenevier, Créteil, France; Université Paris-Est, faculté de médecine, Créteil, France ; Inserm U955, institut Mondor de recherche biomédicale, Créteil, France 5Inserm, U918 ; Université de Rouen ; centre Henri Becquerel, Rouen, France 6UMR 1170 ; Institut Gustave Roussy, 94805Villejuif, France ; Université Paris Sud 11, Orsay, France |
Les trois entités de lymphome T périphérique (LTP) les plus fréquentes sont le lymphome angio-immunoblastique T (LAIT), le lymphome T périphérique non spécifié (LTP-NS) et le lymphome anaplasique à grandes cellules (LAGC). Le LAIT représente, par ordre de fréquence, le deuxième lymphome T périphérique au monde [1] et le premier en Europe de l’Ouest (un tiers des LTP) [2]. Les LTP-NS sont considérés comme les plus hétérogènes des LTP. Leur diagnostic est en réalité un diagnostic d’exclusion des autres LTP. Les LAGC comprennent deux sous-types bien distincts : ceux qui sont associés à un réarrangement du gène ALK
2 et expriment la protéine ALK (ALK+) et ceux qui ne l’expriment pas (ALK-). Les LAIT, LTP-NS et LAGC ALK- sont associés à une survie globale d’environ 30 % à 5 ans [3]. À l’inverse, les LAGC ALK+ se caractérisent par une bonne réponse aux traitements chimiothérapiques conventionnels, et un bon pronostic [3–5] (Tableau I). Tableau I.
| Type |
Prévalence |
| Lymphome T périphérique non spécifié (LTP-NS) |
26 % |
|
| Lymphome T angio-immunoblastique (LAIT) |
18 %*
|
|
| Lymphome NK / T extra-ganglionnaire de type nasal |
10 % |
|
| Leucémie / lymphome T de l’adulte HTLV1+
|
10 % |
|
| Lymphome anaplasique à grandes cellules (LAGC) ALK+
|
7 % |
|
| Lymphome anaplasique à grandes cellules (LAGC) ALK-
|
5 % |
|
| Lymphome T associé à une entéropathie |
5 % |
|
| Lymphome anaplasique à grandes cellules cutané primitif |
2 % |
|
| Lymphome T hépatosplénique |
1 % |
|
| Lymphome T sous-cutané de type panniculite |
1 % |
|
| Autres entités et cas non classés |
15 % |
Prévalence des principales entités de lymphomes T périphériques.
|
|
Lymphome T angio-immunoblastique Présentation clinique et caractéristiques des cellules tumorales Les LAIT affectent le plus souvent des patients d’âge médian entre 60 et 70 ans et se présentent cliniquement par des adénopathies généralisées, une hépatosplénomégalie, des signes généraux (fièvre, perte de poids) et éventuellement d’autres manifestations systémiques telles qu’une éruption cutanée ou des arthralgies. Sur le plan biologique, une hypergammaglobulinémie polyclonale et une anémie hémolytique auto-immune sont fréquemment retrouvées. Les ganglions des LAIT se caractérisent sur le plan histologique par un infiltrat réactionnel important au sein duquel sont identifiés des lymphocytes tumoraux T de taille petite à moyenne. Cet infiltrat se compose aussi d’histiocytes, de cellules épithélioïdes, d’éosinophiles, de plasmocytes et de grandes cellules B souvent infectées par l’EBV (Epstein-Barr virus) [6]. Une hyperplasie des veinules post-capillaires et une prolifération périvasculaire des cellules folliculaires dendritiques sont également des éléments en faveur du diagnostic [6]. Les cellules tumorales de LAIT sont des lymphocytes CD4+CD8-αβ+ n’exprimant que faiblement le CD3, le CD4 ou le CD7 [3]. Elles expriment fréquemment des marqueurs du centre germinatif comme le CD10 [7] et BCL6 [8], et des marqueurs caractéristiques des lymphocytes T folliculaires helper (TFH), tels que la chimiokine CXCL13, les molécules de surface PD1, ICOS, CD200, SAP, et les facteurs de transcription CMAF et ASCL2 [9–13]. Les TFH sont des cellules CD4+CD57+CXCR5+CCR7- présentes dans les centres germinatifs des ganglions ; elles y aident les lymphocytes B lors des dernières étapes de leur maturation [14]. Les études transcriptomiques ont confirmé les résultats de l’immunohistochimie en montrant une signature moléculaire commune entre cellules de LAIT et TFH, suggérant une parenté entre ces deux types cellulaires [15, 16]. Ces observations ont un intérêt pour le diagnostic et la classification. En effet, les marqueurs de TFH, CXCL13, PD1 ou ICOS, sont validés en tant que nouveaux biomarqueurs des LAIT et permettent en particulier de distinguer ce lymphome d’autres entités de LTP [17, 18]. Anomalies cytogénétiques Des aberrations chromosomiques clonales sont observées dans plus de 90 % des cas, principalement des trisomies touchant les chromosomes 5 ou 21, un gain du 3q, du 5q et une perte du 6q [ 19]. Des translocations impliquant le locus du TCR (récepteur à l’antigène des lymphocytes T) sont retrouvées chez 15 % des patients [ 20]. Mutations ponctuelles observées dans les LAIT Récemment, des mutations récurrentes des gènes régulateurs de la méthylation de l’ADN, TET2 [ 21] et DNMT3A, et du gène IDH2, ont été identifiées chez ces patients. Les mutations de TET2 sont observées chez environ 60 à 70 % des patients [22–27] et 2 de ces mutations sont présentes dans presque la moitié des cas [22, 23]. Elles sont réparties sur la totalité du gène et sont de nature inactivatrice (mutations des sites d’épissage, mutations non-sens, faux-sens dans des régions conservées dans l’évolution). Les mutations de DNMT3A surviennent chez 20 à 30 % des patients et sont quasiment toujours associées aux mutations de TET2 [23–25, 27].
IDH2 est muté au niveau du codon R172 chez 20 à 30 % des patients [22, 25, 28], et ces mutations sont souvent associées à celles de TET2 [22, 23]. Les mutations d’IDH2 ont pour effet d’inhiber indirectement les oxydases dépendantes du 2-oxoglutarate et du fer, telles que les protéines de la famille TET [29]. Une mutation récurrente du gène RHOA (G17V) est observée chez environ 70 % des patients [24, 25, 30]. Elle est fréquemment associée aux mutations de TET2 et de DNMT3A [24, 25]. La protéine RHOA fait partie de la famille des petites GTPases qui passent d’un état inactif lié au GDP à un état actif lié au GTP. Elle est impliquée dans nombre de processus cellulaires via l’activation de voies de signalisation variées. Fonctionnellement, la mutation RHOA G17V semble exercer un effet dominant négatif sur l’activité de la protéine normale, aboutissant à une perte de fonction [24, 25, 30]. L’analyse transcriptomique montre que la mutation RHOA G17V est associée à l’activation de voies de signalisation telles que MAPK/ERK, PI3K/AKT, KRAS, RAC1, ou encore la voie alternative d’activation de NFκB [30, 31]. D’un point de vue pronostique, les mutations de TET2 sont associées à une moins bonne survie sans progression [22], mais aucune des anomalies génétiques associées aux LAIT (TET2, DNMT3A, IDH2, RHOA G17V) n’a d’impact discernable sur la survie globale [22, 23, 25, 31]. D’autres anomalies moléculaires sont moins fréquentes (voir
Tableau II
pour une liste de l’ensemble des mutations identifiées dans les LAIT), mais elles sont potentiellement intéressantes pour la compréhension des mécanismes de transformation et le développement de thérapies ciblées. Tableau II.
| Gène |
Conséquence |
Fonction protéique |
Fréquence |
Remarques |
|
|
|
LAIT |
LTP-NS |
|
|
RHOA
|
Gain de fonction - effet dominant négatif |
Petite GTPase/polarisation, migration, contrôle des éléments dynamiques du cytosquelette |
70 % |
20 % |
Point chaud : G17V |
|
|
TET2
|
Perte de fonction |
Oxygénase dépendante du 2-oxoglutarate et du Fe(II)/contrôle de la méthylation de l’ADN |
60-70 % |
20-40 % |
Mutations présentes dans des progéniteurs hématopoïétiques multipotents |
|
|
DNMT3A
|
Perte de fonction-mutant hypomorphe |
DNA méthyltransférase/méthylation de novo durant le développement |
20-30 % |
15-25 % |
Mutations présentes dans des progéniteurs hématopoïétiques multipotents |
|
|
IDH2
|
Gain de fonction |
Isocitrate déhydrogénase dépendante du NADP+/catabolise la transformation de l’isocitrate en 2-oxoglutarate |
20-30 % |
_ |
Point chaud : R172 |
|
|
EP300
|
Perte de fonction |
Histone acétyltransférase/remodelage de la chromatine/activation de la transcription |
6 % |
_ |
|
|
|
STAT3
|
Gain de fonction |
Facteur de transcription/activateur transcriptionnel |
5 % |
_ |
Possible intérêt des inhibiteurs de STAT3 ? |
|
|
TP53
|
ND |
Suppresseur de tumeur/induction de l’apoptose |
5 % |
_ |
Possible intérêt des inhibiteurs de MDM2 ? |
|
|
ETV6
|
Perte de fonction |
Facteur de transcription de la famille des ETS/répresseur transcriptionnel |
4 % |
_ |
|
|
|
FYN
|
Gain de fonction |
SRC kinase/signalisation intracellulaire en amont du TCR, induisant la prolifération et la différenciation T |
3 % |
6 % |
Mutations sensibles au dasatinib, inhibiteur des SRC kinases |
|
|
CD58
|
Perte de fonction |
Interactions entre cellules immunitaires |
< 2 % |
9 % |
Mutations permettant d’échapper à l’immunosurveillance antitumorale. |
|
|
B2M
|
Perte de fonction |
Interactions entre cellules immunitaires |
< 2 % |
_ |
Aussi observées dans des lymphomes de type B |
|
|
JAK2
|
Gain de fonction |
Tyrosine kinase asssociée aux récepteurs de cytokines |
2 % |
_ |
Possible intérêt des inhibiteurs de JAK2 ? |
|
|
CCND3
|
Perte de fonction |
Régulateur des CDK kinases/contrôle la transition G1/S |
2 % |
_ |
|
|
|
TNFSF9
|
Perte de fonction |
Famille des ligands TNF/présentation de l’antigène/génération des cellules T cytotoxiques |
2 % |
_ |
|
|
|
ATM
|
ND |
Impliquée dans les mécanismes de réparation de l’ADN |
< 2 % |
< 2 % |
Gène supresseur de tumeur |
|
|
CDKN2A
|
Perte de fonction |
Contrôle du cycle cellulaire |
_ |
< 2 % |
Gène supresseur de tumeur |
|
|
PRKD2
|
Perte de fonction |
Signalisation intracellulaire en amont du TCR, induisant la prolifération et la différenciation T |
_ |
< 2 % |
|
|
|
RHOT2
|
Perte de fonction |
Famille des RHO GTPases |
_ |
< 2 % |
|
|
|
SMARCAL1
|
Perte de fonction |
Famille SWI/SNIF/remodelage de la chromatine |
_ |
< 2 % |
|
|
|
PRDM1
|
Perte de fonction |
Répresseur transcriptionnel/régulation de la différenciation B |
< 2 % |
_ |
|
Mutations identifiées dans les LAIT et LTP-NS. Les données de ce tableau correspondent aux références [ 22– 28, 30]. ND : non déterminé ; TNF : tumor necrosis factor. |
Des mutations de FYN sont observées dans 3 % des cas [24] et conduisent à une activation de la protéine. FYN appartient au groupe des tyrosines kinases SRC et joue un rôle important dans la signalisation du TCR et l’activation lymphocytaire T. La croissance des cellules exprimant les mutants FYN est inhibée par le dasatinib, un inhibiteur pharmacologique des SRC kinases [24]. Une inactivation biallélique du gène B2M codant la β-2 microglobuline a été rapportée chez un patient [24]. Elle est retrouvée dans 30 % des cas de lymphomes B diffus à grandes cellules, et permet aux cellules d’échapper à l’immunosurveillance tumorale [32]. Enfin, des mutations activatrices de JAK2 et STAT3 et des mutations perte de fonction de CCND3, EP300, PRDM1, TNFSF9 et ETV6 sont observées chez moins de 5 % des patients [23]. Des mutations faux-sens de TP53 sont présentes dans 5 % des cas [23]. Modèle d’oncogenèse ll existe une très forte corrélation entre la présence des mutations RHOA G17V et celle des mutations TET2 et IDH2 [ 24, 25]. Si les mutations TET2 et DNMT3A peuvent être observées dans d’autres cellules hématopoïétiques matures que les lymphocytes T [ 25], et même dans des progéniteurs hématopoïétiques multipotents [ 23, 26, 27], la mutation RHOA G17V, elle, est restreinte à la population tumorale [ 24, 25]. Ceci suggère que les premières surviennent avant celles de RHOA et d’IDH2 dans l’histoire naturelle de la maladie [ 25]. Le processus de pathogenèse semble donc comporter deux étapes principales : un (ou plusieurs) événement(s) (par exemple les mutations de TET2 et/ou DNMT3A) affectant des progéniteurs hématopoïétiques précoces entraînerait la dominance du clone muté, à l’origine d’une hématopoïèse anormale ; puis une deuxième série de mutations (par exemple mutations de RHOA, FYN, ou IDH2), survenant secondairement et possiblement dans des cellules plus matures, conduiraient au phénotype de LAIT (Figure 1).
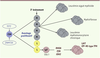 | Figure 1.
Modèle de lymphomagenèse des LAIT et LTP-NS TFH-like. CSH : cellule souche hématopoïétique. M : myéloïde ; L : lymphoïde ; LyT : lymphocyte T. |
De façon intéressante, les mutations de TET2, DNMT3A, IDH2 sont également observées dans les hémopathies myéloïdes (non lymphoïdes) [33]. Or, certains patients porteurs de mutations de TET2 et/ou DNMT3A présentent, séquentiellement ou de façon concomitante, un lymphome T et un syndrome myélodysplasique [27]. Ces différentes observations suggèrent des voies de transformation communes aux lymphoproliférations T et aux hémopathies myéloïdes. Outre les anomalies intrinsèques à la cellule tumorale, le microenvironnement semble également jouer un rôle important dans la pathogenèse de cette maladie puisque près de 90 % de la signature moléculaire caractérisée dans les échantillons de LAIT (sans sélection préalable des cellules tumorales) proviennent des cellules non tumorales [6]. Il existe en effet un réseau complexe d’interactions entre les cellules tumorales de LAIT et les cellules composant le microenvironnement [34–36]3. La modulation du microenvironnement pourrait donc aussi faire partie des stratégies thérapeutiques dans le LAIT. |
Lymphome T périphérique non spécifié Présentation clinique et caractéristiques des cellules tumorales Les LTP-NS concernent souvent des patients de plus de 70 ans et la présentation clinique est variée, le plus souvent sous forme d’adénopathies généralisées, mais un envahissement extraganglionnaire (moelle osseuse, peau, foie, poumons ou tube digestif) est fréquent. Biologiquement, on peut observer une éosinophilie et un syndrome d’activation macrophagique. Dans les ganglions de LTP-NS, les cellules tumorales sont le plus souvent de type CD4+CD8-αβ+CD7-. L’EBV peut être détecté dans une proportion variable de cellules tumorales ainsi que dans des cellules B adjacentes. Une augmentation de la vascularisation et une éosinophilie peuvent également être observées [3, 6]. Sur le plan transcriptomique, les cellules de ces lymphomes semblent se rapprocher de cellules CD4+ ou CD8+ activées : elles se caractérisent par une sous-expression de gènes associés à la prolifération, à l’apoptose, à l’adhésion cellulaire et au remodelage de la matrice extracellulaire, et par une surexpression de la voie PDGFRα [37]. Certains profils semblent corrélés à la survie des patients : la surexpression de la voie NFκB est associée à un bon pronostic [38], contrairement à la surexpression d’une signature de prolifération qui, elle, est de mauvais pronostic [39] On distingue plusieurs sous-entités de LTP-NS. Les LTP-NS dits « cytotoxiques » se caractérisent par l’expression de marqueurs tels que TIA1, granzyme B et perforine [40], et sont associés à un moins bon pronostic [40]. Les LTP-NS de phénotype TFH (expression de CD10 et PD1, prolifération de cellules folliculaires dendritiques CD21+ et/ou CD23+, présence de grandes cellules B positives pour l’EBV [22]) correspondent à un groupe frontière avec les LAIT et se caractérisent par une signature moléculaire enrichie en gènes TFH [15, 16, 41]. Enfin, deux autres sous-groupes ont été récemment été identifiés : l’un regroupe des lymphomes exprimant une signature dite GATA3 avec une surexpression des gènes cibles de ce facteur de transcription, CCR4, IL18RA, CXCR7 et IK (IK cytokine, down regulator of HLA II) ; l’autre exprime une signature dite TBX21, que caractérise une surexpression des gènes cibles CXCR3, IL2RB, CCL3 et IFNg [42]. Le rôle de ces anomalies dans la transformation tumorale est mal connu. GATA3 stimulerait la production de cytokines telles que l’IL(interleukine)-10, l’IL-4 et l’IL-13. Ceci conduirait au développement d’un microenvironnement permissif pour la croissance tumorale via la polarisation des macrophages en macrophages alternatifs de type M2 protumoraux. De plus, GATA3 est connue pour stimuler directement la survie des cellules Th2 et des cellules T CD8+ [43]. Le profil d’expression du groupe GATA3 se caractérise également par un enrichissement en signatures mTOR, MYC et PI3kinase, alors que le groupe TBX21 exprime un profil CD8+ et des signatures IFNa/b/g et NFk B [42]. De façon intéressante, les signatures moléculaires GATA3 et TBX21 sont tout à fait corrélées à la surexpression des protéines correspondantes en immunohistochimie, ce qui pourrait constituer un outil intéressant en routine pour classer les LTP-NS [42]. Les patients atteints d’un LTP du premier sous-groupe GATA3 ont une moins bonne survie (survie globale à 5 ans de 19 %) que ceux du second groupe LTP-NS TBX21 (survie globale à 5 ans de 38 %) [42, 43]. Anomalies cytogénétiques L’étude cytogénétique des LTP-NS retrouve fréquemment des caryotypes complexes. La première translocation à avoir été décrite dans ces lymphomes est la translocation (5;9)(q33;q22), qui fusionne le gène ITK situé sur le chromosome 5 avec le gène SYK localisé sur le chromosome 9 [ 44]. Cette translocation semble associée au variant rare que constitue le LTP-NS folliculaire puisqu’elle est observée chez 20 % des patients présentant ce sous-type [ 45]. Elle a toutefois été rapportée récemment dans de rares cas de LAIT [ 46]. La protéine de fusion résultante est une tyrosine kinase active dont le rôle oncogénique a été établi in vivo. En effet, les souris surexprimant la fusion ITK-SYK développent des lymphomes qui ressemblent aux LTP-NS [ 44]. Une étude avait observé, et ce en dehors de toute translocation, une phosphorylation et une activation de SYK dans plus de 90 % des cas de LTP tous types confondus [ 47], mais cette fréquence n’a pas été confirmée par d’autres groupes [ 48, 49]. Les translocations impliquant le locus du TCR sont très rares dans les LTP-NS [17]. Une translocation impliquant le locus 6p25, la t(6;14)(p25;q11.2), et fusionnant le gène IRF4 au locus du TCR [50], a été rapportée chez deux patients atteints de LTP-NS avec phénotype « cytotoxique ». Enfin, les déséquilibres observés en CGH (comparative genomic hybridization) diffèrent de ceux retrouvés dans les LAIT ou les LAGC. Il s’agit de gains récurrents des 1q, 3p, 5p, 7q, 8q, 17q et 22q et de pertes des 6q, 10p et 13q [19, 51, 52]. Mutations ponctuelles observées dans les LTP-NS Les mutations de TET2 sont identifiées chez 20 à 40 % des patients atteints de LTP-NS [ 22, 24– 26] ; leur fréquence est particulièrement élevée, environ 60 %, dans le sous-groupe des LTP-NS de phénotype TFH [ 22]. Les mutations de DNMT3A sont retrouvées dans 15 à 25 % des cas LTP-NS [24, 25, 27]. La mutation RHOA G17V est retrouvée chez environ 20 % des patients [24, 25] et, compte tenu de son association aux mutations de TET2, elle est également plus fréquemment observée dans les LTP de phénotype TFH (≈ 60 %) [25]. L’observation d’anomalies moléculaires communes dans les lymphomes LAIT et LTP-NS de phénotype TFH renforce l’hypothèse d’une ontogenèse commune de ces deux entités (Figure 1) ; elle peut aussi suggérer que les LTP-NS TFH-like correspondent en réalité à des formes de LAIT riches en cellules tumorales. À la différences des LAIT, aucune mutation d’IDH2 n’est observée dans les LTP-NS [24, 25, 28]. FYN et CD58 sont mutés chez respectivement 6 % et 9 % des patients [24] et, de façon plus anecdotique, des mutations de ATM, CDKN2A, PRKD2, RHOT2 et SMARCAL1 sont rapportées, mais leur fréquence est inférieure à 2 % [24]. Les mutations identifiées dans les LTP-NS sont rapportées dans le
Tableau II
. |
Lymphome anaplasique à grandes cellules ALK + et ALK −LAGC ALK+ Les LAGC ALK + touchent principalement des enfants et de jeunes adultes et se caractérisent cliniquement par de nombreuses adénopathies, des atteintes extra-ganglionnaires fréquentes (peau, os et tissus mous) et la présence de symptômes généraux (fièvre, perte de poids, sueurs nocturnes). Les cellules tumorales sont des cellules de très grande taille, de phénotype ALK+CD30+EMA+, avec un profil CD3- ou CD3+ et une perte fréquente des antigènes lymphocytaires T, alors qu’elles expriment les molécules des grains cytotoxiques4, comme TIA-1, granzyme B et perforine [3]. Sur le plan cytogénétique, les LAGC ALK+ se caractérisent par une translocation impliquant le gène ALK (localisé en 2p23) qui signe le diagnostic. La première décrite, qui est également la plus fréquente, est la translocation t(2;5)(p23;q35) qui fusionne le gène ALK au gène NPM codant la nucléophosmine [53, 54]. D’autres partenaires d’ALK ont par la suite été rapportés [15, 17, 55] (Tableau III). Outre les translocations impliquant le gène ALK, les LAGC ALK+ peuvent présenter d’autres anomalies cytogénétiques telles que des pertes en 4q13-q28, 6q13-q22, 11q14-q23, et 13q, et/ou des gains en 7p11-pter et du chromosome 17 [50, 52, 56–58]. Tableau III.
| Translocation |
Gène partenaire |
Fréquence |
| t(2;5)(p23;q35) |
Nucleophosmin (NPM1)
|
75 % |
|
| t(1;2)(q25;p23) |
Tropomyosin 3 (TPM3)
|
10-20 % |
|
| t(2;3)(p23;q11) |
TRK fused gene (TFG)
|
2-5 % |
|
| inv(2)(p23q35) |
ATIC (Pur H gene)
|
2-5 % |
|
| t(2;17)(p23;q23) |
Clathrin heavy chain (CLTC)
|
2-5 % |
|
| t(2;22)(p23;q11.2) |
Myosin heavy chain (MYH9)
|
rare |
|
| t(2;17)(p23;q23) |
ALK lymphoma oligomerization partner on chromosome 17 (ALO17)
|
rare |
|
| t(2;19)(p23;p13.1) |
Tropomyosin 4 (TPM4)
|
rare |
|
| t(2;X)(p23;q11–12) |
Moesin (MSN)
|
rare |
|
| t(2;9)(p23;q33.2) |
Tumor necrosis factor receptor associated factor 1 (TRAF1)
|
rare |
Translocations impliquant le gène ALK rapportées chez les patients avec lymphome anaplasique à grandes cellules. Les données correspondent aux références [ 17, 55]. |
Les réarrangements de ALK entraînent une activation constitutive de la tyrosine kinase ALK [17], qui conduit à l’activation de multiples voies de signalisation telles que PI3K/AKT/mTOR, JAK/STAT3, ou encore RAS/ERK [59], avec pour conséquences une diminution de l’apoptose et une prolifération accrue des cellules tumorales. L’activation de STAT3 semble jouer un rôle central dans la pathogenèse des LAGC ALK+ [60]. En effet, l’activité oncogénique de cellules ALK+ nécessite la mise en place d’un programme transcriptionnel relayé par STAT3 [61, 62]. Une signature STAT3 peut donc être utilisée pour distinguer les LTP-NS des LAGC ALK+ [59, 62]. L’expression de STAT3 est également sous le contrôle d’un groupe de microARN (cluster 17-92) qui pourrait constituer une cible thérapeutique chez les patients ALK+ [63]. L’activation des voies ERK et mTOR entraîne la transcription des gènes codant les facteurs Jun et JunB, qui conduit à la surexpression dans certains cas du PDGFRβ. L’inhibition du PDGFRβ par l’imatinib5 augmente la survie des souris transgéniques NPM-ALK et agit en synergie avec les inhibiteurs de ALK [64]. L’expression de NPM-ALK est associée à une répression du gène codant le miARN miR-29a, ce qui conduit à la surexpression de la protéine antiapoptotique MCL-1. Ainsi, la surexpression de miR-29a entraîne une réduction de la croissance tumorale dans un modèle de xénogreffe [65]. Enfin, le crizotinib, qui est un inhibiteur de ALK ayant montré son efficacité dans le traitement des formes avancées de cancers du poumon à petites cellules ALK+ [66], semble intéressant sur le plan thérapeutique [67, 68]. LAGC ALK− Présentation clinique et caractéristiques des cellules tumorales Par comparaison avec les LAGC ALK +, les LAGC ALK - affectent des individus plus âgés, et les atteintes extra-ganglionnaires sont moins fréquentes. Les cellules tumorales ont un aspect morphologique et phénotypique (CD30+) identique à celui des cellules ALK+ des LAGC, si ce n’est qu’elles sont ALK-. Les antigènes pan-T sont un peu plus souvent exprimés dans les tumeurs ALK- que dans les tumeurs ALK+. Les analyses transcriptomiques révèlent une signature moléculaire commune entre les lymphomes LAGC ALK+ et ALK, mais elles identifient également un panel de gènes spécifiques à chacun de ces deux sous-types [62, 69, 70] : les LAGC ALK+ expriment HIF1α, IL10, H-ras/K-ras, alors que les LAGC ALK- sont associés à une signature PI3kinase [42]. Les données de transcriptome permettent actuellement de distinguer facilement les LAGC ALK- des LTP-NS par une forte expression, par les premiers, de Myc et des gènes cibles d’IRF4, ainsi qu’une activation de la voie de signalisation mTOR [42, 71]. Réarrangements chromosomiques du locus 6p25 Un réarrangement récurrent du locus 6p25 est présent chez environ 25 % des patients atteints de LAGC ALK -, que les lymphomes soient de type systémique ou cutané 6,. Cette translocation affecte dans 1/3 des cas le gène IRF4 et dans 2/3 des cas le gène DUSP22 [ 50, 56, 57]. Le facteur de transcription IRF4/MUM1 est connu pour être un important régulateur de la différenciation lymphoïde normale, fortement exprimé dans les plasmocytes et les lymphocytes T activés [ 72]. Dans la majorité des translocations impliquant IRF4, le partenaire n’est pas identifié et l’expression d’ IRF4 ne semble pas dérégulée [ 73]. En revanche, quand le gène affecté en 6p25 est DUSP22, son partenaire se situe dans plus de la moitié des cas en 7q32.3, à proximité du site fragile FRA7H et du gène codant pour le microARN MIR-29. La translocation (6;7)(p25.3;q32.3) conduit à la sous-expression de DUSP22 et à la surexpression de MIR-29 [ 73]. Il a également été montré que la présence d’un réarrangement de DUSP22 définit un sous-groupe distinct de LAGC ALK - associés à un bon pronostic [ 74]. Les réarrangements du locus 6p25 ne surviennent qu’occasionnellement dans les autres entités de LTP [ 50, 56, 57, 73], et leur détection peut donc aider au diagnostic différentiel, en particulier pour certaines lymphoproliférations CD30 + de la peau. Une autre translocation, moins fréquente que la précédente, a été décrite dans les LAGC ALK-. Il s’agit de réarrangements impliquant le gène TP63, qui sont observés dans 8 % des cas et associés à un mauvais pronostic [74]. Les deux types d’anomalies – du locus 6p25 et de TP63 – sont mutuellement exclusives. Des aberrations chromosomiques sont détectées dans deux tiers des cas et diffèrent de celles observées chez les patients ALK+ : il s’agit de gains en 1q41-qter, 5q, 6p, 7p, 8q, 12q, et 17q et de pertes en 6q21-q22, 17 p13.3-p12 et 13q [48, 50, 54–56, 73]. Les pertes des régions 17 (25 %), où se situe le gène TP53, et 6q21 (19 %), qui contient les gènes PRDM1 et ATG5, sont les plus fréquentes. Inactivation de PRDM1/BLIMP1 En couplant analyse du statut des mutations et SNP ( single nucleotide polymorphism) array, il apparaît que le gène PRDM1 est inactivé par délétion ou mutation dans 39 % des cas de LAGC ALK - ( versus 3 % des cas de LAGC ALK +) [ 75, 76]. Cette inactivation est le plus souvent monoallélique, suggérant un possible effet d’haplo-insuffisance. Il n’a pas été observé de méthylation du promoteur de l’autre copie [ 75]. PRDM1/BLIMP1 est un répresseur transcriptionnel impliqué dans la régulation de la différenciation B [77]. Une inactivation de ce gène (mutations, délétions, répressions transcriptionnelles) est retrouvée chez 50 % des patients atteints de lymphome diffus à grandes cellules de type activé [78–81], et son rôle suppresseur de tumeur a été formellement montré dans ces lymphomes diffus en utilisant des modèles murins d’invalidation de PRDM1 [80, 81]. Ce gène jouerait également un rôle important dans l’homéostasie T et la tolérance du soi [82, 83]. La réexpression de PRDM1 dans des lignées cellulaires avec une délétion 6q21 conduit à un arrêt de la prolifération cellulaire in vitro et à une diminution de la croissance tumorale dans des modèles de xénogreffe, indiquant que PRDM1 agit comme un gène suppresseur de tumeur [75]. La perte de la région 6q21 est significativement associée à la perte en 17p13.3-p12. Néanmoins, les mutations du gène TP53 sont rares chez les patients atteints de LAGC ALK- (elles ne concernent que 5 % des cas) [75, 76]. Les LAGC ALK- avec inactivation de PRDM1 et/ou perte en 17p se caractérisent par une survie globale inférieure à celle des autres groupes [75]. Autres altérations génétiques : activation de la voie STAT3 Enfin, des mutations de STAT3 et/ou de JAK1 ont récemment été rapportées chez 18 % des patients avec un LAGC ALK - systémique [ 76]. Les mutations de STAT3 ciblent un point chaud dans le domaine SH2 de la protéine, alors que les mutations de JAK1 affectent la glycine 1097 située dans le domaine kinase. Une co-occurence des 2 mutations est observée chez 38 % des patients porteurs de mutations. De nouvelles translocations impliquant les gènes NFk B2 ou NCOR2 d’une part, et TYK2 ou ROS1 d’autre part, ont été identifiées chez un peu moins de 20 % des patients et sont mutuellement exclusives des mutations de STAT3/JAK1 [ 76]. Ces anomalies moléculaires ont toutes en commun d’aboutir à une activation constitutive de la voie STAT3, ce qui leur confère un rôle transformant in vitro et in vivo. L’inhibition de la voie JAK/STAT3 semble donc être une stratégie thérapeutique prometteuse [ 76]. Les anomalies moléculaires identifiées dans les LAGC ALK- sont résumées dans le Tableau IV. Tableau IV.
| Anomalies |
Fréquence |
Fonction du (des) produit(s) du (des) gène(s) impliqué(s) |
| Inactivation de PRDM1 (délétion ou mutation) |
39 % |
Répresseur transcriptionnel/régulation de la différenciation B |
|
| Délétion TP53 |
25 % |
Suppresseur de tumeur/induction de l’apoptose |
|
| Réarrangement DUSP22 |
17 % |
Activateur de la voie JNK |
|
| Translocation NFkB2/NCOR2 - TYK2/ROS1 |
17 % |
NFκB2 : activateur et répresseur de la voie NFκB (selon partenaire) |
| NCOR2 : corépresseur transcriptionnel/favorise la condensation de la chromatine |
| ROS1 : récepteur à activité tyrosine kinase |
| TYK2 : tyrosine kinase asssociée aux récepteurs de cytokines |
| Réarrangement IRF4 |
8 % |
Régulateur de la différenciation lymphoïde normale |
|
| Réarrangement TP63 |
8 % |
Impliquée dans l’apoptose dépendante de p53 |
|
| Mutations TP53 |
5 % |
Suppresseur de tumeur/induction de l’apoptose |
|
| Mutations STAT3 |
3 % |
Facteur de transcription/activateur transcriptionnel |
|
| Mutations JAK1 |
8 % |
Tyrosine kinase asssociée aux récepteurs de cytokines |
|
| Doubles mutations STAT3/JAK1 |
7% |
|
Anomalies identifiées dans les lymphomes anaplasiques à grandes cellules ALK-. Les données proviennent des références [ 56, 57, 73– 76, 95]. |
Rôle du CD30 Les LAGC se caractérisent par l’expression du CD30 7, à la surface des cellules tumorales. Cette surexpression est en partie liée à l’activation des voies ERK et STAT3 [ 59]. Le rôle du CD30 dans la lymphomagenèse des LAGC n’est pas complètement éclairci. La liaison du CD30 à son ligand naturel (CD153) ou à des anticorps anti-CD30 conduit à une activation de la voie canonique, mais aussi alternative, de NFκB, d’où des effets divers de type prolifération, inhibition du cycle cellulaire, différenciation cellulaire et apoptose, qui dépendent de l’intensité et de la durée d’engagement du CD30 [ 59] . L’utilisation d’anticorps anti-CD30 non conjugués a été relativement décevante. En revanche, le brentuximab, qui couple un anticorps anti-CD30 à un alcaloïde de la pervenche, est efficace chez les patients réfractaires ou en rechute [84]. |
Les différentes entités de LTP étaient antérieurement principalement définies sur des aspects anatomopathologiques. L’identification de la parenté des cellules tumorales avec des cellules normales a permis de proposer de nouveaux marqueurs d’intérêt diagnostique. La détection d’anomalies génétiques récurrentes dans certains sous-types aboutira probablement à l’intégration de critères moléculaires dans la future classification de ces lymphomes. Les résultats publiés ces dernières années sur les LAIT et LTP-NS ont fait évoluer le modèle communément admis de lymphomagenèse dans lequel la cellule tumorale dérivait classiquement d’une cellule mature déjà différenciée. Ils suggèrent en effet que des altérations moléculaires importantes pour la transformation surviennent précocement, probablement au niveau d’une cellule souche hématopoïétique. Ce modèle est également proposé dans les hémopathies myéloïdes [85–88], et d’autres tumeurs lymphoïdes matures, comme la leucémie à tricholeucocytes [89], la leucémie chronique lymphoïde [90, 91] et la leucémie/lymphome T de l’adulte HTLV1+ [92–94] qui semblent suivre un schéma similaire. À l’ère des thérapies ciblées (Tableau V), il est indispensable de revoir les stratégies thérapeutiques utilisées dans les LTP en privilégiant désormais un traitement « à la carte » adapté aux anomalies moléculaires détectées chez chaque patient. Ceci devient maintenant possible grâce aux analyses globales, qui ont permis l’identification de nouvelles cibles. Ces traitements ciblés supposent une bonne compréhension de la tumeur, comprenant l’ordre d’apparition des mutations et les mécanismes d’action des protéines mutées. Tableau V.
| Entité |
Anomalie |
Thérapie ciblée |
| LAIT |
Mutations TET2 |
Agents déméthylants |
Azacytidine/décitabine |
| Mutations DNMT3A |
Agents déméthylants |
Azacytidine/décitabine |
| Mutations IDH2 |
Inhibiteur des formes mutées d’IDH2 |
|
| Mutations FYN |
Inhibiteur des SRC kinases |
Dasatinib |
|
| LTP-NS |
Mutations TET2 |
Agents déméthylants |
Azacytidine/décitabine |
| Mutations DNMT3A |
Agents déméthylants |
Azacytidine/décitabine |
| Activation PDGFRa |
Inhibiteur du PDGFR |
Imatinib |
| Activation mTOR |
Inhibiteurs de mTOR |
Temsirolimus |
|
| LAGC |
Expression CD30 |
Anticorps mono-clonal antiCD30 |
Brentuximab |
|
| LAGC ALK+ |
Activation STAT3 |
Inhibiteur de STAT3 |
|
| Translocation ALK+ |
Inhibiteur d’ALK |
Crizotinib |
| Surexpression PDGFRβ |
Inhibiteur du PDGFR |
Imatinib |
|
| LAGC ALK- |
Mutations JAK1 |
Inhibiteur de JAK1/JAK2 |
Ruxolitinib |
| Translocation NFkB2/NCOR2-ROS1/TYK2 |
Inhibiteur de STAT3 |
|
| Mutations STAT3 |
|
Anomalies moléculaires spécifiques détectées dans les LAIT, LTP-NS et LAGC et thérapies ciblées correspondantes.
|
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Lucile Couronné a été financée pendant sa thèse par un poste d’accueil Inserm (Institut national de la santé et de la recherche médicale) et pendant son post-doctorat par une bourse de l’ITMO (Institut multi-organismes cancer) et de l’INCa (Institut national du cancer). Les travaux effectués dans les laboratoires des auteurs ont été financés par l’Inserm, le CNRS, la Ligue nationale contre le cancer (équipe labellisée pour OB), la fondation ARC et la fondation pour la recherche médicale.
|
|
ALK :
|
anaplastic lymphoma kinase |
|
ASCL2 :
|
achaete-scute family BHLH transcription factor 2 |
|
ATG5 :
|
autophagy related 5 |
|
ATM :
|
ataxia-telangiectasia mutated |
|
CCR4 :
|
chemokine (C-C motif) receptor 4 |
|
CCL3 :
|
chemokine (C-C motif) ligand 3 |
|
CXCR3, CXCR7 :
|
C-X-C chemokine receptor type 3, type 7 |
|
CCND3 :
|
cycline D3 |
|
CDKN2A :
|
cyclin-dependent kinase inhibitor 2A |
|
CMAF :
|
musculoaponeurotic fibrosarcoma oncogene homolog |
|
DNMT3A :
|
DNA (cytosine-5-)-methyltransferase 3 alpha |
|
DUSP22 :
|
dual specificity phosphatase 22 |
|
EBV :
|
Epstein Barr virus |
|
EMA :
|
epithelial membrane antigen |
|
EP300 :
|
E1A binding protein P300 |
|
ETV6 :
|
Ets variant 6 |
|
FRA7H :
|
fragile site, aphidicolin type, common, fra(7)(q32.3) |
|
HIF1α :
|
hypoxia-inducible factor 1alpha |
|
ICOS :
|
inducible T-cell costimulator |
|
IDH2 :
|
isocitrate dehydrogenase |
|
IFN α/β/γ :
|
interféron α/β/γ |
|
ITK :
|
IL-2-inducible T cell kinase |
|
IL18RA :
|
interleukin 18 receptor alpha |
|
IRF4 :
|
interferon regulatory factor 4 |
|
JAK2 :
|
Janus kinase 2 |
|
LAGC :
|
lymphome anaplasique à grandes cellules |
|
LAIT :
|
lymphome angio-immunoblastique T |
|
LTP :
|
lymphome T périphérique |
|
LTP-NS :
|
lymphome T périphérique non spécifié |
|
MCL-1 :
|
myeloid cell leukemia 1 |
|
NCOR2 :
|
nuclear receptor corepressor 2 |
|
NPM :
|
nucléophosmine |
|
PTCL :
|
peripheral T cell lymphoma |
|
PD1 :
|
programmed cell death 1 |
|
PDGFRα, PDGFRβ :
|
platelet-derived growth factor receptor, alpha or beta polypeptide |
|
PRDM1 :
|
PR domain containing 1, with ZNF domain |
|
PRKD2 :
|
protein kinase D2 |
|
RHOT2 :
|
ras homolog family member T2 |
|
ROS1 :
|
ROS proto-oncogene 1 |
|
SAP :
|
signalling lymphocyte activation molecule (SLAM)-associated protein |
|
SMARCAL1 :
|
SWI/SNF related, matrix associated, actin dependent regulator of chromatin, subfamily A-like 1 |
|
STAT3 :
|
signal transducer and activator of transcription 3 |
|
SYK :
|
spleen tyrosine kinase |
|
TBX21 (ou TBET) :
|
T-box 21 |
|
TCR :
|
T cell receptor |
|
TET2 :
|
ten-eleven translocation (methylcytosine dioxygenase 2) |
|
TFH :
|
lymphocytes T folliculaires helper |
|
TIA-1 :
|
T-cell intracellular antigen-1 |
|
TNFSF9 :
|
tumor necrosis factor (ligand) superfamily, member 9 |
|
mTOR :
|
mammalian target of rapamycin |
|
TYK2 :
|
tyrosine kinase 2 |
|
Footnotes |
1.
Vose J, Armitage J, Weisenburger D, et al. International peripheral T-cell and natural killer/T-cell lymphoma study: pathology findings and clinical outcomes . J Clin Oncol. 2008; ; 26 : :412.–430. 2.
Parrens M, Martin A, Lamant L, et al. Angioimmunoblastic T-cell lymphoma (AITL) is the most prevalent T-cell lymphoma entity in Western Europe . ASH Annu Meet Abstr. 2012; ; 120 : :1607.. 3.
De Leval L, Gaulard P. Pathology and biology of peripheral T-cell lymphomas . Histopathology. 2011; ; 58 : :49.–68. 4.
Sibon D, Fournier M, Brière J, et al. Long-term outcome of adults with systemic anaplastic large-cell lymphoma treated within the Groupe d’étude des lymphomes de l’adulte trials . J Clin Oncol. 2012; ; 30 : :3939.–3946. 5.
Lamant L, McCarthy K, d’Amore E, et al. Prognostic impact of morphologic and phenotypic features of childhood ALK-positive anaplastic large-cell lymphoma: results of the ALCL99 study . J Clin Oncol. 2011;; 29 : :4669.–76. 6.
De Leval L, Gaulard P. Pathobiology and molecular profiling of peripheral T-cell lymphomas . Hematology Am Soc Hematol Educ Program. 2008 : :272.–279. 7.
Attygalle A, Al-Jehani R, Diss TC, et al. Neoplastic T cells in angioimmunoblastic T-cell lymphoma express CD10 . Blood. 2002; ; 99 : :627.–633. 8.
Ree HJ, Kadin ME, Kikuchi M, et al. Bcl-6 expression in reactive follicular hyperplasia, follicular lymphoma, and angioimmunoblastic T-cell lymphoma with hyperplastic germinal centers: heterogeneity of intrafollicular T-cells and their altered distribution in the pathogenesis of angioimmunoblastic T-cell lymphoma . Hum Pathol. 1999; ; 30 : :403.–411. 9.
Bisig B, Thielen C, Herens C, et al. c-Maf expression in angioimmunoblastic T-cell lymphoma reflects follicular helper T-cell derivation rather than oncogenesis . Histopathology. 2012; ; 60 : :371.–376. 10.
Grogg KL, Attygalle AD, Macon WR, et al. Angioimmunoblastic T-cell lymphoma: a neoplasm of germinal-center T-helper cells? Blood. 2005; ; 106 : :1501.–1502. 11.
Dupuis J, Boye K, Martin N, et al. Expression of CXCL13 by neoplastic cells in angioimmunoblastic T-cell lymphoma (AITL): a new diagnostic marker providing evidence that AITL derives from follicular helper T cells . Am J Surg Pathol. 2006; ; 30 : :490.–494. 12.
Roncador G, García Verdes-Montenegro JF, Tedoldi S, et al. Expression of two markers of germinal center T cells (SAP and PD-1) in angioimmunoblastic T-cell lymphoma . Haematologica. 2007; ; 92 : :1059.–1066. 13.
Liu X, Chen X, Zhong B, et al. Transcription factor achaete-scute homologue 2 initiates follicular T-helper-cell development . Nature. 2014; ; 507 : :513.–518. 14.
Vinuesa CG, Tangye SG, Moser B, et al. Follicular B helper T cells in antibody responses and autoimmunity . Nat Rev Immunol. 2005; ; 5 : :853.–865. 15.
De Leval L, Rickman DS, Thielen C, et al. The gene expression profile of nodal peripheral T-cell lymphoma demonstrates a molecular link between angioimmunoblastic T-cell lymphoma (AITL) and follicular helper T (TFH) cells . Blood. 2007; ; 109 : :4952.–4963. 16.
Piccaluga PP, Agostinelli C, Califano A, et al. Gene expression analysis of angioimmunoblastic lymphoma indicates derivation from T follicular helper cells and vascular endothelial growth factor deregulation . Cancer Res. 2007; ; 67 : :10703.–10710. 17.
De Leval L, Gaulard P. Tricky and terrible T-cell tumors: these are thrilling times for testing: molecular pathology of peripheral T-cell lymphomas . Hematology Am Soc Hematol Educ Program. 2011 ; :336.–343. 18.
Marafioti T, Paterson JC, Ballabio E, et al. The inducible T-cell co-stimulator molecule is expressed on subsets of T cells and is a new marker of lymphomas of T follicular helper cell-derivation . Haematologica. 2010; ; 95 : :432.–439. 19.
Nelson M, Horsman DE, Weisenburger DD, et al. Cytogenetic abnormalities and clinical correlations in peripheral T-cell lymphoma . Br J Haematol. 2008; ; 141 : :461.–469. 20.
Almire C, Bertrand P, Ruminy P, et al. PVRL2 is translocated to the TRA@ locus in t(14;19)(q11;q13)-positive peripheral T-cell lymphomas . Genes Chromosomes Cancer. 2007; ; 46 : :1011.–1018. 21.
Mahfoudhi E, Secardin L, Scourzic L, et al. Propriétés et rôles biologiques des protéines TET au cours du développement et de l’hématopoïèse . Med Sci (Paris). 2015; ; 31 : :268.–274. 22.
Lemonnier F, Couronné L, Parrens M, et al. Recurrent TET2 mutations in peripheral T-cell lymphomas correlate with TFH-like features and adverse clinical parameters . Blood. 2012; ; 120 : :1466.–1469. 23.
Odejide O, Weigert O, Lane AA, et al. A targeted mutational landscape of angioimmunoblastic T cell lymphoma . Blood. 2014; ; 123 : :1293.–1296. 24.
Palomero T, Couronné L, Khiabanian H, et al. Recurrent mutations in epigenetic regulators, RHOA and FYN kinase in peripheral T cell lymphomas . Nat Genet. 2014; ; 46 : :166.–170. 25.
Sakata-Yanagimoto M, Enami T, Yoshida K, et al. Somatic RHOA mutation in angioimmunoblastic T cell lymphoma . Nat Genet. 2014; ; 46 : :171.–175. 26.
Quivoron C, Couronné L, Della Valle V, et al. TET2 inactivation results in pleiotropic hematopoietic abnormalities in mouse and is a recurrent event during human lymphomagenesis . Cancer Cell. 2011; ; 20 : :25.–38. 27.
Couronné L, Bastard C, Bernard OA. TET2 and DNMT3A mutations in human T-cell lymphoma . N Engl J Med. 2012; ; 366 : :95.–96. 28.
Cairns RA, Iqbal J, Lemonnier F, et al. IDH2 mutations are frequent in angioimmunoblastic T-cell lymphoma . Blood. 2012; ; 119 : :1901.–1903. 29.
Xu W, Yang H, Liu Y, et al. Oncometabolite 2-hydroxyglutarate is a competitive inhibitor of α-ketoglutarate-dependent dioxygenases . Cancer Cell. 2011; ; 19 : :17.–30. 30.
Yoo HY, Sung MK, Lee SH, et al. A recurrent inactivating mutation in RHOA GTPase in angioimmunoblastic T cell lymphoma . Nat Genet. 2014; ; 46 : :371.–375. 31.
Manso R, Sánchez-Beato M, Monsalvo S, et al. The RHOA G17V gene mutation occurs frequently in peripheral T-cell lymphoma and is associated with a characteristic molecular signature . Blood. 2014; ; 123 : :2893.–2894. 32.
Challa-Malladi M, Lieu YK, Califano O, et al. Combined genetic inactivation of β2-microglobulin and CD58 reveals frequent escape from immune recognition in diffuse large B cell lymphoma . Cancer Cell. 2011; ; 20 : :728.–740. 33.
Abdel-Wahab O, Levine RL. Mutations in epigenetic modifiers in the pathogenesis and therapy of acute myeloid leukemia . Blood. 2013; ; 121 : :3563.–3572. 34.
Gaulard P, de Leval L. The microenvironment in T-cell lymphomas: emerging themes . Semin Cancer Biol. 2014; ; 24 : :49.–60. 35.
Provot S. Contrôle de la croissance et de la dissémination tumorales par le microenvironnement : certitudes et hypothèses émergentes . Med Sci (Paris). 2014; ; 30 : :366.–371. 36.
Bruchard M, Ghiringhelli F. Microenvironnement tumoral : cellules régulatrices et cytokines immunosuppressives . Med Sci (Paris). 2014; ; 30 : :429.–435. 37.
Piccaluga PP, Agostinelli C, Califano A, et al. Gene expression analysis of peripheral T cell lymphoma, unspecified, reveals distinct profiles and new potential therapeutic targets . J Clin Invest. 2007; ; 117 : :823.–834. 38.
Martínez-Delgado B, Cuadros M, Honrado E, et al. Differential expression of NF-kappaB pathway genes among peripheral T-cell lymphomas . Leukemia. 2005; ; 19 : :2254.–2263. 39.
Cuadros M, Dave SS, Jaffe ES, et al. Identification of a proliferation signature related to survival in nodal peripheral T-cell lymphomas . J Clin Oncol. 2007; ; 25 : :3321.–3329. 40.
Iqbal J, Weisenburger DD, Greiner TC, et al. Molecular signatures to improve diagnosis in peripheral T-cell lymphoma and prognostication in angioimmunoblastic T-cell lymphoma . Blood. 2010; ; 115 : :1026.–1036. 41.
Leval L, Bisig B, Thielen C, et al. Molecular classification of T-cell lymphomas . Crit Rev Oncol Hematol. 2009; ; 72 : :125.–143. 42.
Iqbal J, Wright G, Wang C, et al. Gene expression signatures delineate biological and prognostic subgroups in peripheral T-cell lymphoma . Blood. 2014; ; 123 : :2915.–2923. 43.
Wang T, Feldman AL, Wada DA, et al. GATA-3 expression identifies a high-risk subset of PTCL, NOS with distinct molecular and clinical features . Blood. 2014; ; 123 : :3007.–3015. 44.
Pechloff K, Holch J, Ferch U, et al. The fusion kinase ITK-SYK mimics a T cell receptor signal and drives oncogenesis in conditional mouse models of peripheral T cell lymphoma . J Exp Med. 2010; ; 207 : :1031.–1044. 45.
Huang Y, Moreau A, Dupuis J, et al. Peripheral T-cell lymphomas with a follicular growth pattern are derived from follicular helper T cells (TFH) and may show overlapping features with angioimmunoblastic T-cell lymphomas . Am J Surg Pathol. 2009; ; 33 : :682.–690. 46.
Attygalle AD, Feldman AL, Dogan A. ITK/SYK translocation in angioimmunoblastic T-cell lymphoma . Am J Surg Pathol. 2013; ; 37 : :1456.–1457. 47.
Feldman AL, Sun DX, Law ME, et al. Overexpression of Syk tyrosine kinase in peripheral T-cell lymphomas . Leukemia. 2008; ; 22 : :1139.–1143. 48.
Pozzobon M, Marafioti T, Hansmann ML, et al. Intracellular signalling molecules as immunohistochemical markers of normal and neoplastic human leucocytes in routine biopsy samples . Br J Haematol. 2004; ; 124 : :519.–533. 49.
Geissinger E, Sadler P, Roth S, et al. Disturbed expression of the T-cell receptor/CD3 complex and associated signaling molecules in CD30+ T-cell lymphoproliferations . Haematologica. 2010; ; 95 : :1697.–1704. 50.
Feldman AL, Law M, Remstein ED, et al. Recurrent translocations involving the IRF4 oncogene locus in peripheral T-cell lymphomas . Leukemia. 2009; ; 23 : :574.–580. 51.
Thorns C, Bastian B, Pinkel D, et al. Chromosomal aberrations in angioimmunoblastic T-cell lymphoma and peripheral T-cell lymphoma unspecified: a matrix-based CGH approach . Genes Chromosomes Cancer. 2007; ; 46 : :37.–44. 52.
Zettl A, Rüdiger T, Konrad MA, et al. Genomic profiling of peripheral T-cell lymphoma, unspecified, and anaplastic large T-cell lymphoma delineates novel recurrent chromosomal alterations . Am J Pathol. 2004; ; 164 : :1837.–1848. 53.
Mason DY, Bastard C, Rimokh R, et al. CD30-positive large cell lymphomas (Ki-1 lymphoma) are associated with a chromosomal translocation involving 5q35 . Br J Haematol. 1990; ; 74 : :161.–168. 54.
Morris SW, Kirstein MN, Valentine MB, et al. Fusion of a kinase gene, ALK, to a nucleolar protein gene, NPM, in non-Hodgkin’s lymphoma . Science. 1994; ; 263 : :1281.–1284. 55.
Feldman AL, Vasmatzis G, Asmann YW, et al. Novel TRAF1-ALK fusion identified by deep RNA sequencing of anaplastic large cell lymphoma . Genes Chromosomes Cancer. 2013; ; 52 : :1097.–1102. 56.
Pham-Ledard A, Prochazkova-Carlotti M, Laharanne E, et al. IRF4 gene rearrangements define a subgroup of CD30-positive cutaneous T-cell lymphoma: a study of 54 cases . J Invest Dermatol. 2010; ; 130 : :816.–825. 57.
Wada DA, Law ME, Hsi ED, et al. Specificity of IRF4 translocations for primary cutaneous anaplastic large cell lymphoma: a multicenter study of 204 skin biopsies . Mod Pathol. 2011; ; 24 : :596.–605. 58.
Ott G, Katzenberger T, Siebert R, et al. Chromosomal abnormalities in nodal and extranodal CD30+ anaplastic large cell lymphomas: infrequent detection of the t(2;5) in extranodal lymphomas . Genes Chromosomes Cancer. 1998; ; 22 : :114.–121. 59.
Chiarle R, Voena C, Ambrogio C, et al. The anaplastic lymphoma kinase in the pathogenesis of cancer . Nat Rev Cancer. 2008; ; 8 : :11.–23. 60.
Chiarle R, Simmons WJ, Cai H, et al. Stat3 is required for ALK-mediated lymphomagenesis and provides a possible therapeutic target . Nat Med. 2005; ; 11 : :623.–629. 61.
Amin HM, McDonnell TJ, Ma Y, et al. Selective inhibition of STAT3 induces apoptosis and G(1) cell cycle arrest in ALK-positive anaplastic large cell lymphoma . Oncogene. 2004; ; 23 : :5426.–5434. 62.
Piva R, Agnelli L, Pellegrino E, et al. Gene expression profiling uncovers molecular classifiers for the recognition of anaplastic large-cell lymphoma within peripheral T-cell neoplasms . J Clin Oncol. 2010; ; 28 : :1583.–1590. 63.
Spaccarotella E, Pellegrino E, Ferracin M, et al. STAT3-mediated activation of microRNA cluster 17–92 promotes proliferation and survival of ALK-positive anaplastic large cell lymphoma . Haematologica. 2014; ; 99 : :116.–124. 64.
Laimer D, Dolznig H, Kollmann K, et al. PDGFR blockade is a rational and effective therapy for NPM-ALK-driven lymphomas . Nat Med. 2012; ; 18 : :1699.–1704. 65.
Desjobert C, Renalier MH, Bergalet J, et al. MiR-29a down-regulation in ALK-positive anaplastic large cell lymphomas contributes to apoptosis blockade through MCL-1 overexpression . Blood. 2011; ; 117 : :6627.–6637. 66.
Shaw AT, Kim DW, Nakagawa K, et al. Crizotinib versus chemotherapy in advanced ALK-positive lung cancer . N Engl J Med. 2013; ; 368 : :2385.–2394. 67.
Mossé YP, Lim MS, Voss SD, et al. Safety and activity of crizotinib for paediatric patients with refractory solid tumours or anaplastic large-cell lymphoma: a children’s oncology group phase 1 consortium study . Lancet Oncol. 2013; ; 14 : :472.–480. 68.
Gambacorti-Passerini C, Messa C, Pogliani EM. Crizotinib in anaplastic large-cell lymphoma . N Engl J Med. 2011; ; 364 : :775.–776. 69.
Agnelli L, Mereu E, Pellegrino E, et al. Identification of a 3-gene model as a powerful diagnostic tool for the recognition of ALK-negative anaplastic large-cell lymphoma . Blood. 2012; ; 120 : :1274.–1281. 70.
Lamant L, de Reyniès A, Duplantier M-M, et al. Gene-expression profiling of systemic anaplastic large-cell lymphoma reveals differences based on ALK status and two distinct morphologic ALK+ subtypes . Blood. 2007; ; 109 : :2156.–2164. 71.
Piccaluga PP, Fuligni F, De Leo A, et al. Molecular profiling improves classification and prognostication of nodal peripheral T-cell lymphomas: results of a phase III diagnostic accuracy study . J Clin Oncol. 2013; ; 31 : :3019.–3025. 72.
Gualco G, Weiss LM, Bacchi CE. MUM1/IRF4: a review . Appl Immunohistochem Mol Morphol. 2010; ; 18 : :301.–310. 73.
Feldman AL, Dogan A, Smith DI, et al. Discovery of recurrent t(6;7)(p25.3;q32.3) translocations in ALK-negative anaplastic large cell lymphomas by massively parallel genomic sequencing . Blood. 2011; ; 117 : :915.–919. 74.
Parrilla Castellar ER, Jaffe ES, Said JW, et al. ALK-negative anaplastic large cell lymphoma is a genetically heterogeneous disease with widely disparate clinical outcomes . Blood. 2014; ; 124 : :1473.–1480. 75.
Boi M, Rinaldi A, Kwee I, et al. PRDM1/BLIMP1 is commonly inactivated in anaplastic large T-cell lymphoma . Blood. 2013; ; 122 : :2683.–2693. 76.
Crescenzo R, Abate F, Lasorsa E, et al. Convergent mutations and kinase fusions lead to oncogenic STAT3 activation in anaplastic large cell lymphoma . Cancer Cell. 2015; ; 27 : :516.–532. 77.
Turner CAJr, Mack DH, Davis MM. Pillars article: Blimp-1, a novel zinc finger-containing protein that can drive the maturation of B lymphocytes into immunoglobulin-secreting cells. 1994 . J Immunol. 2010; ; 185 : :5.–14. 78.
Pasqualucci L, Compagno M, Houldsworth J, et al. Inactivation of the PRDM1/BLIMP1 gene in diffuse large B cell lymphoma . J Exp Med. 2006; ; 203 : :311.–317. 79.
Tam W, Gomez M, Chadburn A, et al. Mutational analysis of PRDM1 indicates a tumor-suppressor role in diffuse large B-cell lymphomas . Blood. 2006; ; 107 : :4090.–4100. 80.
Calado DP, Zhang B, Srinivasan L, et al. Constitutive canonical NF-κB activation cooperates with disruption of BLIMP1 in the pathogenesis of activated B cell-like diffuse large cell lymphoma . Cancer Cell. 2010; ; 18 : :580.–589. 81.
Mandelbaum J, Bhagat G, Tang H, et al. BLIMP1 is a tumor suppressor gene frequently disrupted in activated B cell-like diffuse large B cell lymphoma . Cancer Cell. 2010; ; 18 : :568.–579. 82.
Kallies A, Hawkins ED, Belz GT, et al. Transcriptional repressor Blimp-1 is essential for T cell homeostasis and self-tolerance . Nat Immunol. 2006; ; 7 : :466.–474. 83.
Martins GA, Cimmino L, Shapiro-Shelef M, et al. Transcriptional repressor Blimp-1 regulates T cell homeostasis and function . Nat Immunol. 2006; ; 7 : :457.–465. 84.
Younes A, Bartlett NL, Leonard JP, et al. Brentuximab vedotin (SGN-35) for relapsed CD30-positive lymphomas . N Engl J Med. 2010; ; 363 : :1812.–1821. 85.
Abkowitz JL. Clone wars: the emergence of neoplastic blood-cell clones with aging . N Engl J Med. 2014; ; 371 : :2523.–2525. 86.
Jaiswal S, Fontanillas P, Flannick J, et al. Age-related clonal hematopoiesis associated with adverse outcomes . N Engl J Med. 2014; ; 371 : :2488.–2498. 87.
Genovese G, Kähler AK, Handsaker RE, et al. Clonal hematopoiesis and blood-cancer risk inferred from blood DNA sequence . N Engl J Med. 2014; ; 371 : :2477.–2487. 88.
Xie M, Lu C, Wang J, et al. Age-related mutations associated with clonal hematopoietic expansion and malignancies . Nat Med. 2014; ; 20 : :1472.–1478. 89.
Chung SS, Kim E, Park JH, et al. Hematopoietic stem cell origin of BRAFV600E mutations in hairy cell leukemia . Sci Transl Med. 2014;; 6 : :238ra71.. 90.
Damm F, Mylonas E, Cosson A, et al. Acquired initiating mutations in early hematopoietic cells of CLL patients . Cancer Discov. 2014; ; 4 : :1088.–1101. 91.
Kikushige Y, Ishikawa F, Miyamoto T, et al. Self-renewing hematopoietic stem cell is the primary target in pathogenesis of human chronic lymphocytic leukemia . Cancer Cell. 2011; ; 20 : :246.–259. 92.
Rizkallah G, Mahieux R, Dutartre H. Transmission intercellulaire de HTLV-1 . Med Sci (Paris). 2015; ; 31 : :629.–637. 93.
Yamazaki J, Mizukami T, Takizawa K, et al. Identification of cancer stem cells in a Tax-transgenic (Tax-Tg) mouse model of adult T-cell leukemia/lymphoma . Blood. 2009; ; 114 : :2709.–2720. 94.
Duc Dodon M, Barbeau B, Mesnard JM. Leucémies T induites par HTLV-1 : y a-t-il un avant et un après HBZ ? Med Sci (Paris). 2010;; 26 : :391.–6. 95.
Feldman AL, Law M, Remstein ED, et al. Recurrent translocations involving the IRF4 oncogene locus in peripheral T-cell lymphomas . Leukemia. 2009; ; 23 : :574.–580. |