La reprogrammation est à la mode ! Le point d’orgue en est probablement le prix Nobel de physiologie et de médecine 2012, attribué conjointement à Sir John Gurdon pour ses travaux sur le transfert d’un noyau de cellule adulte dans un ovocyte, et au docteur Shinya Yamanaka pour ses études sur la reprogrammation de cellules différenciées adultes en cellules souches pluripotentes (induced pluripotent stem cells, IPS). Contre toute attente, une petite poignée de trois ou quatre facteurs de transcription suffit à dédifférencier des cellules adultes et matures et à réveiller leurs propres gènes de pluripotence. Des travaux récents ont décrypté les mécanismes gouvernant cette reprogrammation en identifiant des facteurs de transcription dits pionniers, car ils sont plus que d’autres, capables d’activer l’expression de gènes silencieux, engoncés dans leurs manteaux de nucléosomes et une chromatine fermée [1, 2]. On s’est alors pris à rêver : et si, de la même manière, un petit cocktail de facteurs suffisait à différencier des cellules du micro-environnement en cellules matures fonctionnelles ou même à réanimer des cellules d’un organe défaillant, sans passer par un stade pluripotent ? Le transfert de gènes prendrait alors le pas sur la thérapie cellulaire, en particulier dans des pathologies acquises où le tissu cible est tellement désorganisé ou nécrosé qu’il empêche généralement l’accès et la survie des cellules transplantées. Certaines expériences, réalisées chez le rongeur, ont déjà appuyé cette hypothèse dans l’infarctus du myocarde, le transfert direct de trois facteurs de transcription (Gata4, Mef2c et Tbx5)1 suffisant, lorsqu’ils sont administrés en périphérie de l’infarctus, à reprogrammer des fibroblastes résidents adjacents en cardiomyocytes, à réduire le degré de fibrose et à améliorer la fonction cardiaque [3]. De même, comme cela a été rapporté dans ces colonnes, chez le rat, l’injection de deux microARN dans le tissu myocardique péri-nécrotique favorise la régénération du tissu cardiaque tout en améliorant de façon significative la fraction d’éjection cardiaque2 [4].
C’est dans un foie en insuffisance terminale que l’équipe d’I. Fox (Pittsburgh, Pennsylvania, États-Unis) vient d’illustrer à nouveau cette possibilité, en montrant que l’expression forcée d’un seul facteur de transcription in vivo suffisait à restaurer la fonction hépatocytaire [5]. Toutes les agressions chroniques du foie, qu’elles soient d’origine virale, toxique ou métabolique, induisent une évolution progressive vers une fibrose hépatique. Celle-ci peut être définie comme un déséquilibre entre une production de matrice extracellulaire excessive et une incapacité à la résoudre. Au long cours, ce déséquilibre conduit à une cirrhose. On distingue alors un stade compensé et un stade décompensé. En cas de cirrhose décompensée, l’insuffisance hépatocellulaire empêche les hépatocytes d’assurer leurs fonctions essentielles, notamment la synthèse de facteurs de coagulation et d’albumine ou la régulation du métabolisme glucidique et lipidique. Cet état aboutira, après parfois certains épisodes critiques d’ascite3, ou d’encéphalopathie hépatique4, à une défaillance terminale et au décès du patient. L’administration chez le rat de phénobarbital et de tétrachlorure de carbone sur de longues périodes est un modèle récapitulant la progression en deux stades de cirrhose (compensée et décompensée) (Figure 1). Les altérations histologiques caractéristiques d’une cirrhose sont (1) une baisse de la masse des hépatocytes qui sont circonscrits en nodules séparés par un abondant et épais tissu matriciel fibrosé (Figure 1)
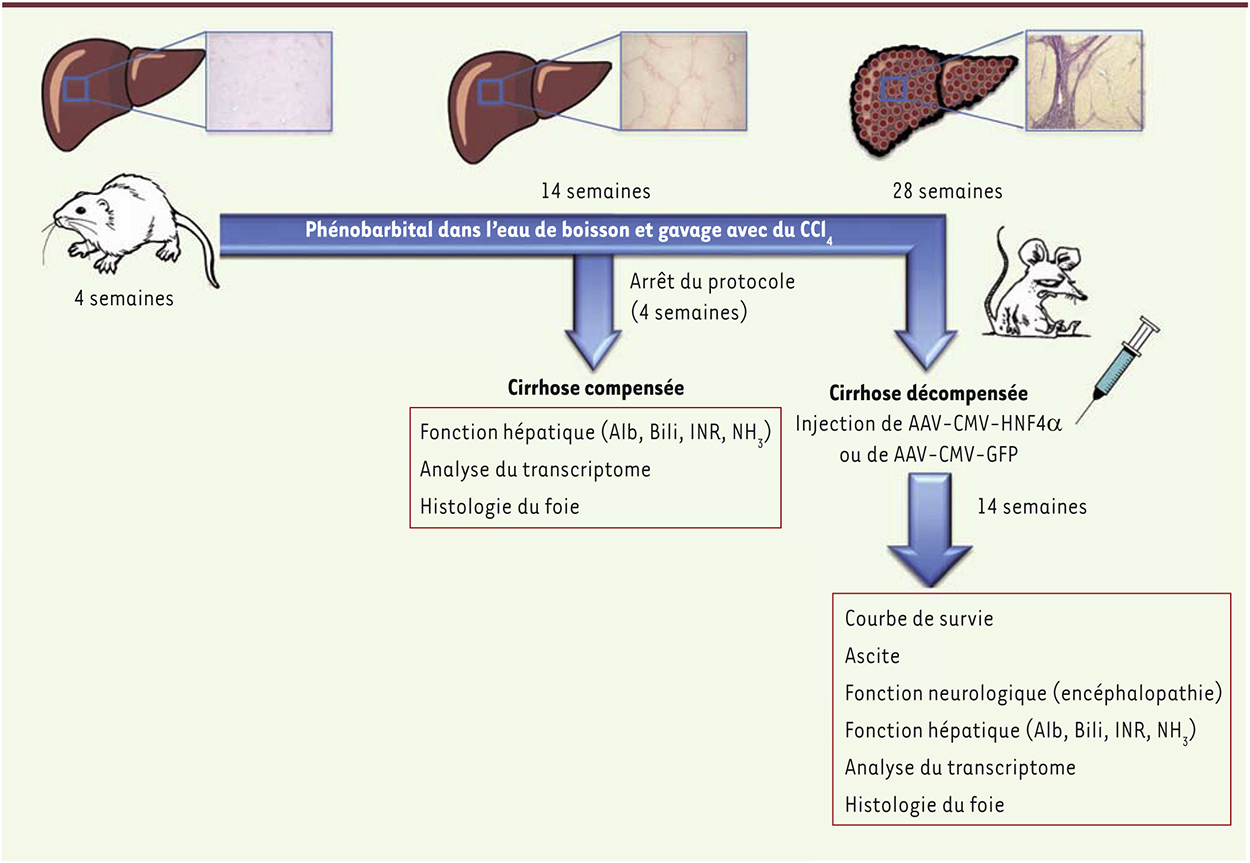
| Figure 1.
Schéma expérimental utilisé pour corriger l’insuffisance hépatique chronique terminale. De jeunes rats reçoivent du phénobarbital dans l’eau de boisson et sont gavés deux fois par semaine par du tétrachlorure de carbone (CCl4) pendant 14 ou 28 semaines. Les animaux sont étudiés après une phase de détoxification de 4 semaines où aucun produit toxique ne leur est administré. Une cirrhose se développe en 14 semaines. Le marquage au rouge Sirius (qui permet de visualiser les fibres de collagène) révèle une fibrose nodulaire qui s’aggrave entre l’état compensé et l’état décompensé (encadrés bleus). Après 14 semaines supplémentaires d’agression, le stade de décompensation est atteint. Les animaux développent alors une ascite, une encéphalopathie et une insuffisance hépatocellulaire caractérisée biologiquement par une augmentation de la bilirubinémie (Bili), une baisse de l’albuminémie (Alb), un défaut de coagulation (INR) et une hyperammoniémie (NH3) pouvant conduire au décès. Une série d’animaux au stade de décompensation reçoivent une injection intraveineuse d’AAV (adeno-associated virus) exprimant soit le facteur HNF4α soit la GFP (green fluorescent protein). Ils sont suivis pendant 14 semaines sur l’évolution des mêmes paramètres (encadrés rouges). |
; (2) un stress oxydatif majeur ; (3) une perturbation de la fonction mitochondriale ; et (4) une baisse des capacités prolifératives des cellules épithéliales du foie. Les auteurs avaient déjà montré que la transplantation d’hépatocytes dans ce modèle de cirrhose décompensée permettait d’améliorer la fonction hépatique et de prolonger la survie, sur une période toutefois de seulement quelques semaines [6, 7].
Dans le présent travail, les auteurs ont d’abord étudié le transcriptome des hépatocytes de rats aux deux stades et observé une diminution dans la cirrhose compensée puis, en cas de décompensation, une chute drastique de l’expression du facteur de transcription HNF4α (hepatocyte nuclear factor 4α). Mais il n’est pas le seul. L’expression d’autres facteurs essentiels au développement hépatique et à la maturation hépatocytaire, comme FoxA2 (forkhead box A2), C/EBP (CCAAT/enhancer binding protein) ou HNF1α (hepatocyte nuclear factor 1α), est également diminuée. HNF4α est connu pour être un commutateur central de la différenciation et de la fonction hépatocytaires [8]. De façon remarquable, il lie presque la moitié des gènes connus pour être hépato-spécifiques chez l’adulte [9]. Les animaux invalidés pour HNF4α dans le foie embryonnaire présentent un défaut de différenciation hépatocytaire, les cellules mutantes de type hépatoblastique n’exprimant pas la plupart des gènes spécifiques du foie et ne s’organisant pas en épithélium [10]. Néanmoins, l’induction de ce facteur dans des cellules non hépatocytaires telles que les fibroblastes n’est pas suffisante pour allumer de novo l’expression du programme hépatocytaire. Dans cette nouvelle étude, l’expression forcée in vitro d’HNF4α dans des hépatocytes issus de foies de cirrhose décompensée, qui expriment des marqueurs de dédifférenciation, entraîne, en seulement 48 heures, une réexpression à un niveau quasiment normal de l’ensemble du réseau de facteurs de transcription qui étaient effondrés. Une telle correction peut-elle être obtenue in vivo et pour quel résultat thérapeutique ? Pour répondre à cette question, les auteurs ont injecté par voie intraveineuse à des rats en décompensation, un vecteur AAV (adeno-associated virus) ciblant majoritairement les hépatocytes et exprimant sous le contrôle du promoteur ubiquiste du CMV (cytomégalovirus), soit le facteur HNF4α, soit la GFP (green fluorescent protein) utilisée comme témoin (Figure 1). Seuls les animaux ayant reçu le facteur HNF4α présentent une amélioration de leurs fonctions cognitive et hépatique avec une survie prolongée jusqu’à la fin de l’étude (100 jours). Cet effet thérapeutique impressionnant est assorti d’une amélioration rapide des fonctions de sécrétion (albumine) et de détoxification (expression de cytochrome p450) et d’une réduction drastique de l’apoptose. Pour autant, aucune augmentation de la prolifération des hépatocytes n’est observée et la longueur de leurs télomères reste à un seuil critique bas. Ainsi, une correction de la différenciation des hépatocytes serait obtenue sans qu’une réversion de l’état de sénescence de l’organe ne soit nécessaire. Si ces résultats étaient confirmés - dans ce travail le nombre d’animaux analysés reste très restreint et l’étude mécanistique limitée -, ils indiqueraient de façon inattendue qu’il n’est point besoin de stimuler la prolifération ou de rajeunir la population d’hépatocytes pour corriger cette affection terminale au pronostic sombre et qu’un seul facteur, HNF4α, suffit à réactiver les principales fonctions hépatiques ! Mais les conclusions vont encore plus loin : l’effet bénéfique prolongé ne nécessite pas une expression soutenue d’HNF4α exogène puisque, 14 semaines après l’injection, la source hépatique d’HNF4α est quasiment exclusivement endogène, à l’instar de la reprogrammation des cellules adultes en cellules souches pluripotentes (IPS). De plus, seule une fraction d’hépatocytes ciblés suffit à corriger l’état de décompensation, des mécanismes de communication intercellulaires ou l’induction de médiateurs paracrines pouvant, mais rien n’est démontré, participer à l’augmentation de l’effet observé. Comme ce qu’il fait dans l’hépatoblaste au cours du développement du foie, HNF4 aurait donc ré-induit le programme de différenciation de cellules commises plutôt que de réellement les reprogrammer. Est-ce un conte de fée ? Cela y ressemble : un discret baiser d’HNF4 semble suffire à réveiller des hépatocytes épuisés et à sauver un organe, voire un organisme défaillant… Mais peut-on croire aux contes de fées ? Quelques démonstrations mécanistiques pourraient nous y aider !