Suite à l’entrée d’un virus dans le cerveau, l’organisme met en place une réponse immunitaire ayant pour but de limiter la dissémination du virus et de résorber l’infection. Ceci se traduit par une encéphalite aiguë, l’inflammation entraînant alors des lésions du tissu nerveux. Il arrive cependant que certain virus ne soient que peu ou pas reconnus par le système immunitaire et n’induisent ni encéphalite, ni lésions majeures. Dans ce cas, le virus peut se répliquer de façon continue et persister dans le cerveau de l’individu infecté pendant toute sa vie. Sa présence n’est toutefois pas sans danger pour les cellules infectées. Il peut en effet interférer avec des fonctions cellulaires ce qui, sans altérer la survie de la cellule, va être à l’origine de dysfonctionnements et éventuellement de maladies. Ce mécanisme viral a été mis en évidence pour la première fois pour le virus de la chorioméningite lymphocytaire, dans le début des années 1980, par le groupe du Dr Oldstone [1]. Depuis, un certain nombre d’études épidémiologiques, chez l’homme, et expérimentales, chez l’animal, ont suggéré que des virus mettant en place ce type de mécanisme pourraient être responsables de maladies chroniques du système nerveux central. Ils pourraient ainsi être à l’origine de certaines maladies psychiatriques ou neurologiques dont l’étiologie n’est pas encore connue [2].
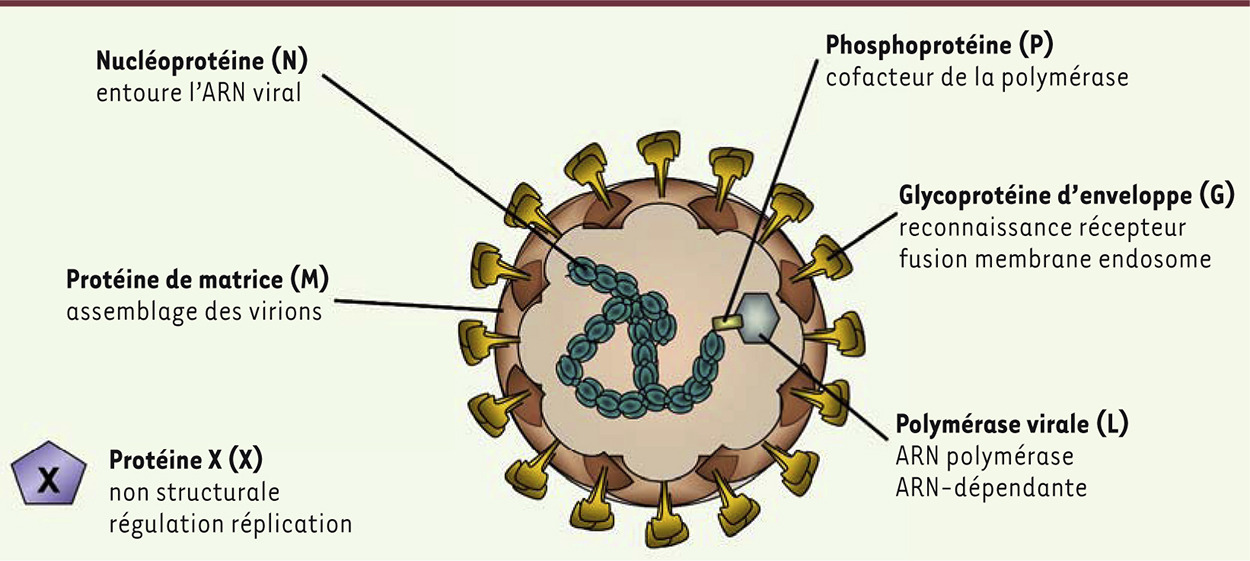
Le virus de la maladie de Borna est un exemple de ce type de virus. Il induit, chez diverses espèces animales, des désordres comportementaux rappelant ceux observés chez les patients schizophrènes ou bipolaires. C’est un virus enveloppé1, dont le génome est constitué d’un ARN simple brin, non-segmenté, de polarité négative2,, qui appartient à la famille des Bornaviridae dans l’ordre des Mononegavirales (Figure 1). Son génome est de petite taille (8,9 kb) et code pour 6 protéines virales : la nucléoprotéine (N), la phosphoprotéine (P), la protéine X (X), la protéine de matrice (M), la glycoprotéine d’enveloppe (G) et la polymérase (L). Pendant très longtemps, le virus de la maladie de Borna a été l’unique représentant des Bornaviridae. Mais les récentes avancées technologiques en matière de séquençage à haut débit (next-generation sequencing) ont permis la découverte de nouveaux membres de cette famille. L’avian-Borna virus, une forme aviaire du virus, a ainsi été découvert chez des psittacidés3, atteints de proventriculite4, une maladie des systèmes nerveux et digestif [3]. Tout récemment, le variagated-squirrel 1 Borna virus a été découvert chez des écureuils multicolores (Sciurus variegatoides) et chez des patients humains décédés à la suite d’une encéphalite aiguë [4]. Cette dernière découverte suggère très fortement que ce membre de la famille des Bornaviridae est à classer dans les virus zoonotiques (les virus transmis de l’animal à l’homme et pathogènes pour l’homme) [11] (→). Dans le cas du virus de la maladie de Borna, la question de la zoonose est débattue depuis la fin des années 1980, moment où l’infection a été associée au développement de maladies psychiatriques. Cependant, il n’existe pas, à l’heure actuelle, de preuves formelles de son pouvoir pathogène pour l’homme [5]. Il n’en constitue pas moins un excellent modèle pour étudier les mécanismes par lesquels un virus persistant peut entraîner des dysfonctionnements dans le cerveau.
(→) Voir l’Éditorial de A. Salvetti et S. Baize, page 1055 de ce numéro
Différents groupes se sont ainsi attachés à comprendre les mécanismes cellulaires et moléculaires par lesquels ce virus perturbe les fonctions cérébrales des animaux et éventuellement de l’homme. Plusieurs études montrent qu’il altère les fonctions de cellules hautement spécialisées, les neurones et les astrocytes. Dans les neurones, il limite la croissance des neurites5 et la formation des synapses induite par un facteur neurotrophique (le brain-derived neurotrophic factor), et il perturbe la transmission synaptique. Dans les astrocytes, l’expression sélective d’une de ses protéines, la phosphoprotéine, induit des remaniements moléculaires qui conduisent à l’apparition de troubles du comportement chez la souris modifiée par transgenèse [6]. Nos travaux ont porté sur un troisième type de cellules du système nerveux central : les cellules souches [12, 13] (→). Ces cellules non différenciées, qui sont à l’origine des neurones, des astrocytes et des oligodendrocytes, sont présentes à la fois dans le cerveau embryonnaire, où elles participent à la formation du cerveau, et dans le cerveau adulte, dans des zones spécifiques appelées zones neurogéniques. Un dérèglement de la capacité de ces cellules à générer des neurones fonctionnels a été mis en cause dans les maladies neuro-développementales, mais aussi dans des maladies comportementales comme la dépression, la démence ou les psychoses [7, 8]. On sait maintenant que des virus peuvent être à l’origine de ces dérèglements de l’activité des cellules souches. C’est le cas par exemple du cytomégalovirus et du virus de l’immunodéficience humaine [9].
(→) Voir les Synthèses de J. Renaud et al., m/s n° 11, novembre 2015, page 979, et de E. Traiffort et J. Ferent, page 1115 de ce numéro
Le virus de la maladie de Borna peut-il également perturber le développement des neurones humains ? Et si oui, par quels mécanismes ? Ce sont les questions auxquelles nous avons cherché à répondre. Pour réaliser cette étude, il était important de se doter d’un modèle qui soit au plus près de la réalité physiologique. Nous avons donc isolé et cultivé des cellules souches neurales primaires d’origine humaine. Nous avons infecté ces cellules avec le virus de la maladie de Borna et montré que le virus affecte spécifiquement la formation des neurones (neurogenèse) sans perturber celle des astrocytes (astrogliogenèse) [10]. Ces premiers résultats mettaient donc en évidence que le virus de la maladie de Borna est capable d’induire des dysfonctionnements dans le développement des neurones. Nous avons ensuite exprimé des gènes du virus de la maladie de Borna individuellement dans les cellules, au moyen de vecteurs lentiviraux, et identifié une protéine virale capable de perturber la neurogenèse, la phosphoprotéine P (Figure 2). Nous avons montré que cette protéine induit une altération du programme moléculaire qui contrôle la formation des neurones. Elle module notamment plusieurs facteurs moléculaires (apolipoprotéine E, Noggin6,, TNR7, etc.) par des mécanismes qui restent à identifier.
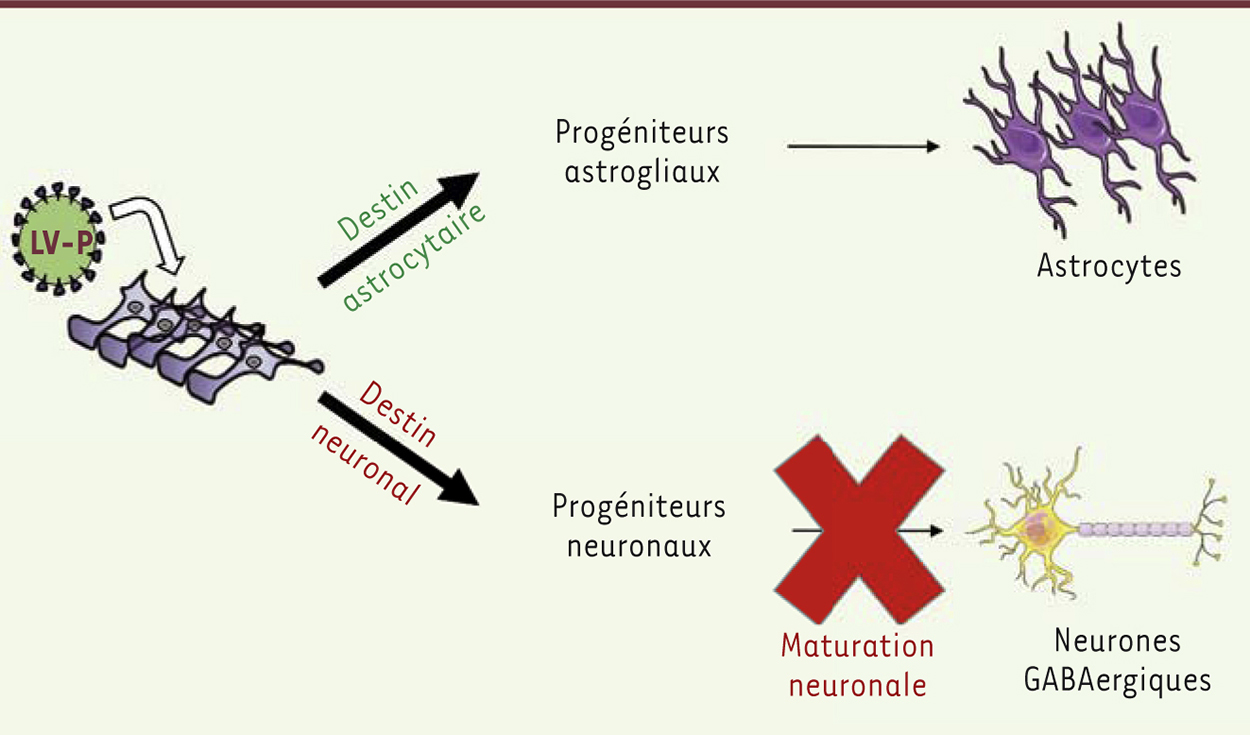
| Figure 2.
Représentation schématique du stade de différenciation auquel la phosphoprotéine du virus de la maladie de Borna altère le développement des neurones GABAergiques. L’astrogliogenèse et la neurogenèse à un stade précoce (acquisition de la spécification neuronale) ne sont pas perturbées par la phosphoprotéine P. L’acquisition d’un phénotype GABAergique est, en revanche, partiellement inhibée. LV-P : vecteur lentiviral exprimant le gène codant pour la phosphoprotéine P. |
Nous nous sommes ensuite intéressés à une autre question. Quels sous-types neuronaux sont affectés par la phosphoprotéine virale P, et à quel stade de leur différenciation ? Chacun des sous-types de neurones a un rôle spécifique dans le système nerveux central et peut réagir différemment à une infection virale. Il était donc important de résoudre cette question. Nous avons alors observé que les cellules souches de nos cultures produisent en grande majorité des neurones GABAergiques. La phosphoprotéine virale P perturbe la genèse de ces neurones, non en inhibant le processus précoce d’entrée des cellules dans une voie neuronale (la spécification neuronale), mais plutôt en limitant la maturation des neurones et l’acquisition du phénotype GABAergique (Figure 2). Il nous reste à déterminer si la protéine virale perturbe la genèse d’autres sous-types neuronaux (glutamatergiques, dopaminergiques, cholinergiques, etc.) ou si elle agit de façon spécifique sur le système GABAergique.
Les connaissances actuelles suggèrent l’existence, dans les maladies psychiatriques, d’un dysfonctionnement des neurones et d’une rupture de l’équilibre entre les systèmes excitateurs et inhibiteurs. Ces phénomènes seraient dus à une altération du développement des neurones. Dans le cas de la schizophrénie, une altération du développement des neurones GABAergiques est particulièrement mise en avant [8]. Nos travaux, montrant qu’une protéine virale perturbe le développement des neurones GABAergiques, sont à replacer dans ce contexte. Ils soutiennent l’hypothèse selon laquelle des virus pourraient être impliqués dans le développement des maladies psychiatriques. Pour autant, à l’heure actuelle, il est impossible d’associer le virus de la maladie de Borna lui-même à l’une de ces maladies. Les données épidémiologiques manquent et les difficultés de diagnostic, liées à la biologie du virus et au caractère chronique de ces maladies, rendent la tâche extrêmement difficile.