Le cil, organite cellulaire conservé chez de nombreux eucaryotes, est un prolongement membranaire constitué de microtubules et doté de fonctions sensorielles et/ou locomotrices particulières [1]. On distingue le cil primaire, non-motile et présent dans la plupart des types cellulaires, du cil motile qui est présent en un unique exemplaire dans des cellules « monociliées », et jusqu’à plusieurs centaines dans des cellules dites « multiciliées » (→). Chez les vertébrés, ces cellules multiciliées bordent la surface de certains tissus comme les voies respiratoires, les ventricules cérébraux, le tractus génital féminin, les placodes1 olfactives du poisson zèbre ou encore l’épiderme d’embryon de grenouille [2, 3]. Grâce au battement coordonné des cils motiles, les cellules multiciliées jouent un rôle important dans divers processus physiologiques comme l’évacuation, par l’épithélium respiratoire, des particules inhalées piégées dans le mucus, la circulation du liquide céphalo-rachidien ou la progression de l’embryon dans le tractus génital [2]. Un dysfonctionnement ou une diminution du nombre de ces cils motiles peut être la cause ou aggraver les symptômes de nombreuses pathologies telles que des ciliopathies (comme les dyskinésies ciliaires touchant le système respiratoire) ou des maladies respiratoires chroniques (comme la mucoviscidose, l’asthme ou les broncho-pneumopathies chroniques obstructives) [2]. La fabrication de multiples cils motiles par les cellules multiciliées (processus appelé multiciliogenèse) intervient au cours du développement embryonnaire, ainsi que lors de la régénération de certains épithéliums spécialisés. Elle nécessite plusieurs étapes clés successives : (1) la sortie du cycle cellulaire, (2) l’acquisition de l’identité « cellule multiciliée » sous le contrôle des voies de signalisation Notch et BMP (bone morphogenetic protein), (3) la réorganisation du réseau apical d’actine, (4) la multiplication massive de centrioles, qui vont migrer et s’ancrer dans le réseau apical d’actine pour devenir des corps basaux, et enfin (5) l’élongation des axonèmes2 des cils motiles à partir de ces mêmes corps basaux qui jouent le rôle de centre organisateur des microtubules à la base de chaque cil (Figure 1) [4]. L’élucidation des mécanismes qui gouvernent la multiciliogénèse est un prélude indispensable à la mise en place de nouvelles stratégies thérapeutiques plus efficaces pour lutter contre les pathologies associées à des désordres ciliaires. Plusieurs facteurs de transcription, comme FoxJ1 (Forkhead box protein J1) ou certains membres de la famille RFX (regulatory factor X) [5], de même que les voies de signalisation Notch et BMP [3, 6], étaient déjà connus pour agir à plusieurs étapes clés de la multiciliogénèse. Notre équipe s’est concentrée sur l’étude du rôle potentiel des microARN dans ce mécanisme.
(→) Voir le numéro thématique « Cils primaires et ciliopathies », m/s n° 11, novembre 2014
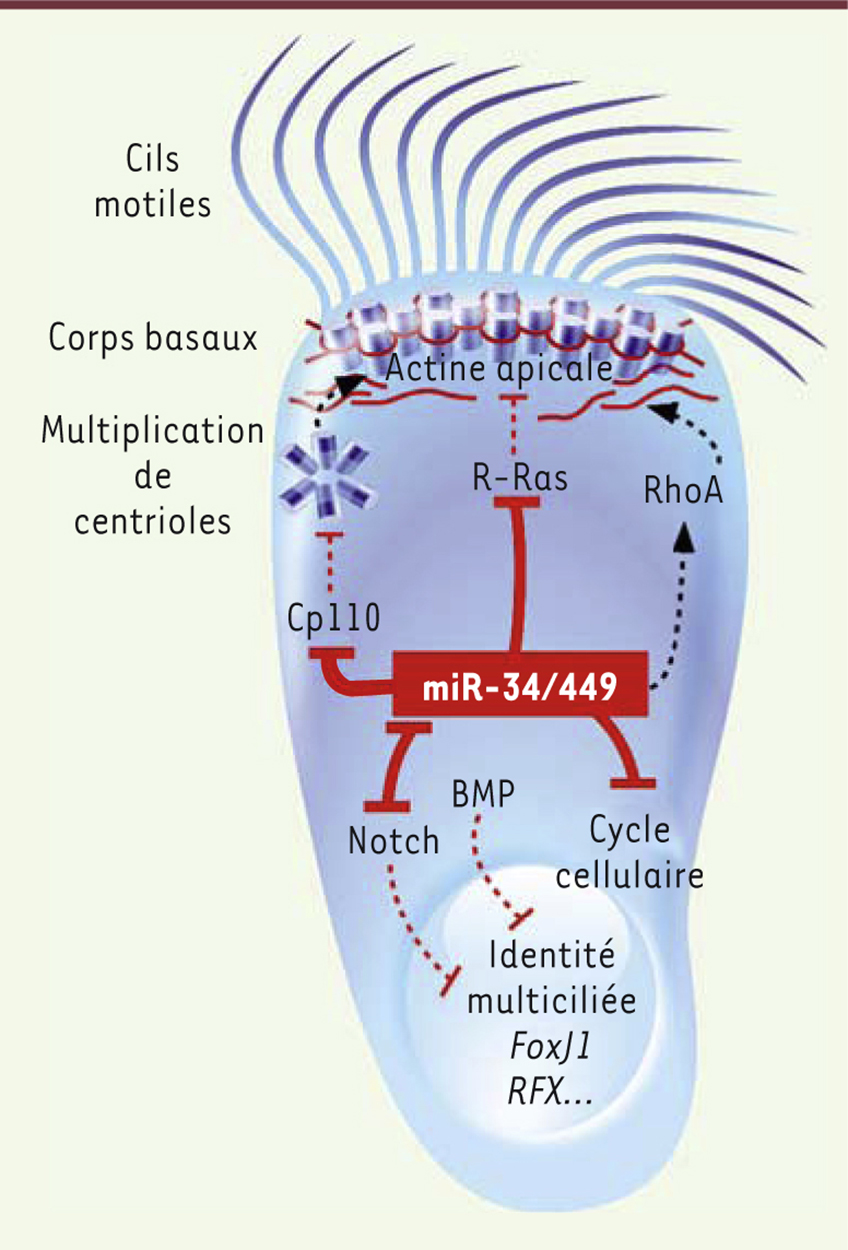
| Figure 1.
Illustration du rôle des miR-34/449 au cours de la multiciliogenèse. L’inhibition des voies BMP (bone morphogenetic protein) et Notch est un événement précoce requis pour l’entrée en différenciation « multiciliée ». L’expression spécifique des miR-34/449 dans les progéniteurs des cellules multiciliées permet la sortie du cycle cellulaire et l’initiation de l’acquisition de l’identité « multiciliée » en inhibant la voie Notch. L’inhibition de la voie Notch renforce l’expression de miR-449. Les miR-34/449 favorisent ensuite (1) la réorganisation du réseau apical d’actine, en réprimant R-Ras et en modulant l’activité de RhoA, et (2) la multiplication massive et la maturation des corps basaux, en réprimant Cp110. Après leur migration au pôle apical, ces corps basaux s’ancrent au réseau apical d’actine. En parallèle, les facteurs de transcription FoxJ1 (Forkhead box protein J1) et RFX (regulatory factor X) activent l’expression des constituants nécessaires à l’assemblage et au mouvement des cils motiles. |
En 2011, nous avions établi un lien fonctionnel, conservé des amphibiens jusqu’à l’homme, entre la famille de microARN (miARN ou miR) miR-34/449 et la multiciliogénèse [3]. Les miARN sont des petits ARN non-codants endogènes qui contrôlent de nombreux processus biologiques en réprimant l’expression génique par des mécanismes post-transcriptionnels [7]. Nous avions montré, à partir d’épithélium respiratoire humain et d’épiderme d’embryon de xénope, que les miR-34/449, dont l’expression était fortement et spécifiquement induite dans les cellules multiciliées, déclenchaient la multiciliogénèse en bloquant à la fois le cycle cellulaire et la voie Notch, deux étapes précoces de la différenciation « multiciliée » [3]. Nos résultats ont depuis été confirmés par deux études montrant que des souris invalidées pour miR-34/449 présentent des défauts de multiciliogénèse [8, 9]. Plus récemment, nous avons mis en évidence une boucle de régulation négative réciproque entre miR-34/449 et la voie Notch [10]. Cette boucle permet l’accumulation de molécules miR-34/449 dans les cellules multiciliées engagées dans leur voie de différenciation, offrant la possibilité à ces microARN de contrôler d’autres cibles à des étapes plus tardives de la multiciliogénèse. En accord avec cette hypothèse, les travaux de Song et ses collègues suggèrent que la protéine centriolaire Cp110, dont l’expression doit être réprimée pour permettre la maturation des corps basaux, représenterait une cible supplémentaire importante des miR-34/449 [8].
Nous montrons aujourd’hui, dans une nouvelle étude, que ces mêmes miR-34/449 contrôlent également la formation du réseau apical d’actine, une autre étape clé de la multiciliogenèse, en agissant sur la voie des petites protéines G [10]. L’invalidation spécifique des miR-34/449 (à l’aide d’oligonucléotides antisens), aussi bien dans l’épiderme d’embryon de xénope que dans l’épithélium respiratoire humain, perturbe fortement la formation du réseau apical d’actine et des cils motiles. Dans les cellules respiratoires humaines, l’expression des miR-34/449 favorise la formation des fibres de stress d’actine et des points focaux d’adhésion. Elle induit également une augmentation de l’activité de la petite protéine G RhoA (Ras homolog family member A), régulateur clé du cytosquelette d’actine, et ce d’une manière indépendante de la voie Notch (Figure 1). Chez le xénope, l’inhibition des miR-34/449 bloque la réorganisation apicale du réseau d’actine et la multiciliogenèse, tandis que l’activité RhoA est toujours détectable. Ces résultats suggèrent l’implication d’autres cibles des miR-34/449, en aval de la voie RhoA et indépendantes de la voie Notch, dans le contrôle de la réorganisation apicale du réseau d’actine qui s’opère lors de la multiciliogenèse.
Nous avons ainsi identifié, parmi les cibles des miR-34/449, la petite protéine G R-Ras (Ras-related protein) comme une des cibles, conservées de l’amphibien à l’homme, contribuant à la formation du réseau apical d’actine au cours de la multiciliogenèse. Dans ces deux espèces, les miR-34/449 répriment spécifiquement l’expression du gène RRAS, à la fois au niveau du transcrit et de la protéine (Figure 1) [10].
Il est à noter que, chez l’homme, une invalidation trop précoce du gène RRAS à l’aide d’une stratégie d’interférence utilisant un siARN (small interfering RNA) affecte le remodelage apical d’actine et la multiciliogénèse, tout en augmentant l’activité RhoA, suggérant que R-Ras est probablement nécessaire aux premiers stades de la multiciliogenèse. De plus, dans nos deux modèles, le blocage spécifique de la liaison des miR-34/449 aux transcrits du gène RRAS réprime à la fois la réorganisation du réseau apical d’actine et la multiciliogenèse, mimant ainsi les effets obtenus par l’invalidation des miR-34/449. Dans les embryons de xénope, ces défauts sont corrigés lorsque l’on empêche les transcrits du gène RRAS, protégés contre l’action des miR-34/449, d’être traduits. Enfin, l’action de miR-34/449 aboutit à une relocalisation de la filamine-A, une protéine de liaison à l’actine, à proximité des corps basaux, et à la stabilisation du réseau apical d’actine, pré-requis indispensable pour l’ancrage des corps basaux. L’ensemble de nos résultats indiquent que les miR-34/449 contrôlent la réorganisation du réseau apical d’actine au cours de la multiciliogenèse en réprimant directement le gène RRAS, d’une manière indépendante de la voie Notch [10].
En conclusion, nos travaux illustrent comment certains microARN sont capables de contrôler les étapes successives d’un processus biologique complexe, via la répression de plusieurs molécules clés de voies de signalisation distinctes. Ce travail ouvre de nouvelles perspectives pour l’étude de l’étiologie des ciliopathies et offre également un éclairage intéressant en cancérologie, puisque l’amplification du nombre de centrioles est une caractéristique fréquente des cellules tumorales.