| |
| Med Sci (Paris). 2016 January; 32(1): 51–56. Published online 2016 February 5. doi: 10.1051/medsci/20163201009.Exposition maternelle aux polluants et altération de la santé métabolique à l’âge adulte Brigitte Le Magueresse-Battistoni,1* Hubert Vidal,1 and Danielle Naville1 1Laboratoire de recherche en cardiovasculaire, métabolisme, diabétologie et nutrition, CarMeN, université Lyon 1, Inserm U1060, UMR Inra 1397, Insa-Lyon, faculté de médecine Lyon-sud-BP12, 165, chemin du Grand Revoyet, 69921Oullins Cedex, France |

L’industrialisation a entraîné la présence, dans les différents compartiments de l’environnement, de plusieurs milliers de molécules anthropiques transportées parfois sur de très longues distances, « mondialisant » la pollution. Certains de ces polluants peuvent affecter le système hormonal et, ainsi, interférer avec le développement de l’organisme ; ce sont les perturbateurs endocriniens [33] (→). Les premières alertes impliquant ces polluants particuliers, furent lancées par les chercheurs investis en biologie de la reproduction mais, progressivement, il est apparu que l’ensemble des fonctions relevant de l’endocrinologie pouvaient être ciblées par ces perturbateurs endocriniens. Aujourd’hui, la notion de perturbation endocrinienne reste encore très débattue. Cependant la communauté scientifique s’accorde sur la définition donnée par l’OMS (Organisation mondiale de la santé) [1] : « les perturbateurs endocriniens sont des substances chimiques d’origine naturelle ou artificielle étrangères à l’organisme qui peuvent interférer avec le fonctionnement du système endocrinien et induire ainsi des effets délétères sur cet organisme ou sur ses descendants ». Le terme de perturbateur métabolique fut ensuite proposé [2] pour qualifier les polluants pour lesquels des corrélations entre exposition et obésité et/ou anomalies métaboliques associées (diabètes) avaient été établies dans des études épidémiologiques [3], et pour lesquels une relation de causalité [4, 5] avait même été mise en évidence, dans des études expérimentales.
(→) Voir la Synthèse de C. Mauduit et al., p. 45 de ce numéro
L’obésité est un problème majeur de santé publique parce qu’elle est un facteur de risque pour le développement de troubles du métabolisme regroupés sous le terme de syndrome métabolique, préfigurant plusieurs maladies graves comme le diabète de type 2, les troubles cardiovasculaires et certains cancers (→).
(→) Voir le numéro thématique Diabète, m/s n° 8-9 vol. 19, août-septembre 2003
Ces maladies chroniques dont l’évolution est pandémique représentent un défi sociétal majeur en santé et bien-être et un poids économique estimé à 5-10 % des budgets de santé des pays développés (17 milliards d’euros en France en 2010). Ainsi, l’OMS prévoit qu’en 2030, le nombre de personnes en surpoids devrait atteindre 3,3 milliards tandis que le diabète touchera plus de 400 millions de personnes dans le monde [6]. Les enfants ne sont pas épargnés. En 2010, près de 42 millions d’enfants âgés de 0 à 5 ans étaient en surpoids dans le monde [7]. Aujourd’hui, 10 % des enfants entre 5 et 17 ans sont en surcharge pondérale ou obèses et le phénomène s’aggrave [6]. Or, ces enfants risquent de rester obèses une fois adultes et sont davantage susceptibles de contracter diabète et maladies cardiovasculaires à un âge plus précoce. Par ailleurs, une estimation prudente du coût lié à l’impact sanitaire des polluants en Europe, dans le domaine de l’obésité et du diabète, dépasse les 18 milliards d’euros annuels [8]. Il est donc important, tant pour la qualité de vie que pour les conséquences sociétales et économiques, de s’intéresser à la part environnementale dans l’étiologie de l’obésité et des maladies métaboliques associées. |
Les perturbateurs endocriniens et métaboliques Si l’industrialisation a favorisé le progrès sociétal améliorant l’espérance de vie, elle est aussi à l’origine de la dégradation de l’environnement (comme les pollutions industrielles à l’origine du déclin de certaines populations de la faune sauvage) et de tragédies humaines (comme celle du distilbène). C’est à la conférence de Wingspread, organisée en 1991, que fut proposé le concept de perturbateur endocrinien pour rendre compte des nouvelles découvertes scientifiques sur des substances étrangères à l’organisme (pesticides, plastifiants, polluants organiques persistants) (→) capables de mimer une action hormonale ou, au contraire, d’exercer une action antagoniste à l’action hormonale, ou encore, d’interférer avec les mécanismes de production, de transport ou de métabolisme des hormones ou de leurs récepteurs [9]. Ainsi, la perturbation endocrinienne se caractérise par une modification du système endocrinien susceptible d’entraîner un effet toxique lorsque les régulations homéostatiques sont perturbées. Cette perturbation se situe donc à l’interface entre l’endocrinologie et la toxicologie. En toxicologie classique, la toxicité d’une molécule chimique (hors molécules cancérigènes pour lesquelles il n’existe pas de dose sans effet) repose sur la notion de seuil toxicologique et sur la linéarité des effets toxiques engendrés, ainsi que sur l’immédiateté des effets générés en réponse à l’exposition, molécule par molécule. On calculera donc, pour chaque molécule chimique étudiée en expérimentation animale, des valeurs toxicologiques de référence, comme la dose journalière tolérable, sur lesquelles repose la réglementation en vigueur. L’endocrinologie, quant à elle, est une discipline intégrative qui s’intéresse au système endocrinien et à sa régulation homéostatique.
(→) Voir liste dans la Synthèse de C. Mauduit et al., page 45 de ce numéro
Précisément, le système endocrinien (Encadré) est le système qui contrôle toutes les grandes fonctions de l’organisme incluant le développement (reproduction, comportement, croissance, métabolisme énergétique, etc.) et le maintien de ces fonctions à l’âge adulte. Il requiert pour cela l’intégration de la signalisation d’un grand nombre d’hormones. Ainsi, la régulation du métabolisme énergétique relève de l’action intégrée de la leptine, de l’insuline, de l’hormone de croissance, d’hormones thyroïdiennes, des glucocorticoïdes etc., en plus des œstrogènes/androgènes puisqu’elle est très marquée sexuellement que ce soit dans le comportement alimentaire ou la répartition des masses graisseuses [10]. La définition du système endocrinien implique qu’une perturbation induite par des substances étrangères agissant en mimant l’action hormonale (hormono-mimétisme) se caractérise par des actions à très faibles doses qui suivent une relation non linéaire [11], et dont les effets seront d’autant plus marqués – voire irréversibles – que la fonction endocrine ciblée sera immature au moment de l’exposition, c’est-à-dire pendant les périodes fœtale et néonatale. Les effets seront aussi très dépendants du sexe. Quelques 900 molécules ont été identifiées comme perturbateurs endocriniens, et une vingtaine de molécules, ou familles de molécules, seraient des perturbateurs métaboliques [12], au nombre desquelles les œstrogéno-mimétiques (DES [diéthylstilbestrol ou distilbène], bisphénol A et dichlorodiphényltrichloroéthane [ou DDT]1,, les phytoœstrogènes), mais également d’autres classes de polluants possiblement retrouvés dans l’alimentation comme les organoétains dont le tributylétain2, certains pesticides, perfluorés et phtalates qui peuvent cibler les voies de signalisation de différents récepteurs nucléaires : récepteurs des hormones sexuelles, récepteurs des glucocorticoïdes ou récepteurs activés par les proliférateurs de peroxysomes, PPAR (peroxisome proliferator-activated receptor) |
Le système endocrinien Le système endocrinien est constitué par un ensemble de glandes dites endocrines parce qu’elles secrètent des messagers chimiques ou hormones, véhiculés dans le sang et qui produisent à distance des effets biologiques spécifiques après liaison à des récepteurs de haute affinité exprimés par les organes cibles. Ce système est extrêmement sensible et les hormones agissent à très faibles doses (pM) suivant une relation non-linéaire entre la concentration hormonale et l’occupation de leurs récepteurs spécifiques. L’activation des récepteurs induit ensuite des signalisations complexes, génomiques (liaison à l’ADN) et/ou nongénomiques (ex : phosphorylations en cascade) mais également tout un système de contre-régulations contextuelles (quantité de récepteurs, concentrations hormonales, présence de cofacteurs activateurs ou répresseurs, rétrocontrôles hormonaux exercés principalement sur l’hypophyse et l’hypothalamus) garantes du maintien de l’homéostasie physiologique. Ce système de contre-régulations n’est pas opérationnel pendant la vie foetale et chez les jeunes enfants. Il existe ainsi des périodes de forte sensibilité à l’action hormonale qui confèrent aux hormones un rôle organisationnel, par exemple sur la différenciation sexuelle et le développement du comportement sexuel (testostérone, oestradiol), le développement cognitif (hormones thyroïdiennes), ou sur la mise en place du comportement alimentaire (testostérone, oestradiol, glucocorticoïdes, leptine).
|
|
Exposition aux polluants et santé métabolique à l’âge adulte et dans les générations suivantes Fenêtres de vulnérabilité aux polluants et concept DOHaD Depuis les premiers travaux de l’épidémiologiste David Barker dans les années 1980 [ 13], de très nombreuses études épidémiologiques et expérimentales ont confirmé l’importance de la nutrition maternelle pendant les périodes critiques des développements prénatal et postnatal des mammifères, et ont démontré que des régimes nutritionnels déséquilibrés pouvaient induire des modifications permanentes du métabolisme énergétique et favoriser le développement des maladies chroniques comme l’obésité ou le diabète et autres maladies métaboliques associées. Le concept DOHaD (pour developmental origins of health and adult diseases), selon lequel la santé ou les maladies de l’âge adulte trouvent leur origine dans les conditions environnementales rencontrées au cours du développement était né. L’avancée des études sur les perturbateurs endocriniens a permis d’étendre ce concept et de souligner les conséquences à long terme d’une exposition précoce aux polluants pouvant se cumuler avec d’autres facteurs de stress environnementaux, notamment nutritionnels [ 12]. De fait, l’exposition à ces deux sources de stress – polluants et facteurs nutritionnels – est souvent confondue puisque l’alimentation est une voie majeure d’exposition à différents perturbateurs endocriniens, en particulier dans une alimentation de type occidental caractérisée par des aliments prêts à l’emploi, souvent gras et conditionnés dans des emballages alimentaires. De surcroît, il a été montré qu’à indice de masse corporelle (IMC) équivalent, l’incidence du diabète augmente avec la concentration sérique en polluants [ 14]. Une interaction délétère entre obésité et polluants a également été décrite en expérimentation animale [ 5]. L’exposition est soit directe par les polluants organiques persistants (POP), très rémanents, et qui, par bioaccumulation, contaminent la chaîne alimentaire, soit indirecte par migration du contenant vers le contenu comme dans le cas des bisphénols ou des phtalates présents dans les matériaux au contact des aliments ( →).
(→) Voir la Synthèse de C. Mauduit et al., page 45 de ce numéro
Les fœtus et les jeunes enfants sont exposés via la mère aux différents polluants présents dans le sang du cordon, le placenta ou le lait maternel [12], et, une fois sevrés, directement par le phénomène du portage des mains à la bouche, qui accentue l’exposition. Le système de détoxication hépatique, qui prend en charge les molécules étrangères, est largement immature chez le fœtus. Il se met en place progressivement chez le jeune enfant [15], ce qui accroît encore la vulnérabilité des périodes fœtale et néonatale vis-à-vis des polluants. Effets métaboliques des polluants et récepteur PPARγ Le terme d’obésogène a été proposé [ 16, 17] pour qualifier les perturbateurs endocriniens et/ou métaboliques capables d’induire une augmentation pondérale chez l’individu exposé en agissant soit directement sur les adipocytes, par l’augmentation de leur capacité de prolifération (hyperplasie) ou de stockage (hypertrophie), soit indirectement par la modification du comportement alimentaire (régulation de l’appétit et de la satiété) ou du métabolisme de base, ou encore par l’amélioration de l’efficacité énergétique des calories ingérées. Les organoétains constituent une famille type d’obésogènes avérés en expérimentation animale [ 16] comme, en particulier, le tributylétain (TBT), un biocide puissant utilisé dans les peintures de coques de navires ( antifouling, empêche la fixation des organismes aquatiques sur la coque des navires), et aujourd’hui interdit d’usage. Chez la mère gestante exposée, ces molécules orientent le devenir des cellules souches mésenchymateuses du fœtus vers la lignée adipocytaire au détriment de la lignée ostéoblastique. Cet effet dépend de l’activation du récepteur nucléaire PPARγ ( peroxisome proliferator-activated receptor g) qui contrôle la différenciation adipocytaire. Le TBT est également un agoniste du RXR ( retinoid X receptor) avec lequel PPARγ s’hétérodimérise pour activer la transcription de ses gènes cibles comme par exemple FABP4 ( fatty acid binding protein 4) [ 18]. L’effet perturbateur endocrinien du TBT pourrait s’exercer non seulement via l’activation directe de PPARγ et la stimulation de gènes cibles, mais également par des mécanismes épigénétiques tels que la déméthylation du promoteur du gène FABP4, permettant la transmission de l’effet obésogène [ 18] ( →).
(→) Voir la Synthèse de D. Vieau et al., page 81 de ce numéro
Il a en effet été montré qu’une exposition in utero au TBT provoquait, dans les générations F1 et F2, mais aussi dans la génération F3, une augmentation du poids des tissus adipeux, une stéatose hépatique et l’expansion du tissu adipeux (par hypertrophie et prolifération) [19]. Cet effet obésogène, alors qualifié de transgénérationnel puisqu’il est observable à la génération F3 qui n’a pas été exposée au polluant, a été également rapporté dans des modèles de rongeurs, modèles dans lesquels les mères gestantes (génération F0) ont été exposées au DDT ou à un mélange contenant du bisphénol A et des phtalates (DEHP et DBP) [20]. La possibilité pour les polluants obésogènes d’exercer des effets de type épigénétique (méthylation globale de l’ADN) a été observée in vitro, dans un modèle cellulaire de préadipocyte murin de 3T3-L1, pour le TBT, mais aussi pour le retardateur de flamme BDE-47 (2,2’, 4,4’- tétrabromodiphényléther), qui est également capable de stimuler in vitro la différenciation adipocytaire [21]. Effets métaboliques des polluants et récepteurs des œstrogènes D’autres mécanismes d’action ont été impliqués dans des effets obésogènes et notamment des mécanismes œstrogéno-dépendants. Par exemple, les souris manipulées génétiquement pour ne plus exprimer soit le récepteur α des œstrogènes (ERα), soit l’aromatase, l’enzyme qui métabolise la testostérone en œstradiol-17β, développent une obésité à l’âge adulte [ 10]. Cependant, dans un modèle de rongeur, une administration néonatale de diéthylstilbestrol qui induit une activation de la signalisation œstrogénique, entraîne aussi une obésité à l’âge adulte [ 22]. Une association positive entre les niveaux sériques de diéthylstilbestrol mesurés à la naissance dans le sang du cordon et l’IMC (indice de masse corporelle) ultérieur des jeunes enfants a également été montrée [ 23]. Ces résultats soulignent l’importance des fenêtres d’exposition aux composés œstrogéniques dans la survenue des événements métaboliques futurs, possiblement parce que les œstrogènes ont des actions pléiotropes qui dépendent d’interactions contextuelles avec de nombreuses voies de signalisation comme la voie PPAR [ 24, 25]. Ainsi, il a été montré, in vitro, que l’activation simultanée des voies œstrogéno- et PPAR-dépendantes, en réponse à des phytoœstrogènes, oriente le devenir de cellules mésenchymateuses de moelle osseuse de souris (modèle de cellules KS483) en ostéoblastes ou en adipocytes selon la dose utilisée 3, : à faible dose, l’action œstrogénique est majoritaire et oriente vers un devenir ostéoblastique, tandis qu’à fortes doses, les phytoœstrogènes activent essentiellement la voie PPARγ conduisant à une différenciation en adipocytes [ 24]. De fait, tous les récepteurs nucléaires impliqués dans la régulation du métabolisme énergétique constituent des cibles potentielles pour les perturbateurs endocriniens, comme le récepteur ERRγ (estrogen-related receptor gamma) qui a été récemment identifié comme une cible du bisphénol A [26]. Effets métaboliques des polluants et études épidémiologiques Si les expérimentations animales ont permis de recenser le caractère obésogène d’un grand nombre de perturbateurs endocriniens, et d’alerter ainsi les pouvoirs publics sur la nécessité d’une réglementation exigeante, l’exploration épidémiologique du concept DOHaD repose sur des études prospectives. Or, ces dernières présentent très souvent des limitations liées à la taille des cohortes et à l’existence de différences de réponse selon le sexe de l’individu, le statut pubertaire et l’index de masse corporelle (ce qui est attendu s’agissant de perturbateurs endocriniens). D’autres paramètres doivent également être considérés, comme les groupes ethnique et géographique ; l’ensemble étant en relation possible avec l’effet cocktail des polluants auxquels la population se trouve exposée et avec les habitudes alimentaires. De plus, le dosage des perturbateurs endocriniens est réalisé dans les urines, ou le sang du cordon, sur un prélèvement unique, alors que la répétition des mesures sur plusieurs prélèvements serait indispensable pour une bonne appréciation de l’exposition [ 27], en particulier pour les polluants à demi-vie courte comme les phthalates et les bisphénols. Pour certains polluants persistants, le placenta constituerait un bon reflet de l’exposition in utero [ 28]. Pour autant, en considérant toutes ces limites, les différentes études s’accordent à reconnaître la plausibilité de l’hypothèse d’un impact des perturbateurs endocriniens dans l’étiologie de l’épidémie d’obésité et/ou des maladies métaboliques associées, en particulier pour les polluants persistants [ 4, 29]. Par exemple, la concentration placentaire de TBT est associée positivement avec le poids des garçons pendant les trois premiers mois de la vie [ 28]. Le DDT, qui est un œstrogéno-mimétique, ou son métabolite, le DDE ( dichlorodiphenyldichloroethylene) qui exerce une action antagoniste vis-à-vis des androgènes, auraient des actions obésogènes chez les garçons (et pas chez les filles) [ 30, 31] après une exposition intra-utérine. Des associations positives ont été également retrouvées entre exposition intra-utérine aux polychlorobiphényls (PCB) œstrogéno-mimétiques et poids corporel chez les filles [ 30]. |
Aujourd’hui, chaque individu se trouve exposé à plusieurs des quelques 900 molécules classées comme perturbateurs endocriniens selon, entre autres, sa localisation géographique, ses habitudes alimentaires, son âge et son sexe. Ces substances naturelles ou anthropiques sont indissociables de notre mode de vie tant elles ont envahi notre quotidien. La réglementation en vigueur repose sur des valeurs référentes, établies molécule par molécule, mais ne prend en compte ni les spécificités de la perturbation endocrinienne, et notamment les effets à faibles doses, ni l’effet cocktail. Dans ce contexte d’incertitudes liées à l’impact des polluants en santé humaine, en particulier pendant les périodes fœtale et périnatale de très forte vulnérabilité, il est important d’appréhender l’effet des faibles doses et d’étudier l’effet cocktail. Ainsi, en utilisant un modèle d’obésité induite chez la souris par une alimentation enrichie en gras et en saccharose, il a été démontré que de faibles doses de polluants (de l’ordre des doses considérées sans effet pour l’homme) ne sont en fait pas sans effet lorsque plusieurs polluants sont administrés en mélange dans un contexte d’obésité (Figure 1) [32]. Ces résultats soulignent l’importance de repenser l’évaluation des risques en considérant les effets cocktails pour mieux protéger les populations des effets métaboliques des polluants environnementaux, et, en particulier, les fœtus et les jeunes enfants, et à institutionnaliser le principe de précaution pour la protection des enfants à venir et des adultes qu’ils deviendront.
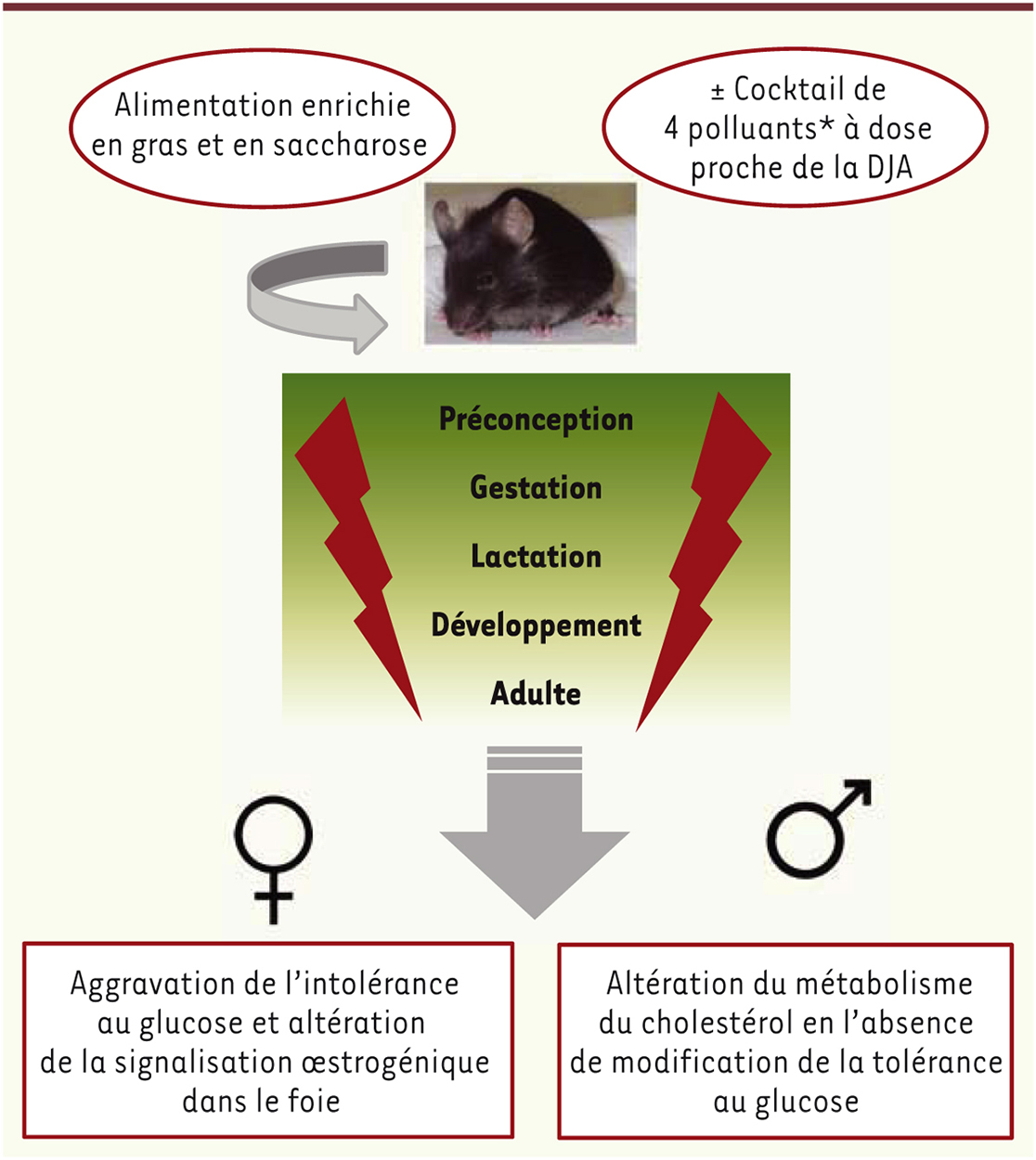
 | Figure 1.
Le protocole développé est un modèle d’obésité induite chez la souris par une alimentation enrichie en gras et en saccharose. Le protocole développé est un modèle d’obésité induite chez la souris par une alimentation enrichie en gras et en saccharose.Les souris ont été soumises à une exposition chronique incluant les phases de préconception, gestation et lactation, à un mélange de 4 polluants présents dans l’alimentation (le PCB [polychlorobiphényl]153, la TCDD [2,3,7,8-tétrachlorodibenzo-p-dioxine], le BPA [bisphénol A] et le diéthylhexyl phtalate [DEHP]) tous capables de perturbations endocriniennes et à large spectre d’action. Les doses utilisées entraînent une exposition correspondant globalement aux doses journalières autorisées (DJA) et même à 10 fois moins pour le BPA. Dans ces conditions, aucune toxicité générale n’est observée. Il n’y a pas non plus de modifications du poids chez les animaux exposés. En revanche, des effets très fortement dépendants du sexe de l’animal sont observés au niveau du foie. Les mâles présentent une altération du métabolisme des lipides et du cholestérol, tandis que les femelles présentent une aggravation de l’intolérance au glucose associée à l’obésité, et une altération de la signalisation oestrogénique [ 32]. Cela pourrait signifier que l’exposition aux contaminants alimentaires se traduit par une baisse de la protection exercée par les oestrogènes contre les maladies métaboliques. * 2,3,7,8-tétrachlorodibenzop- dioxine (TCDD), polychlorinated biphenyl (PCB153), Di-[2-éthylhexyl] phthalate (DEHP), bisphénol A (BPA). |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
WHO/UNEP . State of the science of endocrine disrupting chemicals – 2012. An assessment of the state of the science of endocrine disruptors prepared by a group of experts for the United Nations Environment Programme (UNEP) and WHO . Geneva: : WHO; , 2013 : 296 p. 2.
Casals-Casas C, Desvergne B. Endocrine disruptors: from endocrine to metabolic disruption . Ann Rev Physiol. 2011; ; 73 : :135.–162. 3.
Thayer KA, Heindel JJ, Bucher JR, Gallo MA. Role of environmental chemicals in diabetes and obesity: a National toxicology program workshop review . Environ Health Perspect. 2012; ; 120 : :779.–789. 4.
Ruzzin J, Petersen R, Meugnier E, et al. Persistent organic pollutant exposure leads to insulin resistance syndrome . Environ Health Perspect. 2010; ; 118 : :465.–471. 5.
Le Magueresse-Battistoni B, Vidal H, Naville D. Lifelong consumption of low-dosed food pollutants and metabolic health . J Epidemiol Community Health. 2015; ; 69 : :512.–515. 7.
De Onis M, Blossner M, Borghi E. Global prevalence and trends of overweight and obesity among preschool children . Am J Clin Nutr. 2010; ; 9 (2): :1257.–1264. 8.
Legler J, Fletcher T, Govarts E, et al. Obesity, diabetes, and associated costs of exposure to endocrine-disrupting chemicals in the European Union . J Clin Endocrinol Metab. 2015; ; 100 : :1278.–1288. 9.
Cravedi JP, Zalko D, Savouret JF, et al. Le concept de perturbation endocrinienne et la santé humaine . Med Sci (Paris). 2007; ; 23 : :198.–204. 10.
Mauvais-Jarvis F, Clegg DJ, Hevener AL. The role of estrogens in control of energy balance and glucose homeostasis . Endocr Rev. 2013; ; 34 : :309.–338. 11.
Vandenberg LN, Colborn T, Hayes TB, et al. Hormones and endocrine-disrupting chemicals: low-dose effects and nonmonotonic dose responses . Endocr Rev. 2012; ; 33 : :378.–455. 12.
Barouki R, Gluckman PD, Grandjean P, et al. Developmental origins of non-communicable disease: implications for research and public health . Environ Health. 2012; ; 11 : :42.. 13.
Barker DJ, Eriksson JG, Forsen T, Osmond C. Fetal origins of adult disease: strength of effects and biological basis . Int J Epidemiol. 2002; ; 31 : :1235.–1239. 14.
Lee DH, Lee IK, Song K, et al. A strong dose-response relation between serum concentrations of persistent organic pollutants and diabetes: results from the National Health and Examination Survey 1999–2002 . Diabetes Care. 2006; ; 29 : :1638.–1644. 15.
Milbrath MO, Wenger Y, Chang CW, et al. Apparent half-lives of dioxins, furans, and polychlorinated biphenyls as a function of age, body fat, smoking status, and breast-feeding . Environ Health Perspect. 2009; ; 117 : :417.–425. 16.
Grun F, Blumberg B. Perturbed nuclear receptor signaling by environmental obesogens as emerging factors in the obesity crisis . Rev Endocr Metab Disord. 2007; ; 8 : :161.–171. 17.
Baillie-Hamilton PF. Chemical toxins: a hypothesis to explain the global obesity epidemic . J Altern Complement Med. 2002; ; 8 : :185.–192. 18.
Kirchner S, Kieu T, Chow C, et al. Prenatal exposure to the environmental obesogen tributyltin predisposes multipotent stem cells to become adipocytes . Mol Endocrinol. 2010; ; 24 : :526.–539. 19.
Chamorro-Garcia R, Sahu M, Abbey RJ, et al. Transgenerational inheritance of increased fat depot size, stem cell reprogramming, and hepatic steatosis elicited by prenatal exposure to the obesogen tributyltin in mice . Environ Health Perspect. 2013; ; 121 : :359.–366. 20.
Skinner MK. Endocrine disruptor induction of epigenetic transgenerational inheritance of disease . Mol Cell Endocrinol. 2014; ; 398 : :4.–12. 21.
Bastos Sales L, Kamstra JH, Cenijn PH, et al. Effects of endocrine disrupting chemicals on in vitro global DNA methylation and adipocyte differentiation . Toxicol In Vitro. 2013;; 27 : :1634.–1643. 22.
Newbold RR, Padilla-Banks E, Snyder RJ, Jefferson WN. Developmental exposure to estrogenic compounds and obesity . Birth Defects Res A Clin Mol Teratol. 2005; ; 73 : :478.–480. 23.
Verhulst SL, Nelen V, Hond ED, et al. Intrauterine exposure to environmental pollutants and body mass index during the first 3 years of life . Environ Health Perspect. 2009; ; 117 : :122.–126. 24.
Dang ZC, Lowik C. Dose-dependent effects of phytoestrogens on bone . Trends Endocrinol Metab. 2005; ; 16 : :207.–213. 25.
Yoon M. PPARalpha in obesity: Sex difference and estrogen involvement . PPAR Res. 2010; ; 2010 : :584296.. 26.
Tohme M, Prud’homme SM, Boulahtouf A, et al. Estrogen-related receptor gamma is an in vivo receptor of bisphenol A . FASEB J. 2014; ; 28 : :3124.–3133. 27.
Frederiksen H, Nielsen JK, Morck TA, et al. Urinary excretion of phthalate metabolites, phenols and parabens in rural and urban Danish mother-child pairs . Int J Hyg Environ Health. 2013; ; 216 : :772.–783. 28.
Rantakokko P, Main KM, Wohlfart-Veje C, et al. Association of placenta organotin concentrations with growth and ponderal index in 110 newborn boys from Finland during the first 18 months of life: a cohort study . Environ Health. 2014; ; 13 : :45.. 29.
De Cock M, van de Bor M. Obesogenic effects of endocrine disruptors, what do we know from animal and human studies? Environ Int. 2014; ; 70 : :15.–24. 30.
Valvi D, Mendez MA, Martinez D, et al. Prenatal concentrations of polychlorinated biphenyls, DDE, and DDT and overweight in children: a prospective birth cohort study . Environ Health Perspect. 2012; ; 120 : :451.–457. 31.
Warner M, Wesselink A, Harley KG, et al. Prenatal exposure to dichlorodiphenyltrichloroethane and obesity at 9 years of age in the Chamacos study cohort . Am J Epidemiol. 2014; ; 179 : :1312.–1322. 32.
Naville D, Pinteur C, Vega N, et al. Low-dose food contaminants trigger sex-specific, hepatic metabolic changes in the progeny of obese mice . FASEB J. 2013; ; 27 : :3860.–3870. 33.
Mauduit C, Siddeek B, Benahmed M. Origine développementale et environnementale de l’infertilité : rôle des perturbateurs hormonaux . Med Sci (Paris). 2016; ; 32 : :45.–50. |