| |
| Med Sci (Paris). 2016 January; 32(1): 66–73. Published online 2016 February 5. doi: 10.1051/medsci/20163201011.Impact de l’obésité et du diabète maternels sur la fonction placentaire Anne Gabory,1* Pascale Chavatte-Palmer,1,2 Anne Vambergue,3 and Anne Tarrade1,2* 1Inra, UMR 1198 biologie du développement et reproduction, Domaine de Vilvert, F-78350Jouy-en-Josas, France 2Fondation PremUp, 4, avenue de l’Observatoire, F-75006Paris, France 3Hôpital Claude Huriez, CHRU Lille, université Lille2, EA 4489 environnement périnatal et croissance, Faculté de médecine, place de Verdun, F-59000Lille, France |

Le placenta, situé à l’interface entre la mère et le fœtus, exerce plusieurs fonctions comme la tolérance immunitaire vis-à-vis de l’allogreffe que représente le conceptus [1], le transfert des nutriments, l’élimination des déchets fœtaux et la production d’hormones qui vont influencer les métabolismes fœtal, placentaire et maternel et donc le développement de l’unité fœto-placentaire [2]. Il existe différents types de placentation : épithéliochoriale, endothéliochoriale et hémochoriale qui se définissent selon le degré d’invasion et de destruction de l’endomètre utérin par le trophoblaste [3]. Quel que soit le type de placentation, le placenta est sensible aux conditions environnementales maternelles pouvant affecter sa taille, sa morphologie, sa vascularisation, la vitesse des flux utéro-placentaires, l’abondance des transporteurs des nutriments, son métabolisme, la production d’hormones, le stress oxydatif ou nitrosatif, le statut inflammatoire et/ou les marques épigénétiques (Figure 1). La nature des effets de l’environnement maternel sur la fonction placentaire varie, de plus, en fonction du stade de développement et du type de perturbations mais aussi du sexe du conceptus. Le placenta va donc s’adapter à cet environnement afin d’optimiser le transport des nutriments et des gaz et ainsi promouvoir la survie fœtale.
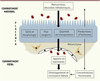 | Figure 1.
Impact de l’environnement maternel sur l’unité fœto-placentaire. Au cours de la grossesse, les désordres métaboliques maternels comme le diabète ou l’obésité peuvent influencer la structure et la fonction placentaire notamment en modifiant la vitesse des flux sanguins, l’expression des transporteurs des nutriments ainsi que la production d’hormones. Ces modifications affectent les transferts placentaires et par conséquent le développement et la croissance fœtale. |
Les modifications phénotypiques du placenta ayant des effets sur le phénotype de l’individu, le placenta représente donc un acteur crucial de la programmation fœtale ou DOHaD (developmental origins of health and disease), concept développé dans ce numéro thématique de médecine/sciences qui lui est consacré [4]. Dans cette synthèse, nous présenterons notamment l’impact des désordres métaboliques maternels, tels que l’obésité et le diabète, sur la fonction placentaire en nous appuyant sur des données obtenues chez l’homme et à partir de modèles animaux. |
Effets de l’obésité sur la fonction placentaire La prévalence de l’obésité ne cesse d’augmenter dans le monde. En France, d’après l’enquête ObEpi-Roche publiée en 20121, une femme sur cinq en âge de procréer est en surpoids, et environ 15 % des femmes présentent une obésité (index de masse corporelle, IMC ≥ 30 kg/m2). Cette obésité pré-gestationnelle favorise, au cours de la grossesse, les anomalies de la croissance fœtale, le développement d’un diabète gestationnel, le retard de croissance intra-utérin (RCIU) ou la macrosomie, la pré-éclampsie et la mortalité fœtale (→).
(→) Voir la Synthèse de P. Chavatte-Palmer et al., page 57 de ce numéro
En fin de grossesse, le statut métabolique des femmes obèses se caractérise par une augmentation de la sécrétion de leptine, de TNF-α (tumor necrosis factor) et d’IL(interleukine)-6, ainsi que par une diminution d’adiponectine, associées à une dyslipidémie et parfois à une insulino-résistance [5]. Cet environnement maternel va affecter le développement et la fonction placentaire, et donc la programmation fœtale. L’obésité maternelle impacte différents paramètres placentaires, tels que la biométrie, la vascularisation, les transferts de nutriments et l’inflammation. De plus, elle augmente le risque d’obésité chez sa descendance ainsi que le développement d’un syndrome métabolique au cours de l’enfance et pendant l’adolescence, ce qui favorise la persistance de l’obésité dans la génération future [6] (→).
(→) Voir page 57 de ce numéro
Dans cette première partie, nous traiterons de l’impact de l’obésité, en particulier chez l’homme. Il existe également une littérature abondante portant sur la surnutrition et l’obésité étudiées dans des modèles animaux que nous avons choisi de détailler dans le Tableau I.
Tableau I.
| Espèce/Modèle |
Phénotype maternel |
Poids fœtus et placenta |
Histologie |
Vascularisation placentaire |
Transferts placentaires |
Inflammation placentaire |
Réf |
|
Mouton
|
|
|
|
|
|
|
|
| Brebis sur-nourries = Ob (150 % du contrôle C), de 60 jours avant accouplement à mi-gestation ou agnelage |
Brebis Ob poids > C, hyperglycémie, hyperinsulinémie, dyslipidémie |
Mi-gestation : fœtus Ob +20 % agnelage : Ob = C Placenta Ob = C |
|
↗ diamètre des artérioles des cotylédons à mi-gestation ↘ expression facteurs angiogéniques des artérioles des cotylédons en seconde partie de gestation |
↗ Expression placentaire des transporteurs d’acides gras à mi-gestation, corrélée à ↗ cholestérolémie et triglycéridémie fœtale |
Accumulation macrophages (mesurée par marqueurs) ↗ Expression cytokines pro-inflammatoires, activation des récepteurs TLR (stimulent voies pro-inflammatoires NFκB et JNK) |
[8, 17, 18, 23] |
| Brebis pubères sur-nourries (H, nourriture = C mais quantité ↗) du début de gestation à fin du 1er, 2e ou 3e tiers de gestation |
|
Fœtus H > C 2e et 3e tiers Placenta H < C 3e tiers |
|
Anomalies de développement vasculaire des cotylédons 1er et 2e tiers |
|
|
[15] |
|
|
Souris
|
|
|
|
|
|
|
|
| Femelles avec régime HF à partir de l’âge de 8 sem. Accouplement à 16 sem. Fœtus et placentas collectés à terme (E18.5) |
Mères HF poids = C, masse grasse HF > C, dyslipidémie, absence de diabète |
Fœtus HF > C Placenta HF = C |
|
|
↗ Transport du glucose et des acides aminés ↗ Expression protéines Glut-1 et Snat-2 Expression Glut-3 et Snat-4 : HF = C |
|
[45] |
| Femelles avec régime HF de E0 à E15.5 (milieu de la période fœtale) |
Mères HF poids = C |
Fœtus HF = C Placenta HF > C Efficacité placentaire HF < C |
Pas de modification apparente de la structure placentaire |
|
|
|
[46, 47] |
|
|
Rat
|
|
|
|
|
|
|
|
| Femelles avec régime HF à partir de l’âge de 3 sem. Accouplement à 19 sem. Fœtus et placentas collectés à E15 |
Mères HF poids et masse grasse > C, dyslipidémie, hyperglycémie et hyperleptinémie |
↘ Taille de portée Fœtus HF < C Efficacité placentaire HF < C |
|
↘ Densité vaisseaux, retard de maturation ↗ Hypoxie (marqueur : anhydrase carbonique) |
|
|
[16] |
|
|
Lapin
|
|
|
|
|
|
|
|
| Femelles avec régime HH à partir de l’âge de 10 sem. Saillie à 18 sem. Fœtus et placentas collectés 3j avant terme (E28) |
E28 : mères HH dyslipidémiques |
Fœtus HH < C Efficacité placentaire HH = C |
Accumulation de gouttelettes lipidiques dans le trophoblaste |
|
↗ Stockage de lipides, placentas HH femelles ↗ Transfert des lipides vers sang fœtal HH mâles |
|
[48] |
|
|
Primate non-humain
|
|
|
|
|
|
|
|
| Femelles macaques avec régime HF pendant 4 ans. Fœtus et placentas collectés à E130 (terme E170-180) |
Chez les femelles sensibles au régime HF : poids HF > C hyperinsulinémie, hyperleptinémie et hypertriglycéridémie |
Fœtus HF = C Placentas HF = C |
↗ Zones d’infarctus et de calcification au sein des villosités |
E120 : ↘ volume des flux sanguins utéro-placentaires HF versus C |
|
↗ Expression de TLR-4 ↗ Expression de MCP-1 et IL-1β |
[10] |
| Femelles babouins nourries ad libitum. Fœtus et placentas collectés à E165 (terme = E185) |
Obésité (Ob) basée sur l’index d’obésité (poids/longueur tête-croupe2) Mères Ob : hyperleptinémie |
Fœtus Ob = C mais IMC fœtal Ob > C Placenta Ob = C |
Volume des villosités placentaires Ob=C ↘ Épaisseur des villosités ↗ Nombre de macrophages |
|
Expression/localisation des transporteurs Snat 1,2,4 : Ob = C |
|
[49] |
Modèles animaux permettant d’étudier les effets de la surnutrition ou de l’obésité sur le développement et la fonction placentaire. C : groupe contrôle, Ob : groupe obèse, H : haute valeur énergétique, HF : groupe nourri avec un régime hyperlipidique, HH : groupe nourri avec un régime hyperlipidique-hypercholestérolémique. E15.5, E28, E120 etc. : jour embryonnaire 15,5/28/120 etc., Sem : semaine ; Snat : sodium-coupled neutral amino acid transporter ; TLR-4 : Toll-like receptor-4, dont les ligands sont des acides gras ; MCP-1 : monocyte chemoattractant protein 1 ; IL : interleukine ; NFκB : nuclear factor kappa B ; JNK : c-Jun NH2-terminal kinase ; Glut : glucose transporter. |
Obésité et biométrie fœto-placentaire L’obésité maternelle peut moduler le poids de l’unité fœto-placentaire à la naissance dans le sens d’une diminution ou d’une augmentation. Ainsi, l’étude de la cohorte écossaise AMND ( Aberdeen maternity and neonatal databank) montre que les poids du placenta et de l’enfant à la naissance sont corrélés à un index de masse corporelle (IMC) maternel élevé, alors que l’efficacité placentaire, mesurée par le ratio poids fœtal sur poids placentaire, diminue quand l’IMC augmente. L’obésité peut être aussi associée à de très petits poids de naissance, voire être sans effet (dans ce dernier cas, on observe une diminution de l’efficacité placentaire) [ 7]. Dans un modèle de brebis obèses, les fœtus produits par les animaux ont un poids corporel qui est augmenté à mi-gestation, alors que le poids du placenta n’est pas altéré [8]. L’ensemble de ces données montre que chez l’homme, comme dans les modèles animaux, le statut métabolique maternel, en cas d’obésité, peut induire des effets très variables sur la biométrie fœto-placentaire. Obésité et histologie placentaire Les placentas provenant de femmes obèses ont été examinés en histologie. Aucune anomalie histologique majeure n’a été observée, hormis une augmentation de la paroi musculaire des vaisseaux et des infiltrations de macrophages (voir ci-dessous le paragraphe « Obésité et vascularisation placentaire ») [ 9]. En revanche, chez des primates non-humains, dans un modèle d’obésité induite par un régime hypergras, les placentas présentent une augmentation des zones d’infarctus et de calcification au sein des villosités [ 10]. Dans un modèle d’obésité développé chez la souris, les placentas se caractérisent par une diminution de l’épaisseur de la zone labyrinthique qui participe aux échanges entre le sang maternel et fœtal [ 11]. L’obésité conduit donc à des altérations histologiques plus ou moins sévères qui peuvent affecter les échanges fœto-placentaires et donc la croissance fœtale. Obésité et vascularisation placentaire Il est bien établi qu’un index de masse corporelle élevé au moment de la grossesse est associé à une altération des marqueurs angiogéniques maternels circulants comme sFlt-1 (soluble fms-like tyrosine kinase-1) et PlGF (placental growth factor) [ 12, 13], reflétant l’existence de désordres de la fonction vasculaire qui touchent à la fois l’endothélium et les cellules musculaires lisses. Ces désordres contribueraient à l’apparition d’une pré-éclampsie, pathologie spécifique de l’espèce humaine caractérisée par un défaut d’invasion et de remodelage des artères spiralées utérines. Des anomalies suggérant des altérations de la vascularisation placentaire touchant l’expression de facteurs proangiogéniques comme le VEGF ( vascular endothelial growth factor) et de ses récepteurs ont d’ailleurs été observées dans les placentas de femmes obèses [ 14]. Des perturbations du développement vasculaire placentaire [15] mais aussi des réductions des flux sanguins utérins [10] ont été décrites dans des modèles animaux d’obésité au cours de la gestation (Tableau I). Ainsi, chez des brebis obèses [10, 15], les placentomes, qui constituent les unités placentaires, présentent une augmentation du diamètre des artérioles en début et à mi-gestation avec une diminution de l’expression de facteurs angiogéniques dans la seconde moitié de la gestation, limitant ainsi le développement vasculaire placentaire et donc le transfert des nutriments. L’obésité maternelle perturbe donc le développement de l’architecture placentaire, pouvant compromettre la croissance et la survie fœtales [16, 17]. Obésité et transferts placentaires Comme chez les brebis obèses, chez les femmes obèses, le transport et le métabolisme des lipides placentaires sont altérés [ 7, 18]. L’obésité maternelle entraîne une réduction du transport de l’acide oléique dans les placentas des fœtus de sexe masculin qui est reliée à une diminution d’expression du transporteur CD36 ( fatty acid translocase) et de la protéine intracellulaire de liaison des acides gras FABP5 ( fatty acid binding protein) ; le transport d’acide oléique est en revanche augmenté chez les fœtus de sexe féminin [ 19]. L’augmentation des transferts lipidiques vers le foetus femelle favoriserait le développement du tissu adipeux fœtal et donc le risque d’obésité chez la descendance. Dans les placentas de femmes obèses ne présentant pas de diabète gestationnel mais dont le nouveau-né est en surpoids, les voies insuline/IGF-1 (insulin growth factor) et mTOR (mammalian target of rapamycin), qui régulent positivement le transport des acides aminés, sont activées [20]. Dans une autre étude, il est montré que l’un des transporteurs d’acides aminés, SNAT-4 (sodium-coupled neutral amino acid transporter 4), a une activité diminuée. L’obésité module donc le transfert des acides aminés au niveau du placenta et par conséquent influe sur la croissance fœtale [21]. Obésité et inflammation L’index de masse corporelle maternel est corrélé positivement à l’inflammation systémique comme le montrent les taux élevés de MCP-1 ( monocyte chemo-attractant protein-1), de TNF-α, mais aussi d’IL-6 produits par le tissu adipeux [ 22]. L’inflammation peut également être locale. Ainsi, dans les placentas de femmes obèses et ceux provenant de femelles babouins obèses, les macrophages s’accumulent dans le stroma des villosités placentaires [ 22]. Cette accumulation est associée à une augmentation de cytokines pro-inflammatoires [ 10, 22, 23]. Une activation des récepteurs TLR-4 ( Toll-like receptor-4), dont les ligands sont en particulier les acides gras, qui stimulent les voies de signalisation pro-inflammatoires NFκB ( nuclear factor κ -light chain-enhancer of activated B cells) et JNK ( c-Jun N-terminal kinases), a été mise en évidence dans les placentas de brebis obèses [ 10, 22, 23]. D’autres voies de l’inflammation comme celles impliquant p38-MAPK ( mitogen-activated protein kinases) et STAT-3 ( signal transducer and activator of transcription 3), sont également activées. Dans le modèle de souris obèses, l’inflammation placentaire et l’activation des macrophages [ 11] sont plus importantes chez les fœtus mâles que chez les fœtus femelles [ 11]. Les cytokines pro-inflammatoires (IL-6 et TNF-α) stimulent l’activité du système A des transporteurs des acides aminés (transporteurs des acides aminés neutres comme l’alanine, la sérine et la glutamine) dans les cellules trophoblastiques humaines en culture [24]. De plus, l’IL-6 induit l’accumulation des acides gras dans le trophoblaste. L’inflammation placentaire contribuerait ainsi à l’excès de transfert des nutriments depuis le sang maternel vers le sang fœtal et donc à la macrosomie, facteur de risque connu de maladies métaboliques chez la descendance. |
Effets du diabète maternel sur la fonction placentaire Plusieurs types de diabètes peuvent toucher la mère : les diabètes de type 1 (DT1) ou 2 (DT2), qui sont indépendants de la grossesse, et le diabète gestationnel (GDM). Le DT1 apparaît très précocement. Il résulte d’un processus auto-immun qui conduit à la destruction des cellules bêta du pancréas. Il en résulte une absence totale d’insuline endogène, ce qui explique la fréquence des épisodes alternatifs d’hyperglycémie ou d’hypoglycémie et le recours à une insulinothérapie. Le DT2 est associé à un surpoids et à un manque d’activité physique. Il apparaît plus tardivement dans la vie. Il est le résultat d’une augmentation de la résistance périphérique à l’insuline. Les patients sont, dans ce cas, pris en charge sur le plan nutritionnel. Ils peuvent également recevoir des agents hypoglycémiants administrés par voie orale en dehors de la grossesse et, parfois, une insulinothérapie. Au cours de la grossesse diabétique, seule l’insulinothérapie est à ce jour utilisée. Des études ont montré que, malgré un contrôle adapté de la glycémie, le risque de complications fœtales au cours de la grossesse (malformations congénitales et mortalité périnatale) est légèrement augmenté chez les patientes présentant un DT2 par rapport aux patientes ayant un DT1 [25]. Le diabète gestationnel est, quant à lui, associé à une insulinorésistance, une hyperglycémie et une hyperinsulinémie. Les taux de leptine et de cytokines pro-inflammatoires comme le TNF-α, l’IL-6 et l’IL-1β sont également augmentés. Ces cytokines participent à la physiopathologie de cette maladie de même que le stress oxydatif qui, par son rôle d’inducteur de l’apoptose des cellules bêta, affecte la production d’insuline. Des complications périnatales, en particulier une macrosomie fœtale, augmentent les risques obstétricaux liés à cette pathologie [26]. De plus, la présence d’un diabète gestationnel accroît le risque pour la descendance de développer des maladies cardiovasculaires et métaboliques ainsi que des dysfonctionnements cognitifs [27] (→).
(→) Voir la Synthèse de M. Rincel et al., page 93 de ce numéro
Les principales fonctions placentaires affectées par le diabète sont la vascularisation – liée à l’hypoxie – et le transfert des nutriments, en particulier le glucose, les acides aminés et les lipides. Modifications structurales du placenta Une étude rétrospective a montré l’absence de différence de poids entre des placentas provenant de mères présentant un DT1 et celles ayant un DT2. En revanche, chez 13 % des mères ayant un DT2, mais 5 % des mères présentant un DT1, il existe une insuffisance placentaire. Des anomalies villositaires sont également plus fréquentes chez les premières [ 25], de même que des anomalies de remaniement des artères spiralées, une nécrose fibrinoïde ou une thrombose en lien avec une augmentation de la circulation utéroplacentaire. Chez 17 % des patientes atteintes de diabète (DT1 et DT2), les placentas présentent des zones d’infarctus. Une augmentation du nombre de capillaires des villosités choriales (ou chorangiose) et de l’immaturité des villosités terminales a été rapportée [ 28]. Une synthèse des données histologiques répertoriées pour les placentas provenant de patientes DT1, DT2 et GDM (diabète gestationnel) a été réalisée récemment. Elle montre qu’il existe une grande variabilité des anomalies placentaires liées au diabète pré-gestationnel [ 29]. Néanmoins, les auteurs confirment l’immaturité villositaire et constatent une augmentation du volume et de la surface du mésenchyme. Les anomalies placentaires liées au diabète gestationnel varient considérablement. Un poids placentaire élevé est l’anomalie la plus fréquente, avec 22 % d’augmentation par rapport au poids des placentas contrôles. Le diamètre de ces placentas est également supérieur de 33 % et son épaisseur de 85 % par rapport aux placentas contrôles [30]. D’autres études rapportent une augmentation significative des lésions vasculaires de nécrose fibrinoïde, de chorangiose et d’ischémie dans le placenta des femmes atteintes de diabète gestationnel comparé au placenta de femmes normoglycémiques. Il existe des différences placentaires chez les femmes atteintes d’un diabète pré-gestationnel et celles qui développent un diabète gestationnel, notamment en termes d’épaisseur trophoblastique et de sévérité des anomalies placentaires. Mais, dans tous les cas, l’angiogenèse – processus de formation de nouveaux vaisseaux à partir de ceux préexistants – est augmentée. Angiogenèse et flux placentaires L’angiogenèse placentaire est régulée par de nombreux facteurs angiogéniques comme le VEGF ( vascular endothelial growth factor), le FGF-2 ( fibroblast growth factor [Basic]), le récepteur nucléaire PPAR-γ ( peroxisome proliferator activated receptors) et des facteurs de croissance placentaires [ 31]. L’hyperglycémie affecte également la voie de signalisation de la PKC (protéine kinase C) qui active la production de facteurs de croissance comme le VEGF. Elle a une action positive sur le tonus vasculaire, l’hémostase (pro-thrombotique), l’inflammation et l’angiogenèse. Elle a un effet négatif sur la perméabilité vasculaire. L’hyperglycémie maternelle pourrait donc avoir un impact sur la perméabilité vasculaire du placenta [ 32]. En effet, dans le diabète pré-gestationnel, le VEGF est détecté dans l’endothélium des larges vaisseaux [ 33]. Dans les placentas de patientes présentant un DT1, l’expression élevée des transcrits FGF-2 et FGFR1 ( fibroblast growth factor receptor 1) contribue également à l’angiogenèse placentaire [ 34]. Dans les placentas issus de femmes atteintes de diabète gestationnel, une corrélation élevée entre les concentrations circulantes de VEGF et l’immaturité des villosités placentaires a pu être observée. Les transcrits de FGF-2 augmentent, alors que ceux du récepteur FGF-2R sont diminués. Les taux de transcrits et de protéines correspondants à PPAR-γ sont diminués dans ces placentas. Ces modifications, associées à une réduction des cellules circulantes progénitrices hématopoïétiques dans le sang de cordon des femmes présentant un diabète gestationnel, contribueraient aux anomalies de la vascularisation observées dans les placentas de ces patientes, comme la ramification et la croissance longitudinale des capillaires [31]. L’impact du diabète pré-gestationnel sur le développement vasculaire au premier trimestre de grossesse, a été évalué via des mesures échographiques en Doppler 3D. Elles démontrent que les indices de vascularisation, de flux sanguins et de perfusion sont significativement diminués par rapport aux valeurs des placentas contrôles [35]. La diminution de l’indice de flux résulterait de l’augmentation du nombre de vaisseaux fœtaux [36]. Dans le cas du diabète gestationnel, des anomalies des flux utérins artériels ont été observées dans 16 % des grossesses [31]. Bien que les paramètres hémodynamiques soient le plus souvent normaux, l’oxygénation fœtale est perturbée. L’oxygénation fœtale ne dépend pas uniquement du développement des vaisseaux des villosités, mais également des flux utéro-placentaires. La saturation en oxygène et le contenu en oxygène sont significativement diminués dans la veine ombilicale, ce qui conduit à une hypoxie fœtale. Cette hypoxie résulterait d’un défaut de transfert de l’oxygène depuis le sang maternel vers le sang fœtal en raison du taux maternel élevé d’hémoglobine A1c glyquée2 qui a une plus forte affinité pour l’oxygène. Une synthèse accrue de collagène dans le mésenchyme placentaire ainsi que des modifications de la membrane basale du syncytiotrophoblaste, contribueraient également à cette hypoxie dans le diabète gestationnel. Dans les placentas de ces patientes, l’augmentation de la taille associée à celle de la surface pourrait être une manière de contrebalancer l’hypoxie fœtale. Diabète et transfert des nutriments Que ce soit dans le cadre du diabète pré-gestationnel ou du diabète gestationnel, l’altération de l’activité et de l’expression des transporteurs placentaires des nutriments représente un point critique au cours de la grossesse. Dans le cas du glucose, sa production par le fœtus étant minime, ce dernier dépend entièrement des apports maternels. Le transfert transplacentaire du glucose fait intervenir un processus de transport facilité qui implique plusieurs transporteurs de la famille des GLUT (glucose transporter), localisés sur les membranes apicale et basale du syncytiotrophoblaste. Dans les placentas provenant de patientes diabétiques insulino-dépendantes, GLUT-1 est surexprimé. La capacité de transfert du glucose est ainsi augmentée au niveau de la membrane basale du trophoblaste [37], expliquant l’hyperglycémie fœtale que l’on observe. Pour les patientes atteintes de diabète gestationnel, les études sont contradictoires : certaines rapportent une augmentation de l’activité et de l’expression de GLUT-1 au niveau de la membrane basale du trophoblaste [38] ; d’autres n’observent pas de modification d’expression des transporteurs au niveau des microvillosités et de la membrane basale [39]. Ces différences pourraient résulter des critères cliniques d’inclusion des patientes présentant un diabète gestationnel (GDM). Les acides aminés jouent un rôle important dans la croissance fœtale. Chez les patientes présentant un DT1 et un diabète gestationnel, l’activité du système A (transporteurs des acides aminés neutres) est augmentée de 65-80 % au niveau des microvillosités placentaires et ceci indépendamment de la croissance fœtale. Le transport de la leucine, mais pas celui de la lysine et de la taurine, est augmenté au niveau des microvillosités dans les placentas provenant des patientes présentant un diabète gestationnel lorsqu’il existe un surpoids fœtal. Ces données suggèrent une augmentation de l’import placentaire des acides aminés neutres qui peuvent être métabolisés par le placenta ou délivrés au fœtus [40]. Le diabète maternel est associé à des altérations de la synthèse et du transport des lipides à travers le placenta qui conduisent à une dyslipidémie fœtale [41], bien que triglycérides et phospholipides s’accumulent dans l’unité placentaire. En effet, l’expression génique de la lipase endothéliale, localisée sur la membrane plasmique trophoblastique et impliquée dans l’hydrolyse des triglycérides des lipoprotéines, est augmentée dans les placentas des patientes présentant un DT1 [42]. Les transcrits codant les isoformes FABP (fatty acid binding protein) 4 et FABP5, protéines de liaison des acides gras, sont également surexprimés dans les placentas des patientes ayant un DT2 et un diabète gestationnel [43]. Dans ces derniers, le transfert placentaire des acides gras polyinsaturés à longues chaînes est perturbé [26]. Une surexpression des transporteurs des acides gras placentaires (FABP1, FABP3, FABP4 et ACSL [acyl-CoA synthethase long chain] 2, ACSL3 et ACSL4) a également été montrée dans le diabète GDM, ce qui pourrait expliquer l’accumulation des acides gras polyinsaturés à longues chaînes dans ce tissu. Des concentrations faibles en acide arachidonique (20:4n-6)3, et en acide docosahexaénoïque (22:6n-3) ont été observées dans les placentas ainsi que dans le sang de cordon, provenant des patientes ayant un diabète gestationnel, par rapport à des placentas normaux. Étant donné le rôle crucial de ces composés dans le développement visuel et cognitif, ces résultats pourraient constituer une explication possible à la mauvaise programmation fœtale du développement neurologique associée au diabète [31]. |
Le placenta n’est pas un participant passif à la gestation. Il s’adapte à l’environnement maternel notamment en cas d’obésité et/ou de diabète maternel en modifiant sa structure et sa fonction. Ceci conduit à des modifications de disponibilités de substrats pour le fœtus et à des modifications de l’environnement hormonal. Ces adaptations placentaires permettent d’optimiser la survie fœtale. Néanmoins, elles peuvent s’accompagner d’une macrosomie fœtale ou d’un retard de croissance (RCIU). Le placenta est donc un acteur incontournable de la programmation fœtale (→).
(→) Voir la Synthèse de P. Chavatte-Palmer et al., page 57de ce numéro
En fin de gestation, le phénotype placentaire est la résultante de tous les évènements rencontrés in utero. La mise en évidence de signatures placentaires spécifiques, notamment au moyen de marques épigénétiques [44] (→), mémoire des événements produits in utero, pourrait aboutir à l’identification de marqueurs prédictifs des risques pathologiques encourus à long terme par la descendance. Cette meilleure connaissance des mécanismes physiopathologiques devrait nous permettre d’envisager des stratégies de corrections, et ceci dès le début de la vie post-natale, une période où la plasticité des tissus permet encore d’espérer des résultats.
(→) Voir la Synthèse de C. Junien et al., page 35 de ce numéro
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Le Bouteiller P, Tabiasco J. Immunologie de la grossesse : faits nouveaux . Med Sci (Paris). 2006; ; 22 : :745.–750. 2.
Tarrade A, Chavatte-Palmer P, Guillomot M, et al. Le placenta . In: La reproduction animale et humaine . Paris: : Éditions Quae; , 2014 : :367.–407. 3.
Challier JC, Uzan S. Le placenta humain et ses pathologies : l’oxygène en question . Med Sci (Paris). 2003; ; 19 : :1111.–1120. 4.
Chavatte-Palmer P, Tarrade A. Programmation foetale . In: La reproduction animale et humaine . Paris: : Éditions Quae; , 2014 : :409.–424. 5.
Ramsay JE, Ferrell WR, Crawford L, et al. Maternal obesity is associated with dysregulation of metabolic, vascular, and inflammatory pathways . J Clin Endocrinol Metab. 2002; ; 87 : :4231.–4237. 6.
Boney CM, Verma A, Tucker R, Vohr BR. Metabolic syndrome in childhood: association with birth weight, maternal obesity, and gestational diabetes mellitus . Pediatrics. 2005; ; 115 : :e290.–e296. 7.
Dube E, Gravel A, Martin C, et al. Modulation of fatty acid transport and metabolism by maternal obesity in the human full-term placenta . Biol Reprod. 2012; ; 87 (14) : :1.–11. 8.
Zhu MJ, Du M, Nijland MJ, et al. Down-regulation of growth signaling pathways linked to a reduced cotyledonary vascularity in placentomes of over-nourished, obese pregnant ewes . Placenta. 2009; ; 30 : :405.–410. 9.
Roberts KA, Riley SC, Reynolds RM, et al. Placental structure and inflammation in pregnancies associated with obesity . Placenta. 2011; ; 32 : :247.–254. 10.
Frias AE, Morgan TK, Evans AE, et al. Maternal high-fat diet disturbs uteroplacental hemodynamics and increases the frequency of stillbirth in a nonhuman primate model of excess nutrition . Endocrinology. 2011; ; 152 : :2456.–2464. 11.
Kim DW, Young SL, Grattan DR, Jasoni CL. Obesity during pregnancy disrupts placental morphology, cell proliferation, and inflammation in a sex-specific manner across gestation in the mouse . Biol Reprod. 2014; ; 90 : :130.. 12.
Pereira RD, De Long NE, Wang RC, et al. Angiogenesis in the placenta: the role of reactive oxygen species signaling . Biomed Res Int. 2015; ; 2015 : :814543.. 13.
Zera CA, Seely EW, Wilkins-Haug LE, et al. The association of body mass index with serum angiogenic markers in normal and abnormal pregnancies . Am J Obstet Gynecol. 2014; ; 211 (247) : :e1.–e7. 14.
Burton GJ, Charnock-Jones DS, Jauniaux E. Regulation of vascular growth and function in the human placenta . Reproduction. 2009; ; 138 : :895.–902. 15.
Redmer DA, Luther JS, Milne JS, et al. Fetoplacental growth and vascular development in overnourished adolescent sheep at day 50, 90 and 130 of gestation . Reproduction. 2009; ; 137 : :749.–757. 16.
Hayes EK, Lechowicz A, Petrik JJ, et al. Adverse fetal and neonatal outcomes associated with a life-long high fat diet: role of altered development of the placental vasculature . PLoS One. 2012; ; 7 : :e33370.. 17.
Ma Y, Zhu MJ, Zhang L, et al. Maternal obesity and overnutrition alter fetal growth rate and cotyledonary vascularity and angiogenic factor expression in the ewe . Am J Physiol Regul Integr Comp Physiol. 2010; ; 299 : :R249.–R258. 18.
Zhu MJ, Ma Y, Long NM, et al. Maternal obesity markedly increases placental fatty acid transporter expression and fetal blood triglycerides at midgestation in the ewe . Am J Physiol Regul Integr Comp Physiol. 2010; ; 299 : :R1224.–R1231. 19.
Brass E, Hanson E, O’Tierney-Ginn PF. Placental oleic acid uptake is lower in male offspring of obese women . Placenta. 2013; ; 34 : :503.–509. 20.
Jansson N, Rosario FJ, Gaccioli F, et al. Activation of placental mTOR signaling and amino acid transporters in obese women giving birth to large babies . J Clin Endocrinol Metab. 2013; ; 98 : :105.–113. 21.
Brett KE, Ferraro ZM, Yockell-Lelievre J, et al. Maternal-fetal nutrient transport in pregnancy pathologies: the role of the placenta . Int J Mol Sc. 2014; ; 15 : :16153.–16185. 22.
Challier JC, Basu S, Bintein T, et al. Obesity in pregnancy stimulates macrophage accumulation and inflammation in the placenta . Placenta. 2008; ; 29 : :274.–281. 23.
Zhu MJ, Du M, Nathanielsz PW, Ford SP. Maternal obesity up-regulates inflammatory signaling pathways and enhances cytokine expression in the mid-gestation sheep placenta . Placenta. 2010; ; 31 : :387.–391. 24.
Jones HN, Jansson T, Powell TL. IL-6 stimulates system A amino acid transporter activity in trophoblast cells through STAT3 and increased expression of SNAT2 . Am J Physiol Cell Physiol. 2009; ; 297 : :C1228.–C1235. 25.
Starikov R, Inman K, Chen K, et al. Comparison of placental findings in type 1 and type 2 diabetic pregnancies . Placenta. 2014; ; 35 : :1001.–1006. 26.
Araujo JR, Keating E, Martel F. Impact of gestational diabetes mellitus in the maternal-to-fetal transport of nutrients . Curr Diab Rep. 2015; ; 15 : :569.. 27.
Fraser A, Lawlor DA. Long-term health outcomes in offspring born to women with diabetes in pregnancy . Curr Diab Rep. 2014; ; 14 : :489.. 28.
Desoye G, Shafrir E. Placental metabolism and its regulation in health and diabetes . Mol Aspects Med. 1994; ; 15 : :505.–682. 29.
Huynh J, Dawson D, Roberts D, Bentley-Lewis R. A systematic review of placental pathology in maternal diabetes mellitus . Placenta. 2015; ; 36 : :101.–114. 30.
Ashfaq M, Janjua MZ, Channa MA. Effect of gestational diabetes and maternal hypertension on gross morphology of placenta . J Ayub Med Coll Abbottabad. 2005; ; 17 : :44.–47. 31.
Gauster M, Desoye G, Totsch M, Hiden U. The placenta and gestational diabetes mellitus . Curr Diab Rep. 2012; ; 12 : :16.–23. 32.
Leach L, Taylor A, Sciota F. Vascular dysfunction in the diabetic placenta: causes and consequences . J Anat. 2009; ; 215 : :69.–76. 33.
Pietro L, Daher S, Rudge MV, et al. Vascular endothelial growth factor (VEGF) and VEGF-receptor expression in placenta of hyperglycemic pregnant women . Placenta. 2010; ; 31 : :770.–780. 34.
Arany E, Hill DJ. Fibroblast growth factor-2 and fibroblast growth factor receptor-1 mRNA expression and peptide localization in placentae from normal and diabetic pregnancies . Placenta. 1998; ; 19 : :133.–142. 35.
Gonzalez Gonzalez NL, Gonzalez Davila E, Castro A, et al. Effect of pregestational diabetes mellitus on first trimester placental characteristics: three-dimensional placental volume and power Doppler indices . Placenta. 2014; ; 35 : :147.–151. 36.
Moran M, Mulcahy C, Daly L, et al. Novel placental ultrasound assessment: potential role in pre-gestational diabetic pregnancy . Placenta. 2014; ; 35 : :639.–644. 37.
Jansson T, Wennergren M, Powell TL. Placental glucose transport and GLUT 1 expression in insulin-dependent diabetes . Am J Obstet Gynecol. 1999; ; 180 : :163.–168. 38.
Gaither K, Quraishi AN, Illsley NP. Diabetes alters the expression and activity of the human placental GLUT1 glucose transporter . J Clin Endocrinol Metab. 1999; ; 84 : :695.–701. 39.
Jansson T, Ekstrand Y, Wennergren M, Powell TL. Placental glucose transport in gestational diabetes mellitus . Am J Obstet Gynecol. 2001; ; 184 : :111.–116. 40.
Jansson T, Ekstrand Y, Bjorn C, et al. Alterations in the activity of placental amino acid transporters in pregnancies complicated by diabetes . Diabetes. 2002; ; 51 : :2214.–2219. 41.
Herrera E, Ortega-Senovilla H. Disturbances in lipid metabolism in diabetic pregnancy – Are these the cause of the problem? Best Pract Res Clin Endocrinol Metab. 2010; ; 24 : :515.–525. 42.
Lindegaard ML, Damm P, Mathiesen ER, Nielsen LB. Placental triglyceride accumulation in maternal type 1 diabetes is associated with increased lipase gene expression . J Lipid Res. 2006; ; 47 : :2581.–2588. 43.
Scifres CM, Chen B, Nelson DM, Sadovsky Y. Fatty acid binding protein 4 regulates intracellular lipid accumulation in human trophoblasts . J Clin Endocrinol Metab. 2011; ; 96 : :E1083.–E1091. 44.
Tarrade A, Panchenko P, Junien C, Gabory A. Placental contribution to nutritional programming of health and diseases: epigenetics and sexual dimorphism . J Exp Biol. 2015; ; 218 : :50.–58. 45.
Jones HN, Woollett LA, Barbour N, et al. High-fat diet before and during pregnancy causes marked up-regulation of placental nutrient transport and fetal overgrowth in C57/BL6 mice . FASEB J. 2009; ; 23 : :271.–278. 46.
Gallou-Kabani C, Gabory A, Tost J, et al. Sex- and diet-specific changes of imprinted gene expression and DNA methylation in mouse placenta under a high-fat diet . PLoS One. 2010; ; 5 : :e14398.. 47.
Gabory A, Ferry L, Fajardy I, et al. Maternal diets trigger sex-specific divergent trajectories of gene expression and epigenetic systems in mouse placenta . PLoS One. 2012; ; 7 : :e47986.. 48.
Tarrade A, Rousseau-Ralliard D, Aubriere MC, et al. Sexual dimorphism of the feto-placental phenotype in response to a high fat and control maternal diets in a rabbit model . PLoS One. 2013; ; 8 : :e83458.. 49.
Farley D, Tejero ME, Comuzzie AG, et al. Feto-placental adaptations to maternal obesity in the baboon . Placenta. 2009; ; 30 : :752.–760. |