| |
| Med Sci (Paris). 2016 February; 32(2): 149–152. Published online 2016 March 2. doi: 10.1051/medsci/20163202005.SPINK1, macrophages et cellules progénitrices du foie De nouvelles pistes pour stimuler la régénération dans l’hépatite alcoolique ? Nicolas Lanthier1,2,3* and Laurent Spahr1 1Gastroenterology and hepatology, university hospitals of Geneva, Geneva, Suisse 2Service d’hépato-gastroentérologie, cliniques universitaires Saint-Luc, université catholique de Louvain, Brussels, Belgique 3Laboratory of hepatogastroenterology, institut de recherche expérimentale et clinique, université catholique de Louvain, Brussels, Belgique MeSH keywords: Protéines de transport, Hépatite alcoolique, Humains, Cellules de Küpffer, Foie, Régénération hépatique, Macrophages, Cellules souches, Inhibiteur de la trypsine pancréatique Kazal, physiologie, génétique, métabolisme, physiopathologie, thérapie, anatomopathologie, cytologie |
La consommation excessive d’alcool peut entraîner d’importantes lésions du foie, potentiellement mortelles. Parmi les atteintes hépatiques possibles, la plus sévère est l’hépatite alcoolique. Dans une étude récente [1], nous avons analysé les paramètres des patients à leur admission à l’hôpital pour hépatite alcoolique. À partir de la biopsie du foie, effectuée avant toute intervention thérapeutique, nous avons pu mettre en évidence des facteurs de bon pronostic. Ces données ouvrent de nouvelles possibilités de recherche et de traitement pour une maladie sévère aux possibilités thérapeutiques actuellement limitées. |
La maladie alcoolique du foie La maladie alcoolique du foie regroupe un ensemble d’atteintes hépatiques causées par une consommation à risque d’alcool. Ces atteintes vont d’une surcharge en graisse au niveau du foie, appelée stéatose, à une maladie plus sévère, caractérisée par une inflammation et une fibrose progressive du parenchyme hépatique pouvant évoluer vers une cirrhose. La cirrhose peut elle-même être compliquée par un cancer primitif du foie (hépatocarcinome), un défaut de fonctionnement du foie (par exemple production insuffisante de protéines ou de facteurs de la coagulation) ou induire une pression élevée au niveau des vaisseaux en amont du foie (hypertension portale), pouvant notamment causer d’importants saignements suite à une rupture de varices dans le tube digestif. L’hépatite alcoolique constitue une autre atteinte inflammatoire très sévère, survenant le plus souvent dans un contexte de cirrhose sous-jacente. Elle est diagnostiquée cliniquement et biologiquement par un ictère (jaunisse) associé à un mauvais fonctionnement du foie (développement d’ascite1,, d’encéphalopathie ou d’une coagulation perturbée). Une biopsie du foie révèle, dans la majorité des cas, une stéatohépatite alcoolique caractérisée histologiquement par une stéatose, une souffrance2 des cellules du parenchyme du foie (les hépatocytes) et des neutrophiles en amas (satellitose). Les possibilités thérapeutiques dans cette situation sévère sont limitées. Malgré l’arrêt de la consommation d’alcool et un support nutritionnel adéquat, le pronostic est sombre avec plus de 50 % de mortalité à 6 mois. Un traitement par corticoïdes peut être indiqué mais son bénéfice est limité [2]. |
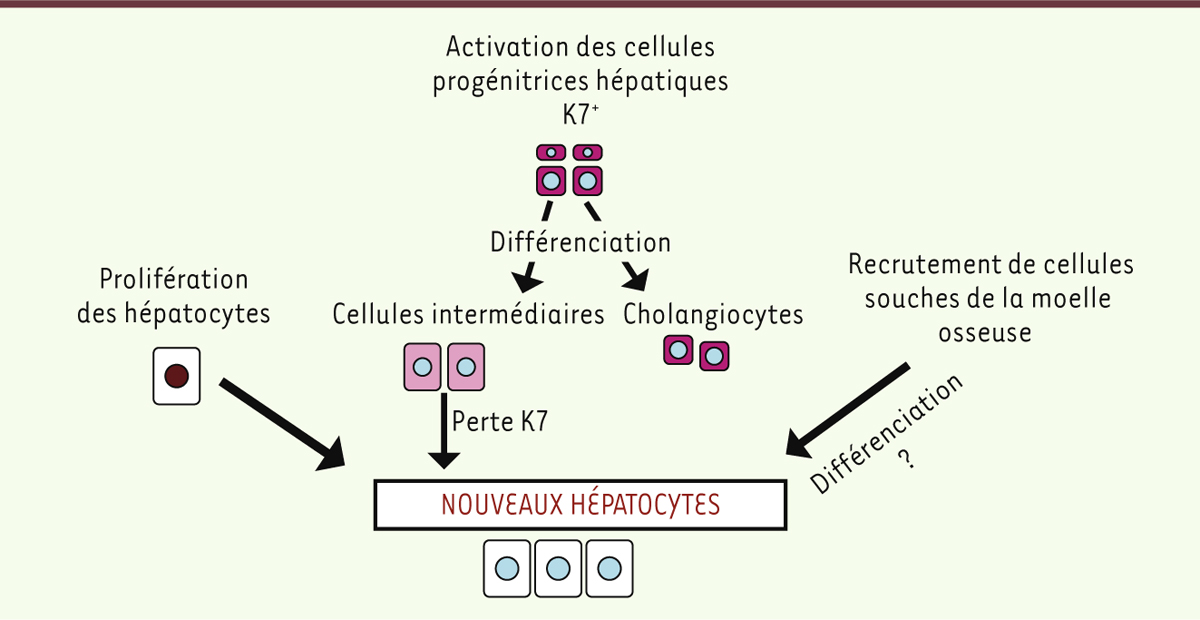
Mécanismes de régénération du foie En conditions normales, un renouvellement faible physiologique des hépatocytes, capables de réplication, est observé, permettant de maintenir les différentes fonctions de l’organe (Figure 1) [11, 12] (→). Cette prolifération hépatocytaire est également majoritairement responsable de la croissance du foie et de la récupération de son volume initial en cas de résection hépatique, même large, chez un sujet ne présentant pas de maladie sous-jacente (par exemple en cas de don vivant d’une partie de l’organe ou de résection localisée d’une tumeur) [3]. En cas de souffrance hépatocytaire et d’incapacité de prolifération, d’autres cellules peuvent également donner naissance à des hépatocytes, comme les cellules souches de la moelle osseuse capables d’infiltrer le foie et de se différencier (Figure 1). L’ampleur de ce processus est toutefois peu connu et une étude chez l’être humain, visant à injecter des cellules souches de la moelle dans le foie en cas d’hépatite alcoolique, n’a pas montré de bénéfice [4].
(→) Voir la Nouvelle de H. Gilgenkrantz, m/s n° 4, avril 2015, page 357 et la Synthèse de F. Lemaigre, m/s n° 11, novembre 2012, page 958
 | Figure 1.
Les mécanismes de régénération hépatique. Trois types de mécanismes sont possibles : la prolifération des hépatocytes existants, l’activation et la différenciation des cellules progénitrices K7+ au sein du foie ainsi que le recrutement et la différenciation de cellules de la moelle osseuse. |
Au sein du foie, il existe également des cellules progénitrices hépatiques, situées dans une niche à proximité des canaux biliaires et exprimant un marqueur de surface appelé kératine 7 (K7). Ces cellules progénitrices sont capables de proliférer et de se différencier pour donner naissance à des cholangiocytes3, ou à des hépatocytes, perdant alors leur marqueur de surface kératine 7 (Figure 1). Ce processus d’activation des cellules progénitrices est classiquement décrit comme particulièrement stimulé en cas d’incapacité de prolifération des hépatocytes eux-mêmes ou d’atteinte destructrice très sévère du foie [3]. Des études chez l’animal ont permis d’évaluer la capacité des cellules progénitrices à donner naissance in vivo à des hépatocytes [5] et ont mis en évidence l’importance de la présence des macrophages du foie, appelés cellules de Kupffer, favorisant la différenciation des cellules progénitrices plutôt en hépatocytes qu’en cholangiocytes [6]. Chez l’être humain, de telles données in vivo ne sont pas disponibles et le rôle des cellules progénitrices restait hypothétique, leur présence et expansion4, étant uniquement décrites jusqu’à présent comme liées à la gravité de la maladie hépatique, sans preuve connue de fonction ou de différentiation éventuelles [3]. |
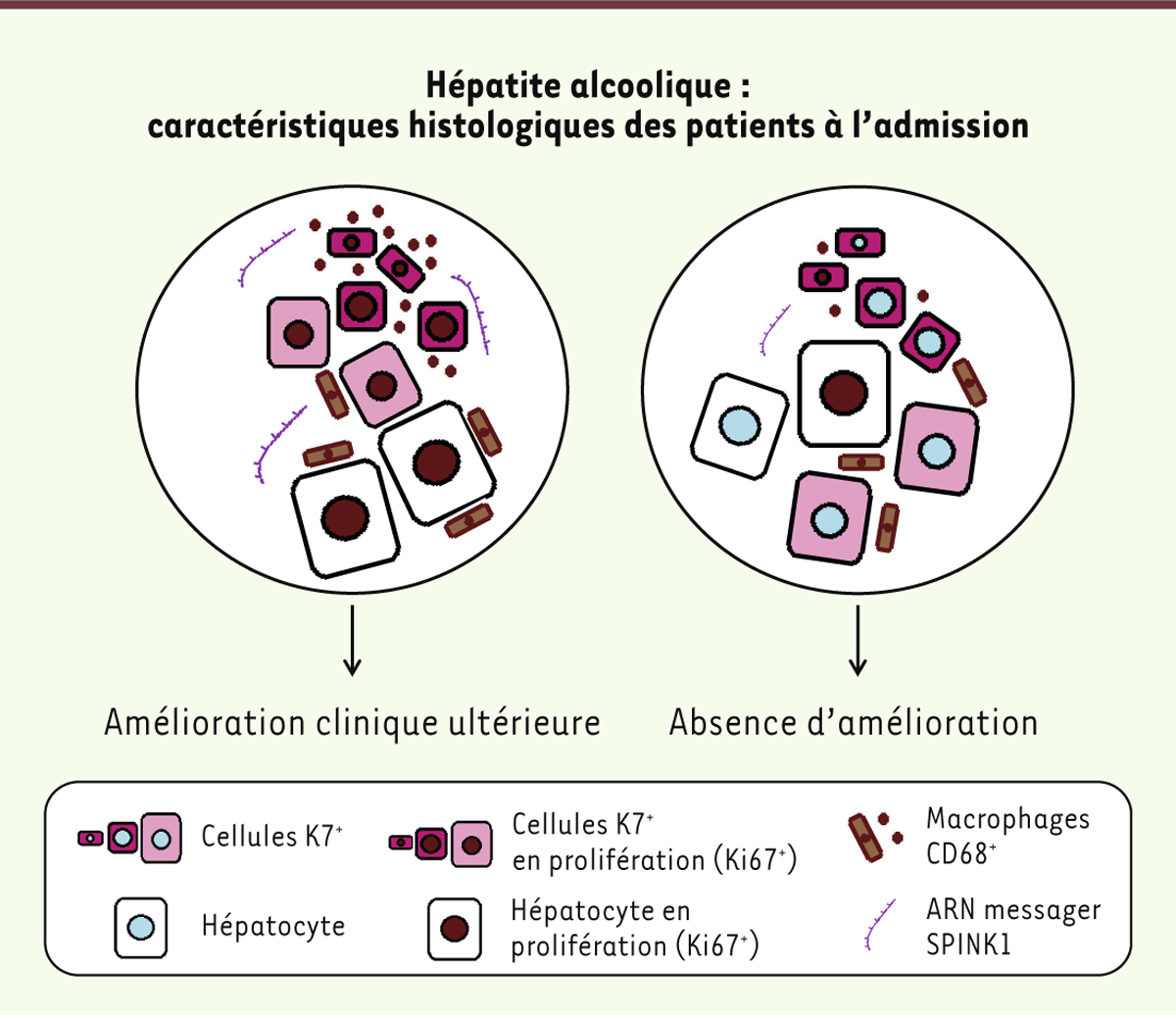
L’hépatite alcoolique : une situation clinique et histologique particulière Notre objectif était de déterminer le rôle de ces cellules progénitrices et leur éventuelle interaction avec les cellules de Kupffer chez l’être humain. Dans un premier temps, nous avons comparé des patients présentant une maladie alcoolique du foie au stade de cirrhose, sans hépatite alcoolique surajoutée, avec des patients présentant une cirrhose compliquée d’une hépatite alcoolique. Ces derniers, comme mentionné précédemment, présentent une altération de la fonction hépatique, caractérisée cliniquement et sur la base de tests de laboratoire, associée à des lésions caractéristiques de la stéatohépatite alcoolique, observées histologiquement sur un échantillon de foie obtenu par biopsie. Sur ce même fragment biopsique, nous avons analysé l’expansion des cellules de Kupffer (macrophages exprimant le marqueur CD68), des cellules progénitrices (exprimant la cytokératine 7), ainsi que leur prolifération et celle des hépatocytes (par l’analyse de l’expression d’un marqueur de prolifération, l’antigène Ki67). Par rapport aux patients atteints d’une cirrhose sans hépatite alcoolique, les patients admis pour une hépatite alcoolique compliquant une cirrhose présentent un nombre plus élevé de macrophages et de cellules progénitrices, mais également d’hépatocytes et de cellules progénitrices en prolifération (Figure 2) [1]. Même si ces caractéristiques sont liées à un état clinique plus sévère, ces données ne suffisaient cependant pas à conclure à leur rôle délétère.
 | Figure 2.
Les nouveaux facteurs de bon pronostic identifiés dans l’hépatite alcoolique. Un haut taux d’hépatocytes et de cellules progénitrices K7+ en prolifération est associé à un pronostic favorable (alors que le nombre total de cellules K7+ est identique dans les deux groupes). Une inflammation plus marquée (avec présence d’un grand nombre de macrophages et expression importante de SPINK1) peut jouer un rôle dans cette prolifération et dans la différenciation des cellules progénitrices en hépatocytes. SPINK1 : serine peptidase inhibitor Kazal type 1. |
|
Patients avec évolution favorable : de nouvelles caractéristiques identifiées Afin de déterminer le rôle de l’activation des macrophages et des cellules progénitrices dans l’hépatite alcoolique, nous avons donc comparé deux groupes de patients : ceux avec une évolution favorable, déterminée à 3 mois par l’amélioration d’un score de sévérité de maladie hépatique (appelé score de MELD, pour model for end stage liver disease), et ceux avec une évolution défavorable, caractérisée par le décès du patient ou l’absence d’amélioration de son score de MELD dans les 3 mois. Par rapport aux patients avec évolution délétère, les patients présentant une évolution favorable ont, à leur admission, le même nombre total de cellules progénitrices mais un nombre significativement plus élevé de macrophages hépatiques, de cellules progénitrices en prolifération, ainsi que d’hépatocytes en prolifération. Le fait que le nombre total de cellules progénitrices soit similaire, mais que le nombre de cellules progénitrices en prolifération soit significativement plus élevé en cas d’amélioration clinique, constitue un argument indirect de différenciation en hépatocytes de ces cellules progénitrices en prolifération et de leur participation à l’amélioration clinique des patients. Notre étude a également comporté une vaste analyse du transcriptome hépatique, à savoir la quantification de plus de 40 000 transcrits (ARNm) au niveau du foie. Cette analyse a mis en évidence une nette augmentation de nombreux transcrits codant pour des protéines impliquées dans le cycle cellulaire, mais également codant pour le récepteur du TWEAK (TNF [tumor necrosis factor] -like weak inducer of apoptosis), qui stimule la prolifération des cellules progénitrices, ainsi que SPINK1 (serine peptidase inhibitor Kazal type 1), une protéine non encore décrite dans l’hépatite alcoolique, mais déjà analysée dans des cas d’hépatocarcinome, et également associée à la croissance cellulaire. Ces protéines, ainsi que les différentes populations cellulaires, ont été localisées sur des coupes histologiques, révélant que des foyers de SPINK1 étaient présents au sein du foie des patients avec évolution favorable, dans les zones de prolifération hépatocytaire, de prolifération des cellules progénitrices et de recrutement macrophagique (Figure 2) [1]. |
Quelles nouvelles possibilités thérapeutiques ? Ces résultats identifient donc de nouveaux facteurs de bon pronostic dans l’hépatite alcoolique. Outre la prolifération des hépatocytes - phénomène évident mais pouvant être compromis en cas d’atteinte sévère du foie -, la prolifération des cellules progénitrices est désormais clairement associée à un meilleur pronostic. La question actuelle est donc : comment stimuler la prolifération de ces cellules ? Une piste intéressante semble être la production de certains facteurs de croissance par les macrophages hépatiques. L’infiltration inflammatoire dans le contexte de la maladie hépatique ne doit donc pas être interprétée uniquement comme délétère, cette inflammation constituant également un stimulus indispensable conduisant vers la régénération. Dans le passé, des traitements comme l’infliximab, inhibant certaines voies inflammatoires (anti-TNF [tumor necrosis factor] alpha), ont d’ailleurs été étudiés dans l’hépatite alcoolique chez l’homme, se révélant bien tolérés à faibles doses [7] mais augmentant la mortalité dans cette maladie à plus fortes doses [2]. D’autres facteurs potentiellement impliqués dans la régénération, comme l’HGF (hepatocyte growth factor), le TWEAK ou SPINK1, doivent être investigués et leur rôle précis déterminé. Nous savons déjà, à partir de précédentes observations chez l’animal, que la suppression des macrophages empêche la différenciation des cellules progénitrices en hépatocytes [6]. Une étude récente indique que cette suppression inhibe également la prolifération de ces cellules progénitrices [8], tandis que l’injection de monocytes stimule leur prolifération et leur différenciation en hépatocytes [8]. Dans le même ordre d’idées, un traitement par facteur de croissance (granulocyte colony-stimulating factor) est capable de stimuler la prolifération des cellules progénitrices [9] mais également d’améliorer la survie des patients présentant une hépatite alcoolique [10]. Ce traitement pourrait notamment agir en stimulant le recrutement de cellules inflammatoires de la moelle vers le foie, qui, à leur tour, participeraient à la multiplication des cellules progénitrices et leur différenciation en hépatocytes… voilà donc de nouveaux mécanismes et de nouvelles cibles en vue. |
Les auteurs déclarent n’avoir aucun conflit d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Lanthier N, Rubbia-Brandt L, Lin-Marq N, et al. Hepatic cell proliferation plays a pivotal role in the prognosis of alcoholic hepatitis . J Hepatol. 2015; ; 63 : :609.–621. 2.
Goossens N, Ditisheim S, Lanthier N, et al. Alcoholic steatohepatitis: what’s new in 2012? Rev Med Suisse. 2012; ; 8 : :1646.–1641. 3.
Lanthier N, Rubbia-Brandt L, Spahr L. Liver progenitor cells and therapeutic potential of stem cells in human chronic liver diseases . Acta Gastroenterol Belg. 2013; ; 76 : :3.–9. 4.
Spahr L, Chalandon Y, Terraz S, et al. Autologous bone marrow mononuclear cell transplantation in patients with decompensated alcoholic liver disease: a randomized controlled trial . PLoS One. 2013; ; 8 : :e53719.. 5.
Espanol-Suner R, Carpentier R, Van Hul N, et al. Liver progenitor cells yield functional hepatocytes in response to chronic liver injury in mice . Gastroenterology. 2012; ; 143 : :1564.–1575. 6.
Van Hul N, Lanthier N, Espanol Suner R, et al. Kupffer cells influence parenchymal invasion and phenotypic orientation, but not the proliferation, of liver progenitor cells in a murine model of liver injury . Am J Pathol. 2011; ; 179 : :1839.–1850. 7.
Spahr L, Rubbia-Brandt L, Frossard JL, et al. Combination of steroids with infliximab or placebo in severe alcoholic hepatitis: a randomized controlled pilot study . J Hepatol. 2002; ; 37 : :448.–455. 8.
Elsegood CL, Chan CW, Degli-Esposti MA, et al. Kupffer cell-monocyte communication is essential for initiating murine liver progenitor cell-mediated liver regeneration . Hepatology. 2015; ; 62 : :1272.–1284. 9.
Spahr L, Lambert JF, Rubbia-Brandt L, et al. Granulocyte-colony stimulating factor induces proliferation of hepatic progenitors in alcoholic steatohepatitis: a randomized trial . Hepatology. 2008; ; 48 : :221.–229. 10.
Singh V, Sharma AK, Narasimhan RL, et al. Granulocyte colony-stimulating factor in severe alcoholic hepatitis: a randomized pilot study . Am J Gastroenterol. 2014; ; 109 : :1417.–1423. 11.
Gilgenkrantz H. Une seule cellule souche dans le foie : l’hépatocyte ! . Med Sci (Paris). 2015; ; 31 : :357.–359. 12.
Lemaigre F. Le développement des lignages hépatiques dans le foie normal et durant la régénération . Med Sci (Paris). 2012; ; 28 : :958.–962. |