L’ulcère de Buruli, ou infection à Mycobacterium ulcerans [11] (→), est une maladie à tropisme essentiellement cutané, qui est diagnostiquée dans 30 pays localisés principalement dans la ceinture tropicale. Cette maladie tropicale négligée et émergente représente actuellement la troisième mycobactériose la plus prévalente chez les sujets immunocompétents, après la tuberculose et la lèpre. L’ulcère de Buruli touche principalement les enfants et provoque de vastes ulcérations cutanées, très invalidantes et stigmatisantes [1]. Les lésions peuvent être traitées par une antibiothérapie, associée à de la chirurgie pour les formes les plus avancées.
(→) Voir la Synthèse de G. Mabèrou-Houngbédji et J. Frénette, m/s n° 2, février 2011, page 187
Le réservoir naturel du bacille, et le lieu probable de contamination pour l’homme, est l’environnement aquatique [12] (→). Comme pour d’autres mycobactéries environnementales, il est très probable qu’il soit nécessaire à M. ulcerans d’être inoculé dans le derme pour qu’il puisse s’y multiplier [2]. Ces dernières années, il a été démontré que des punaises aquatiques pouvaient jouer le rôle d’hôte et vecteur du bacille. Il est probable que plusieurs autres modes de transmission puissent exister, la transmission interhumaine étant cependant exclue.
(→) Voir la Nouvelle de L. Marsollier et al., m/s n° 6-7, juin-juillet 2007, page 572
Les premiers signes cliniques cutanés, non ulcératifs, et peu ou pas douloureux, apparaissent après une incubation de plusieurs semaines suite à l’inoculation. Ils évoluent vers une ulcération cutanée indolore dont l’extension peut être importante [3]. Les destructions tissulaires sont dues à la mycolactone, principal facteur de virulence du bacille [4]. Cette exotoxine, molécule de nature lipidique, se compose d’un noyau lactone et d’une chaîne carbonée. À faible concentration, la mycolactone pourrait présenter des activités immuno-modulatrices permettant au bacille d’échapper au système immunitaire [5, 6]. À plus forte concentration, la mycolactone cause la destruction des tissus.
Le bacille a développé une stratégie de colonisation originale, et proprement « machiavélique », présentant deux caractéristiques principales: (1) le caractère indolore des lésions (pré-ulcératives et ulcératives) à l’origine du retard de la prise en charge des patients, qui négligent leurs plaies, et (2) la capacité du bacille à développer une stratégie d’échappement face au système immunitaire. Les éléments de cette stratégie permettent alors la multiplication « en douceur » du bacille dans le tissu cutané.
Il était couramment admis que le caractère indolore ou peu douloureux des lésions, appelé hypoesthésie, était dû à la destruction des cellules du système nerveux par la mycolactone [7, 8]. Les formes précoces de la maladie, indolores, ne présentent cependant pas de destruction ou de lésion des cellules nerveuses. De plus, les deux seules études in vivo examinant ce sujet ont été réalisées sur des animaux présentant des lésions très avancées, avec une destruction massive du tissu cutané contenant les terminaisons nerveuses. Nous avons donc émis l’hypothèse selon laquelle la mycolactone pourrait plutôt interférer avec le passage de l’influx nerveux, sans destruction préalable des cellules nerveuses.
Nous avons tout d’abord développé un modèle animal qui nous a permis de démontrer que la mycolactone, à des doses ne provoquant pas de lésion tissulaire ni de lésion du tissu nerveux local, induisait effectivement une hypoesthésie locale. Nous avons donc supposé que la mycolactone empêchait la transmission de l’influx nerveux par un mécanisme indépendant de la destruction des cellules nerveuses. Afin de déterminer si la mycolactone agissait par perturbation des courants ioniques, des cellules PC12 (lignée cellulaire présentant des propriétés proches de celles des neurones) ont été incubées avec la mycolactone et les variations du potentiel membranaire ont été suivies par la technique de patch clamp1. Nos résultats montrent que la mycolactone seule est capable de provoquer une hyperpolarisation cellulaire réversible. Cette hyperpolarisation peut s’avérer suffisante pour empêcher la transmission de l’influx nerveux.
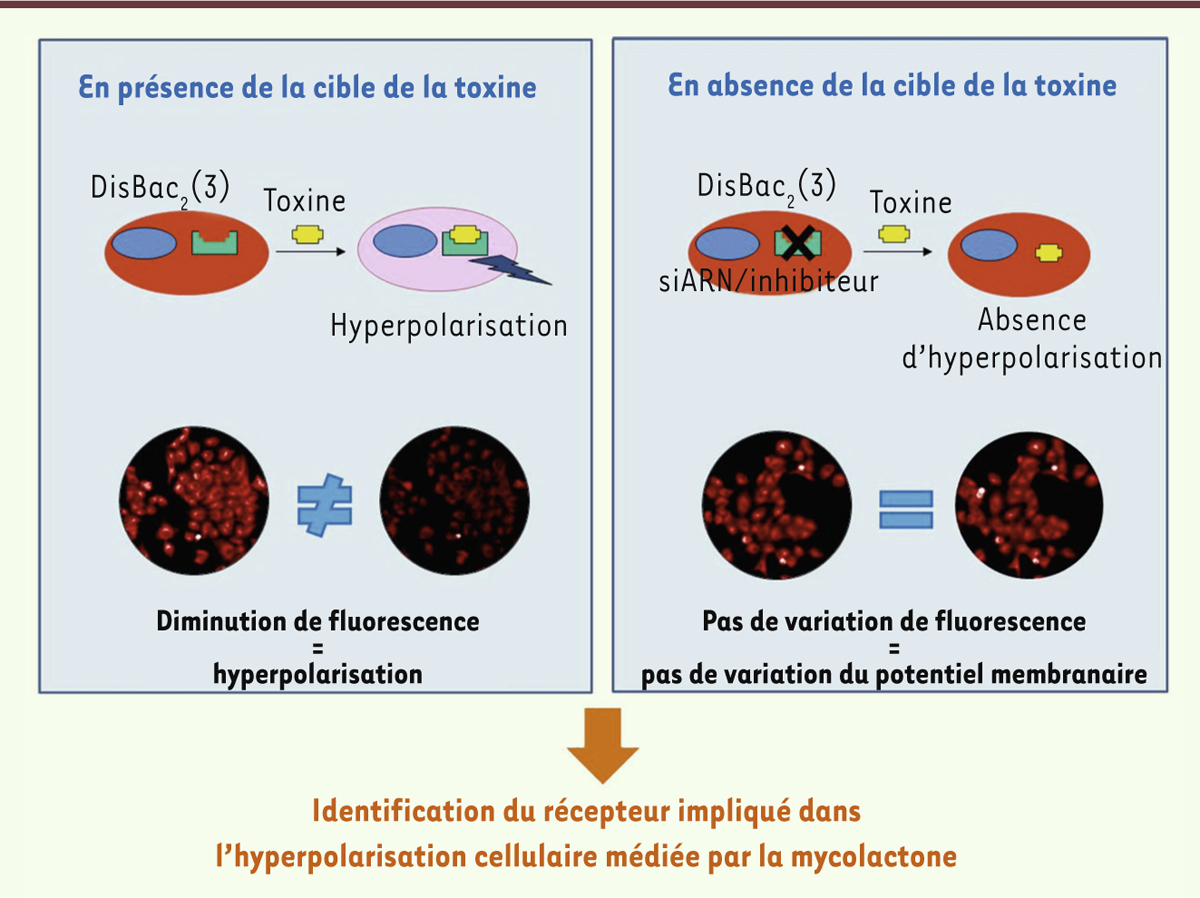
Afin d’identifier les voies cellulaires impliquées dans l’hyperpolarisation médiée par la mycolactone, une méthode de criblage à haut débit par microscopie confocale couplée à une analyse d’image a été spécialement développée. Des cellules - neurones primaires, PC12 et macrophages - ont été marquées par une sonde fluorescente, le DiSBAC2, indicatrice de la variation des potentiels membranaires. En présence de mycolactone, la fluorescence des cellules diminue, démontrant la propriété hyperpolarisante de la mycolactone. Un criblage basé sur le principe des petits ARN interférents (siARN, small interfering RNA), utilisant la sonde DiSBAC2 , a été déployé. Des macrophages de souris ont été transfectés avec une banque de siARN comprenant 8000 siARN différents (Figure 1). Le principe de cette approche repose sur l’absence de variation de la fluorescence des cellules n’exprimant pas, ou peu, les facteurs cellulaires clefs impliqués dans l’hyperpolarisation. Afin de confirmer les résultats de ce premier criblage, mais aussi pour les affiner et les compléter, des criblages orientés, s’appuyant sur des banques de composés chimiques, ont été également réalisés.
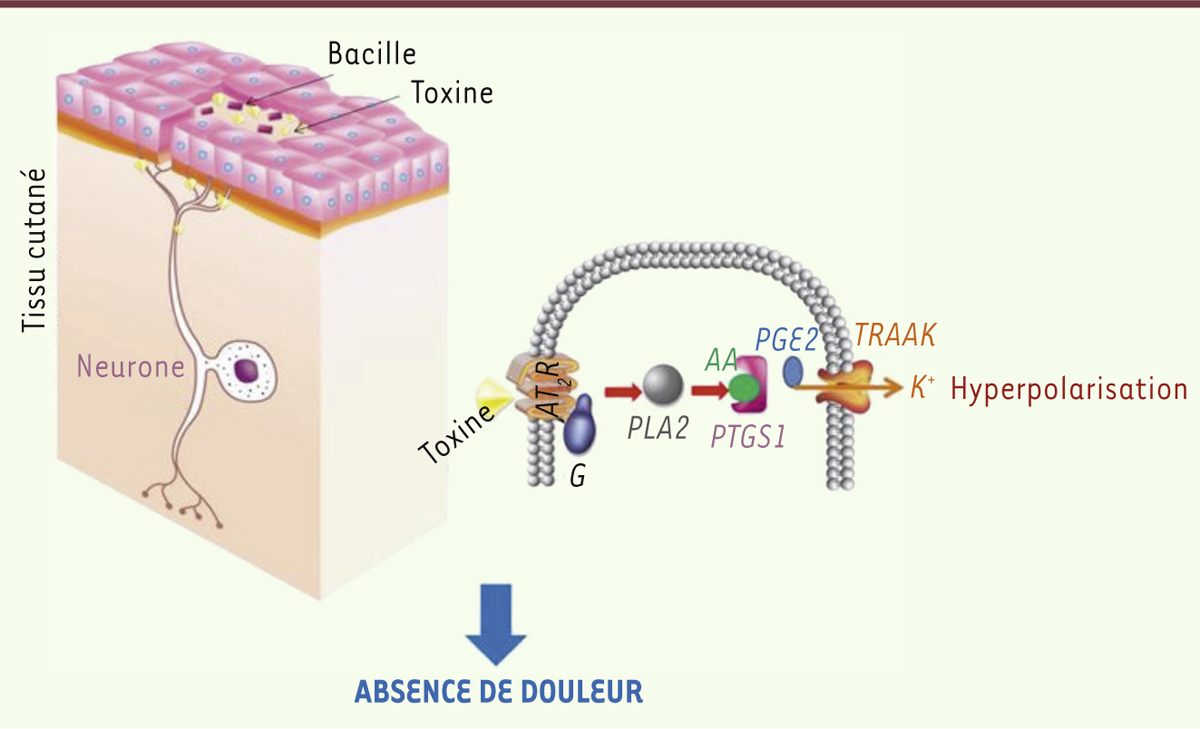
L’analyse des résultats obtenus à l’issue de ces criblages a notamment suggéré l’implication de trois facteurs principaux : le récepteur de type 2 de l’angiotensine 2 (AT2R), les cyclo-oxygénases de type I et les canaux potassiques de la famille TRAAK (TWIK [the weak inward rectifier K+ channel] - related arachidonic acid stimulated K+ channel). L’implication d’AT2R était a priori plutôt inattendue dans notre contexte. Pour valider cette implication, nous avons utilisé un inhibiteur de l’activation de ce récepteur, le PD123319. Nous avons par ailleurs eu recours à des cellules n’exprimant pas constitutivement AT2R. Ces résultats, certes obtenus par des expériences in vitro, ont confirmé l’implication d’AT2R dans l’hyperpolarisation cellulaire médiée par la mycolactone. Des expériences de fixation de la toxine à AT2R (binding assays) ont de plus montré que la mycolactone pouvait interagir directement avec le récepteur. Une série d’expériences complémentaires a permis de disséquer la voie cellulaire impliquée dans l’hyperpolarisation provoquée par la mycolactone (Figure 2). Brièvement, la mycolactone se fixe sur AT2R, déclenchant l’activation des cyclo-oxygénases de type 1 via une phospholipase A2. Cette activation provoque une production de prostaglandines de type 2, qui vont directement interagir avec les canaux potassiques de la famille TRAAK, déclenchant leur ouverture. L’ouverture de ces canaux favorise alors une fuite de potassium provoquant l’hyperpolarisation cellulaire (Figure 2).
| Figure 2.
Action de la mycolactone sur les neurones et dissection de la voie cellulaire impliquée dans l’effet analgésique. La mycolactone se fixe sur le récepteur 2 de l’angiotensine 2 qui est un récepteur associé à une protéine G entraînant l’activation des cyclo-oxygénases de type 1 via une production d’acide arachidonique. Cette activation provoque une augmentation du nombre de molécules de prostaglandines de type 2, déclenchant l’ouverture de canaux K+ (TRAAK). La fuite de potassium qui en résulte est alors responsable de l’hyperpolarisation cellulaire. AT2R : récepteur 2 à l’angiotensine 2, G : protéine G, PLA2 : phospholipase A2, AA : acide arachidonique, PTGS1 : cyclo-oxygénase de type 1, PGE2 : prostaglandines de type 2, TRAAK : canal potassique. |
Afin de vérifier la pertinence des résultats obtenus in vitro, nous avons réalisé des études complémentaires chez un modèle murin. Après inoculation de souris par la mycolactone, la perception de la douleur a été évaluée au niveau du point d’inoculation. L’animal a été soumis à un stimulus (dans notre cas la patte de la souris a été exposée à une source de chaleur) et le temps de réponse au stimulus de chaleur a été chronométré. Un premier groupe de souris, ayant reçu la mycolactone, a réagi au stimulus après un délai plus long que pour le groupe de souris témoin n’ayant pas reçu de toxine, établissant ainsi l’effet hypoesthésique de la mycolactone. Finalement, pour valider également in vivo les voies moléculaires découvertes in vitro, c’est-à-dire vérifier les implications effectives d’AT2R et des cyclo-oxygénases dans le processus à l’origine de l’effet hypoesthésique de la mycolactone, d’autres groupes de souris ont été constitués : (1) un groupe de souris déficientes pour l’expression d’AT2R ; (2) un groupe de souris ayant reçu du PD123319 (inhibiteur de l’activation d’AT2R) ; et (3) un groupe de souris ayant reçu du piroxicam (inhibiteur préférentiellement dirigé contre les cyclo-oxygénases de type I). Pour tous ces groupes, aucun effet hypoesthésique de la mycolactone n’a été mis en évidence. Ces résultats démontrent donc le rôle d’AT2R dans l’hypoesthésie, induite par la mycolactone [9].
En conclusion, l’ensemble de ces travaux ouvre de nouvelles perspectives pour le développement de nouveaux candidats anti-douleur à partir de lactones2 naturelles ou de leurs dérivés. De façon plus générale, nos résultats montrent que le récepteur 2 de l’angiotensine 2 peut représenter une cible de choix pour le développement de nouvelles molécules anti-douleur, conclusion également confortée par d’autres études récentes indépendantes [10]. Dans le contexte de l’infection par M. ulcerans, notre étude met en lumière une stratégie originale, et très surprenante, du bacille dans la colonisation du tissu cutané.