| |
| Med Sci (Paris). 2016 February; 32(2): 158–162. Published online 2016 March 2. doi: 10.1051/medsci/20163202008.Revascularisation du cœur après un infarctus Leçons du développement embryonnaire Lucile Miquerol1* 1Aix-Marseille université, institut de biologie du développement de Marseille, CNRS UMR 7288, campus de Luminy, case 907, 13288Marseille Cedex 9, France MeSH keywords: Animaux, Différenciation cellulaire, Circulation coronarienne, Vaisseaux coronaires, Développement embryonnaire, Cellules endothéliales, Coeur, Humains, Infarctus du myocarde, Myocarde, physiologie, cytologie, embryologie, physiopathologie |
L’infarctus du myocarde demeure une cause majeure de morbidité et de mortalité en France et dans le monde. Il est généralement dû à l’occlusion, plus ou moins sévère, d’une artère coronaire, privant ainsi le myocarde d’oxygène et de nutriments. L’ischémie provoque la perte irréversible des cellules musculaires lorsqu’elle se prolonge au-delà de 30 minutes. La reperfusion1, du cœur, à l’hôpital, diminue la mortalité et les complications cliniques. Elle n’empêche cependant pas la formation d’une zone infarcie2 plus ou moins importante. La revascularisation du cœur, par la formation de nouveaux vaisseaux, est l’une des approches thérapeutiques privilégiées dans le cas de l’infarctus du myocarde [1]. Plusieurs stratégies favorisant l’angiogenèse, comme l’utilisation de facteurs de croissance, la thérapie génique ou l’implantation de cellules souches endothéliales, ont été testées, mais les résultats restent encore très limités en terme de revascularisation du muscle cardiaque [2]. Par exemple, l’injection d’un facteur de croissance comme le VEGF (vascular endothelial growth factor) permet le développement de nombreux vaisseaux qui restent immatures et non fonctionnels. En supposant que les voies impliquées dans la formation des vaisseaux coronaires, au cours du développement embryonnaire, puissent être réutilisées lors d’une atteinte pathologique, une meilleure compréhension de ces mécanismes devrait apporter de nouvelles pistes pour induire une revascularisation efficace. |
Origine multiple des cellules endothéliales coronaires L’endothélium coronaire est constitué d’une monocouche cellulaire qui recouvre la surface interne de tous les vaisseaux sanguins. Dans le cœur adulte, les cellules endothéliales représentent un très grand nombre de cellules, réparties suivant le type de vaisseaux. Les plus nombreuses participent au réseau des petits vaisseaux capillaires, très dense entre les cardiomyocytes. Les autres participent aux vaisseaux coronaires de diamètre variable formant le réseau d’artères et de veines qui irriguent le cœur. Enfin, les cellules endothéliales recouvrent la totalité de la surface interne des ventricules et des oreillettes en une monocouche que l’on appelle endocarde. Tous ces types de cellules endothéliales se distinguent par l’expression de marqueurs spécifiques. L’origine embryologique des différents types de cellules endothéliales n’est pas encore définitivement établie. De récentes avancées dans ce domaine ont été obtenues grâce à de nouvelles techniques de lignages génétiques chez la souris [3, 12] (→).
(→) Voir la Nouvelle de L. Pardanaud, m/s n° 6-7, juin-juillet 2007, page 568
Le lignage génétique consiste à marquer une cellule définie par l’expression d’un gène particulier à un moment donné du développement et cette marque se transmet ensuite à toutes ses cellules filles. L’étude des descendants permet ainsi de définir leur origine. Malgré certaines disparités selon les études, ces expériences proposent que les cellules endothéliales coronaires dérivent de plusieurs origines dans l’embryon de souris. Au cours des premières étapes du développement embryonnaire, le cœur se compose d’un simple tube constitué, à l’extérieur, de cardiomyocytes et, à l’intérieur, de l’endocarde [4]. Avec la croissance des parois musculaires des ventricules, l’endocarde s’invagine entre les cardiomyocytes pour former des projections musculaires appelées trabécules. Ces invaginations permettent aux cardiomyocytes d’être en contact avec le sang et, ainsi, de pourvoir à l’alimentation du cœur, avant que les vaisseaux coronaires ne se forment. En parallèle, des cellules extérieures du cœur migrent à la surface des ventricules pour former l’épicarde, la couche la plus externe des ventricules. Pendant de nombreuses années, l’épicarde a été considéré comme la source majeure des cellules endothéliales du cœur, en envahissant les parois des ventricules de l’extérieur vers l’intérieur par un mécanisme de transformation épithélio-mésenchymateuse (Figure 1) [5]. Or, les dernières données montrent que seulement 5 % des cellules endothéliales coronaires proviendraient de l’épicarde. En revanche, l’épicarde représente la source majeure des fibroblastes et des cellules musculaires lisses qui consolident les vaisseaux coronaires lors de leur maturation. L’épicarde est aussi une source abondante de facteurs de croissance nécessaires au développement des vaisseaux coronaires. Une deuxième source, à l’origine des cellules endothéliales coronaires, est aussi extérieure au cœur, localisée à la base des oreillettes dans la région du sinus veineux (Figure 1) [6, 7]. Plusieurs études récentes montrent que les cellules endothéliales du sinus veineux migrent entre l’épicarde et le myocarde pour envahir toute la surface des ventricules et former le réseau de vaisseaux coronaires. Au cours de cette migration, certaines de ces cellules auraient la capacité de perdre leur caractère de cellules veineuses pour acquérir un caractère artériel et former également les artères coronaires. Par opposition, une autre étude montre que les cellules endothéliales des artères coronaires dérivent directement de l’invagination de l’endocarde, qui perd alors l’expression d’un marqueur spécifique de l’endocarde, et qui s’organise pour former des vaisseaux sous l’influence du facteur de croissance VEGF (vascular endothelial growth factor) et de l’expression de son récepteur VEGFR2 (vascular endothelial growth factor receptor 2) [8]. Enfin, une dernière étude montre que l’endocarde est la source majeure des vaisseaux coronaires qui se développent tardivement, juste après la naissance, lorsque les trabécules se compactent pour former un muscle cardiaque lisse et efficace [9]. Il semblerait donc qu’il existe au moins deux sources majeures de cellules endothéliales, l’endocarde et le sinus veineux, avec une discordance quant à leur contribution respective à la formation des vaisseaux coronaires, selon les études. Ce qui apparaît clairement, cependant, est que les veines proviennent en quasi totalité des cellules du sinus veineux alors que les artères proviendraient des deux populations. Restent à déchiffrer les mécanismes qui instruisent ces cellules endothéliales afin de développer une vasculature coronaire fonctionnelle.
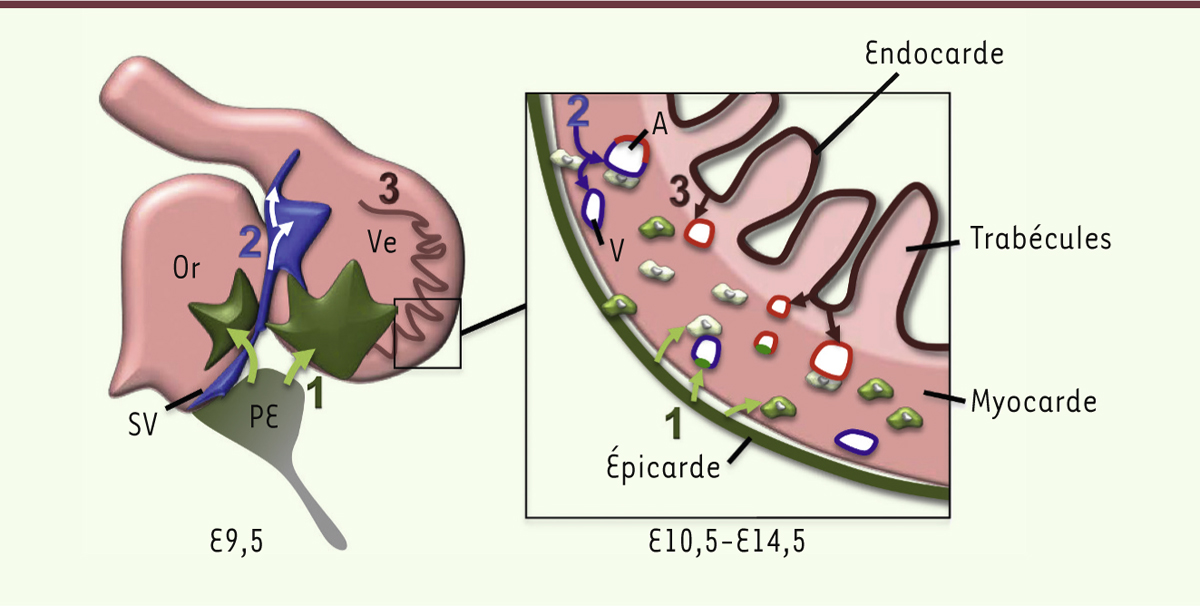
 | Figure 1.
Origine embryonnaire des cellules endothéliales des vaisseaux coronaires. Les cellules endothéliales coronaires dérivent de trois sources distinctes dans l’embryon de souris : (1) l’épicarde ; (2) le sinus veineux ; (3) l’endocarde. Au jour 9,5 de développement embryonnaire (E9,5) : (1) des cellules du proépicarde (PE) migrent à la surface des oreillettes et des ventricules pour former l’épicarde, recouvrant la totalité des oreillettes (Or) et des ventricules (Ve) ; (2) des cellules migrent à partir du sinus veineux (SV) pour envahir le myocarde ; (3) à l’intérieur des ventricules, l’endocarde s’invagine dans le myocarde pour former les trabécules. À partir du jour 10,5 : (1) les cellules de l’épicarde envahissent le myocarde pour former les fibroblastes, les cellules de muscles lisses et quelques cellules endothéliales des vaisseaux coronaires ; (2) les cellules en migration depuis le sinus veineux forment un réseau dense de vaisseaux coronaires sous l’épicarde et participeront à la formation des veines (V) et quelques artères (A) ; (3) l’endocarde à la base des trabécules se referme pour former les artères coronaires lors de la compaction du myocarde. Les veines sont représentées en bleu, les artères en rouge (d’après [ 4]). |
|
L’endocarde : une nouvelle source de revascularisation après l’infarctus du myocarde Nous avons étudié le remodelage vasculaire après un infarctus du myocarde, modélisé par une ligature permanente de la coronaire gauche, chez la souris. Pour cela nous avons utilisé une lignée de souris transgéniques (Cx40-GFP) permettant de visualiser les cellules endothéliales coronaires, exprimant la connexine 40 (Cx40) couplée à une protéine fluorescente (GFP, green fluorescent protein) [10]. La connexine 40, une protéine impliquée dans la communication intercellulaire, est un très bon marqueur des cellules endothéliales des artères coronaires, qui n’est pas exprimé dans les cellules endothéliales des capillaires ou l’endocarde [11]. Lors de la ligature de la coronaire gauche réalisée sur des souris Cx40-GFP, nous avons observé de manière inattendue, grâce à la fluorescence de la GFP, un remodelage important des vaisseaux exprimant Cx40 dans la zone infarcie. Ces artères forment des vaisseaux plus ou moins tortueux qui débouchent à la surface de l’endocarde sous la forme de « fleurs » (Figure 2A). La caractérisation de ces « fleurs endocardiques » montre qu’elles diffèrent des cellules de l’endocarde par l’expression de marqueurs tels que la Cx40 et le récepteur VEGFR2 (Figure 2B, C) et l’absence d’expression des marqueurs endocardiques tels que l’endogline ou l’endomucine (Figure 2D). De plus, ces vaisseaux possèdent des caractéristiques d’artères, comme le montre une accumulation de cellules musculaires lisses localisées autour des fleurs endocardiques (Figure 2E). Ces résultats suggèrent que la zone infarcie est une zone active pour le développement des vaisseaux, malgré les conditions d’ischémie sévère et de nécrose importante observées dans le modèle de ligature permanente utilisé.
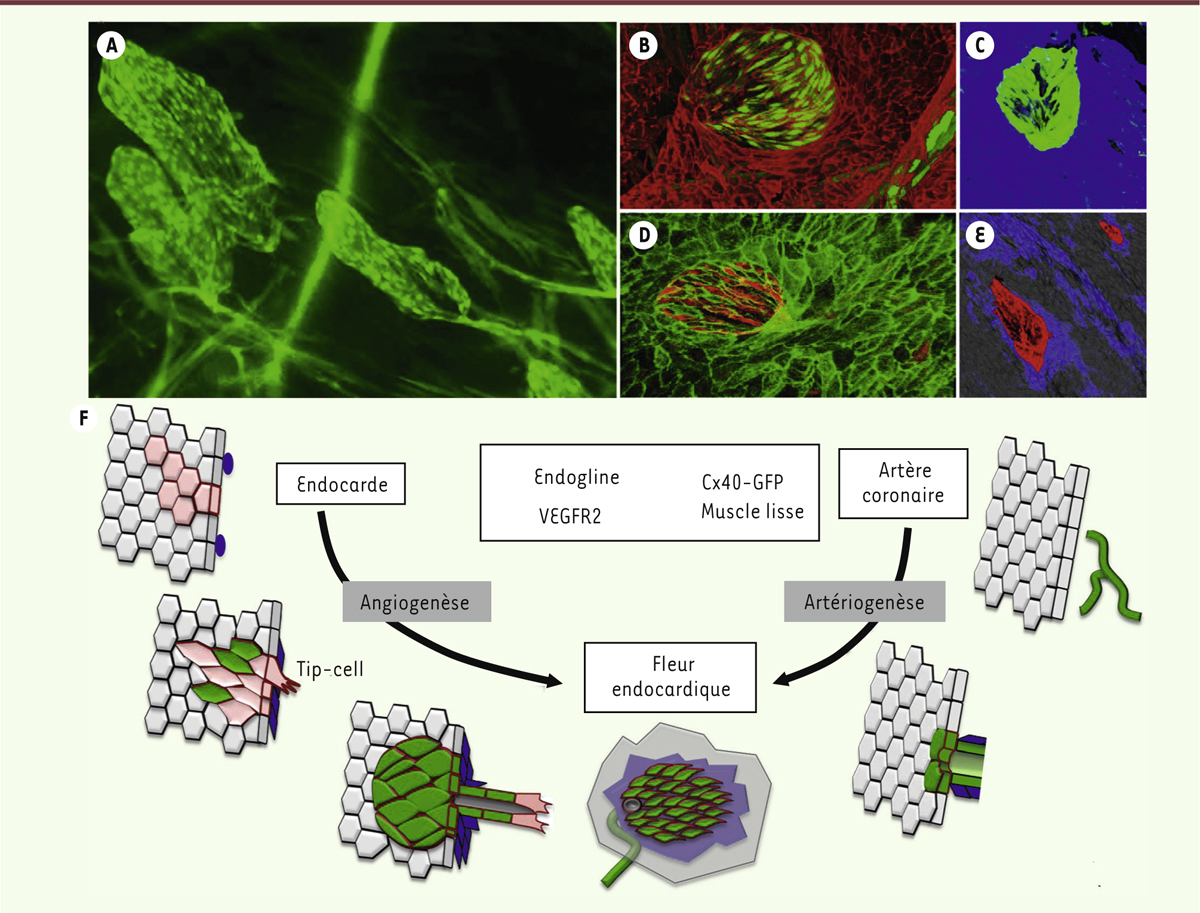
 | Figure 2.
Caractéristiques et formation de fleurs endocardiques dans la zone infarcie d’un cœur de souris. Images de microscopie à fluorescence de la surface de l’endocarde après révélation de plusieurs marqueurs de cellules endothéliales. A. Observation de nouveaux vaisseaux en forme de « fleurs » détectés à la surface de l’endocarde grâce à la fluorescence de la GFP chez des souris Cx40-GFP. B-E. Les cellules endothéliales de fleurs sont positives pour les marqueurs Cx40-GFP (B-D, en vert), VEGFR2 (C-E, en rouge) et négatives pour le marqueur de l’endocarde endogline (D, en bleu). Des cellules musculaires lisses soutiennent ces nouvelles artères (E, en bleu). F. Ces fleurs se développent à partir de deux sources de cellules endothéliales suivant des mécanismes distincts. La première source serait l’endocarde, qui formerait de nouveaux vaisseaux suivant un processus d’angiogenèse faisant appel à une activation du marqueur VEGFR2, avec le bourgeonnement de vaisseaux vers l’intérieur du myocarde sous l’influence de tip cells, et enfin l’acquisition d’un caractère d’artère par l’activation du marqueur Cx40 et la migration de cellules musculaires lisses. La deuxième source de ces fleurs serait les artères coronaires préexistantes, exprimant le marqueur Cx40-GFP avant l’infarctus, et qui atteignent l’endocarde par artériogenèse après l’infarctus. Cx40 : connexine 40 ; GFP : green fluorescent protein ; VEGFR2 : vascular endothelial growth factor receptor 2. |
Une des questions importantes était de savoir si ces vaisseaux résultaient d’une nouvelle vascularisation, à partir de l’endocarde, ou bien d’un remodelage des capillaires ou des coronaires existantes. Pour répondre à cette question, nous avons réalisé un lignage génétique, spécifique des cellules endothéliales marquées pour la Cx40 au sein des artères coronaires, lors d’un infarctus du myocarde chez la souris. Ces analyses montrent l’existence de deux types de fleurs qui proviendraient soit d’un remodelage des artères coronaires préexistantes, soit d’une angiogenèse à partir de l’endocarde (Figure 2F). Cette angiogenèse a été confirmée par l’expression précoce de VEGFR2 par les cellules de l’endocarde et la présence de filopodes. Ces deux caractéristiques sont spécifiques des tip cells, les cellules en bourgeonnement se situant à l’extrémité des vaisseaux en croissance [2]. Une prolifération importante des cellules endocardiques et des muscles lisses sous-jacents accompagne cette angiogenèse. Ces vaisseaux acquièrent rapidement un caractère d’artère avec l’expression de la Cx40. |
Ces résultats suggèrent donc que les mécanismes d’angiogenèse décrits au cours du développement embryonnaire, à savoir l’activation de VEGFR2 et la formation d’artères coronaires à partir de l’endocarde, est un processus conservé et activé dans des conditions pathologiques. Cependant, ces vaisseaux, au centre de la zone infarcie, ne semblent pas persister dans le temps. Il est maintenant nécessaire de chercher les voies d’action qui permettraient de les maintenir et de les rendre fonctionnels. Malgré tout, ces résultats montrent qu’une source endogène de cellules endothéliales, capables de se développer en artère coronaire, est présente au sein de la zone infarcie. Ces observations ouvrent ainsi de nouvelles perspectives pour la revascularisation du cœur après un infarctus. |
L’auteur déclare n’avoir aucun conflit d’intérêt concernant les données publiées dans cet article.
|
L’auteur remercie Robert G. Kelly et Sylvain Richard pour les discussions et la relecture de cet article. Ce travail a été soutenu par la Fondation pour la Recherche Médicale (FRM).
|
Footnotes |
1.
Van Royen N, Piek JJ, Schaper W, Fulton WF. A critical review of clinical arteriogenesis research . J Am Coll Cardiol. 2009; ; 55 : :17.–25. 2.
Potente M, Gerhardt H, Carmeliet P. Basic and therapeutic aspects of angiogenesis . Cell. 2011; ; 146 : :873.–887. 3.
Tian X, Pu WT, Zhou B. Cellular origin and developmental program of coronary angiogenesis . Circ Res. 2015; ; 116 : :515.–530. 4.
Miquerol L, Kelly RG. Organogenesis of the vertebrate heart . Wiley Interdiscip Rev Dev Biol. 2013; ; 2 : :17.–29. 5.
Riley PR, Smart N. Vascularizing the heart . Cardiovasc Res. 2011; ; 91 : :260.–268. 6.
Red-Horse K, Ueno H, Weissman IL, Krasnow MA. Coronary arteries form by developmental reprogramming of venous cells . Nature. 2010; ; 464 : :549.–553. 7.
Tian X, Hu T, Zhang H, et al. Subepicardial endothelial cells invade the embryonic ventricle wall to form coronary arteries . Cell Res. 2013; ; 23 : :1075.–1090. 8.
Wu B, Zhang Z, Lui W, et al. Endocardial cells form the coronary arteries by angiogenesis through myocardial-endocardial VEGF signaling . Cell. 2012; ; 151 : :1083.–1096. 9.
Tian X, Hu T, Zhang H, et al. Vessel formation. De novo formation of a distinct coronary vascular population in neonatal heart . Science. 2014; ; 345 : :90.–94. 10.
Miquerol L, Thireau J, Bideaux P, et al. Endothelial plasticity drives arterial remodeling within the endocardium after myocardial infarction . Circ Res. 2015; ; 116 : :1765.–1771. 11.
Miquerol L, Meysen S, Mangoni M, et al. Architectural and functional asymmetry of the His-Purkinje system of the murine heart . Cardiovasc Res. 2004; ; 63 : :77.–86. 12.
Pardanaud L. Au cœur des cellules souches cardiaques . Med Sci (Paris). 2007; ; 23 : :568.–570. |