| |
| Med Sci (Paris). 2016 February; 32(2): 175–182. Published online 2016 March 2. doi: 10.1051/medsci/20163202011.Certaines bactéries de la flore commensale exacerberaient-elles la carcinogenèse colorectale ? Jennifer Raisch,1,2 Guillaume Dalmasso,1 Richard Bonnet,1,3 Nicolas Barnich,1 Mathilde Bonnet,1 and Marie-Agnès Bringer1,4* 1UMR1071 Inserm-université d’Auvergne, INRA USC2018, 28, place Henri Dunant, 63000Clermont-Ferrand, France 2Laboratoire interaction hôte-pathogène, INRS-institut Armand Frappier, 531, boulevard des Prairies, Laval, QC, Canada 3Centre hospitalier universitaire, 58, rue Montalembert, 63000Clermont-Ferrand, France 4UMR 1324 INRA, 6265 CNRS, Université de Bourgogne Franche-Comté, Centre des Sciences du goût et de l’alimentation, Dijon, France |
Le cancer colorectal (CCR) se situe au troisième rang des cancers les plus fréquemment diagnostiqués dans le monde après ceux du poumon et du sein, avec 1,4 millions de nouveau cas diagnostiqués en 2012. Si environ 10 % des cancers colorectaux sont héréditaires, 90 % sont sporadiques (c’est-à-dire sans origine familiale). Plusieurs facteurs de risques de développer un CCR ont été identifiés comme l’inactivité physique, le tabagisme, une alimentation riche en viande rouge et faible en fibres, la consommation de viandes transformées et d’alcool et certaines pathologies incluant l’obésité, le diabète de type 2 et les maladies inflammatoires chroniques intestinales (MICI) [1]. La plupart de ces facteurs de risques sont associés à un mode de vie occidental. Il existe une grande variation géographique de l’incidence du cancer colorectal et près de 55 % des cas sont dénombrés dans les régions du monde les plus développées. En 2012, l’Océanie et l’Europe enregistraient les taux d’incidence, normalisés sur l’âge pour les deux sexes, les plus élevés, et l’Afrique et l’Asie, ceux les moins élevés. Des altérations de la composition des bactéries (leurs quantités relatives et leur diversité) constituant le microbiote intestinal sont associées à certains des facteurs de risques de développer un CCR, en particulier l’alimentation de type occidentale, l’obésité, le diabète de type 2 et les MICI. La plus grande charge bactérienne est en contact avec le côlon qui est le principal segment intestinal touché par le cancer. Dans des modèles animaux de CCR (génétiques ou chimio-induits), les animaux porteurs d’une flore conventionnelle sont plus susceptibles de développer des tumeurs que des animaux dépourvus de flore. Cumulées, toutes ces observations ont conduit la communauté scientifique à considérer le microbiote intestinal comme pouvant représenter un acteur à part entière du développement du CCR. Dans la majorité des cas, le CCR résulte de la transformation, sur une durée de 10 à 20 ans, d’une lésion bénigne, le polype adénomateux, en adénocarcinome qui peut présenter des propriétés invasives et donc disséminer vers d’autres organes (Figure 1). Cette séquence « adénome-cancer » est initiée, et développée, dynamiquement par une série d’événements moléculaires (accumulation de mutations/aberrations génétiques, altérations épigénétiques) qui conduisent à des modifications cellulaires et tissulaires [1]. Dans cette revue, nous avons choisi de faire un état de la littérature sur le rôle que joue le microbiote intestinal dans le CCR, et sur l’implication suspectée de certaines espèces bactériennes.
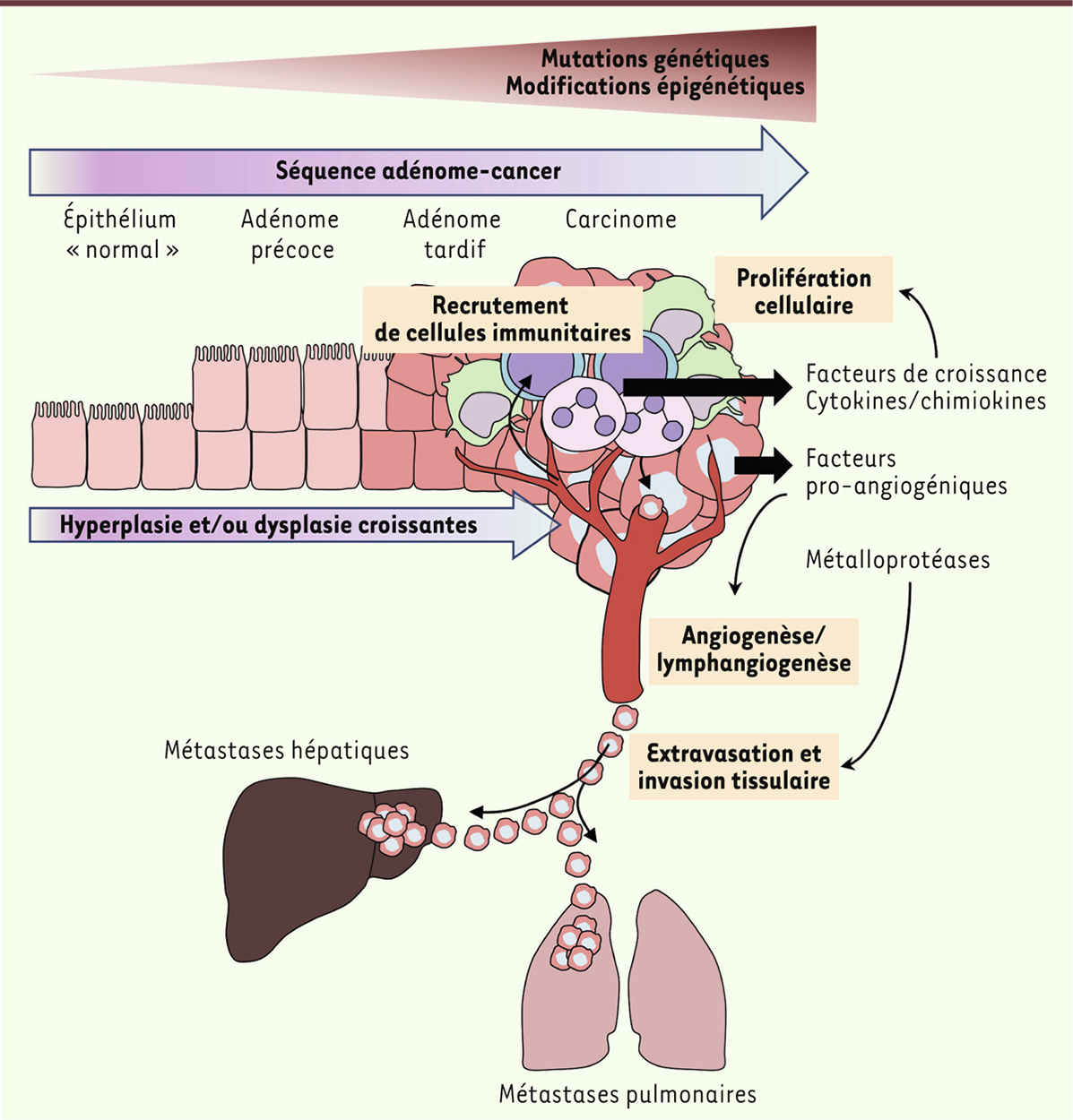
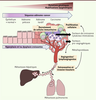 | Figure 1.
Séquence adénome-cancer chez les patients atteints de cancers colorectaux sporadiques. La transformation d’un épithélium normal en carcinome colorectal résulte de l’accumulation de mutations génétiques et de modifications épigénétiques induisant séquentiellement la formation d’adénome précoce (lésion précancéreuse) pouvant évoluer en adénome tardif puis en carcinome (tumeur maligne). Les carcinomes peuvent présenter des propriétés invasives et conduire au développement de sites secondaires tumoraux appelés métastases, en particulier au niveau du foie et des poumons. Cette longue séquence, depuis la première cellule dysplasique jusqu’au cancer invasif, est nommée « séquence adénome-cancer ». La carcinogenèse colorectale implique de manière significative des cellules immunitaires, incluant des macrophages, des lymphocytes et des neutrophiles, qui sont recrutées au niveau du site tumoral et participent à la mise en place de processus pro-tumoraux (promotion de la prolifération et de la survie des cellules malignes, remodelage de la matrice extracellulaire facilitant l’invasion tissulaire, stimulation de l’angiogenèse et de la lymphangiogenèse, etc.) en sécrétant des cytokines/chimiokines, des métalloprotéases, des facteurs de croissance et des facteurs pro-tumoraux tels que la prostaglandine E2 (PGE2). |
|
Microbiote intestinal et cancer colorectal Le microbiote intestinal de chaque individu se compose de 500 à plus de 1 000 espèces bactériennes qui s’organisent en un ensemble limité de communautés. Deux phylums dominent, les Firmicutes et les Bacteroidetes, et d’autres incluant les Actinobacteria, les Proteobacteria, les Verrucomicrobia et les Fusobacteria, sont présents en moindre proportion. Sujet d’études intensives ces deux dernières décennies, le microbiote intestinal est aujourd’hui considéré comme un organe à part entière qui influence profondément la physiologie, le métabolisme et les fonctions nutritionnelles et immunitaires de l’hôte qui l’héberge [2]. Le microbiote intestinal co-évolue avec son hôte. Sous l’influence de modifications environnementales, il est sujet à des remodelages. Ainsi, des modifications de l’équilibre entre microbiote et hôte peuvent avoir d’importantes conséquences qui peuvent être bénéfiques ou délétères pour l’hôte. Avec l’essor des techniques de séquençage haut débit de l’ARN 16S bactérien et le financement de programmes européens et américains visant à explorer la complexité et la variabilité du microbiote humain, il a été possible d’associer des altérations du microbiote intestinal à différentes pathologies dont l’obésité, les MICI et le CCR [3, 4] (→). Ainsi, une surreprésentation des phylums Bacteroidetes, Proteobacteria et Fusobacteria, au détriment des Firmicutes, a été mise en évidence dans les tissus tumoraux de patients atteints de CCR, comparativement à des tissus sains de patients contrôles. Cette modification de représentation bactérienne a également été observée entre des prélèvements tumoraux et des prélèvements luminaux chez des patients. Des études approfondies portant sur l’analyse des espèces bactériennes présentes chez les patients atteints de CCR, comparativement à des sujets contrôles, ont également révélé une augmentation de certaines bactéries : Bacteroides fragilis, Escherichia coli, Streptococcus gallolyticus, Enterococcus faecalis et Fusobacterium nucleatum, et une diminution de Bacteroides vulgatus, de Clostridium coccoides et de Faecalibacterium prausnitzii [5, 6]. Il est à noter toutefois, qu’à l’heure actuelle, bien qu’elles soient très informatives sur la distribution bactérienne, les données relatives au microbiote intestinal chez les patients atteints de CCR présentent certaines limites. En effet, celles-ci ne donnent aux scientifiques qu’une photographie instantanée de la composition du microbiote, alors que la pathologie cancéreuse se développe lentement (10-20 ans) et les remodelages moléculaires, cellulaires et tissulaires qui lui sont associés, laissent supposer une modification dynamique, dans le temps, du microbiote. Par ailleurs, ces données ne sont pas suffisantes à elles seules. Elles ne permettent pas l’établissement d’un lien de causalité entre sur-représentation ou sous-représentation de microorganismes et développement de la maladie.
(→) Voir les Nouvelles de C. Jobin, m/s n° 6-7, juin-juillet 2013, page 582, et de S. Normand et al., m/s n° 6-7, juin-juillet 2013, page 586
Différents modèles murins ont permis de montrer le rôle du microbiote intestinal dans le développement du CCR. Par exemple, des souris maintenues en condition axénique (exempte de tous germes pouvant les coloniser) et donc dépourvues de microbiote intestinal, développent moins de tumeurs intestinales que des souris colonisées par un microbiote intestinal dit « normal » [7]. Au-delà du rôle du microbiote intestinal pris dans sa globalité, sa composition peut profondément influencer le développement du CCR. Cela est particulièrement bien illustré par la capacité d’un microbiote dysbiotique (dont la composition le rend différent de celui observé dans une situation dite « normale »), obtenu à partir de souris développant un CCR chimio-induit, à favoriser l’émergence de tumeurs colorectales chez des animaux axéniques (sans microbiote), ce qui n’est pas le cas de microbiotes isolés de souris conventionnelles n’ayant pas été soumises à la cancérogenèse [7]. |
Bactéries et transformation tumorale colique Si aucune association n’a pu être établie entre une bactérie unique, particulière, et le CCR, comme cela a été le cas, par exemple, pour Helicobacter pylori et le cancer gastrique [36] (→), l’émergence et/ou l’expansion de bactéries commensales coliques, ou provenant de segments digestifs supérieurs, présentant des propriétés oncogéniques et/ou pro-inflammatoires, a été rapportée chez les patients atteints de CCR. Nous avons choisi de présenter ici les espèces bactériennes pour lesquelles des arguments forts concernant leur rôle potentiel dans le CCR, ont été avancés.
(→) Voir la Synthèse de C. Lemercier, m/s n° 8-9, août-septembre 2014, page 758
Bacteroides fragilis entérotoxinogènes
Bacteroides fragilis est une bactérie anaérobie à Gram négatif, commensale du côlon, relativement aérotolérante. Malgré sa faible proportion (elle ne représente que jusqu’à 1 à 2 % des bactéries fécales cultivables), elle est retrouvée chez près de 80 % des enfants et des adultes. Certaines souches de B. fragilis sont capables de produire une toxine de type métalloprotéase dépendante du zinc, appelée fragilysine ou Bacteroides fragilis toxin (BFT). Les souches qui produisent cette toxine sont dites entérotoxinogènes (ETBF, enterotoxigenic B. fragilis) ; celles qui ne la produisent pas sont non-toxinogènes (NTBF, nontoxigenic B. fragilis). Les ETBF sont responsables de diarrhées inflammatoires chez l’homme. Elles colonisent néanmoins, de manière asymptomatique, jusqu’à 25 à 30 % des adultes. Une augmentation de la prévalence de ETBF a été rapportée chez les patients atteints de CCR, comparativement à des sujets contrôles [ 8]. De plus, la présence de ETBF est associée au stade de la maladie, cette bactérie est en effet retrouvée plus fréquemment au niveau des tissus tumoraux et sains des patients à des stades tardifs qu’aux stades précoces de la maladie [ 8]. Plusieurs mécanismes d’action de la fragilysine ont été décrits et pourraient expliquer, au moins en partie, le potentiel carcinogène des ETBF (Figure 2). Il est aujourd’hui bien établi qu’il existe un lien fort entre inflammation et développement tumoral. Contrairement aux NTBF, non-toxinogènes, qui colonisent pourtant, elles aussi, la muqueuse intestinale des animaux, les souches ETBF, toxinogènes, productrices de fragilysine, sont capables d’induire une inflammation et la formation de tumeurs coliques dans un modèle génétique de CCR (les souris MinApc716+/-
qui expriment un gène mutant codant une proteine Apc tronquée en position « acide aminé 716 »)1 [9]. Cette induction résulte de l’activation, par la fragilysine, du facteur de transcription STAT3 (signal transducer and activator of transcription 3) avec pour conséquence la mise en place d’une colite qui se caractérise par une réponse immunitaire sélective de type Th17 (réponse lymphocytaire T helper 17), connue pour être associée à un mauvais pronostic dans le CCR [9]. L’inflammation intestinale induite par les souches ETBF implique également leur capacité à augmenter la perméabilité colique, qui a pour conséquence une inflammation de la sous-muqueuse due à son exposition aux bactéries de la lumière intestinale, et à l’activation des voies de signalisation NF-κB (nuclear factor-kappa B) et MAPK (mitogen-activated protein kinases) à l’origine de l’expression de cytokines pro-inflammatoires [10]. Outre leur propriété pro-inflammatoire, les ETBF stimulent la prolifération cellulaire et la résistance à l’apoptose. En effet, en se fixant sur un récepteur, qui est à ce jour inconnu, la fragilysine induit le clivage de l’E-cadhérine, impliquée à la fois dans les complexes de jonctions et d’adhésion cellulaire, et la séquestration cytoplasmique de la β-caténine [11]. Libérée dans le cytoplasme, la β-caténine passe dans le noyau des cellules et active l’expression de gènes comme c-myc, un oncogène impliqué dans le contrôle de la prolifération cellulaire. La fragilysine pourrait également participer au développement tumoral en favorisant la survie des cellules tumorales. En effet, la stimulation in vitro de cellules par cette toxine induit une augmentation de l’expression de la protéine inhibitrice de l’apoptose cIAP2 (cellular inhibitor of apoptosis protein 2) qui dépend de la cyclooxygénase COX-2 [12]. La fragilysine pourrait aussi participer activement aux anomalies génétiques des cellules tumorales. En effet, in vivo, cette toxine induit au niveau des cellules épithéliales coliques, des dommages à l’ADN, ce qui pourrait conduire à l’accumulation de mutations [13].
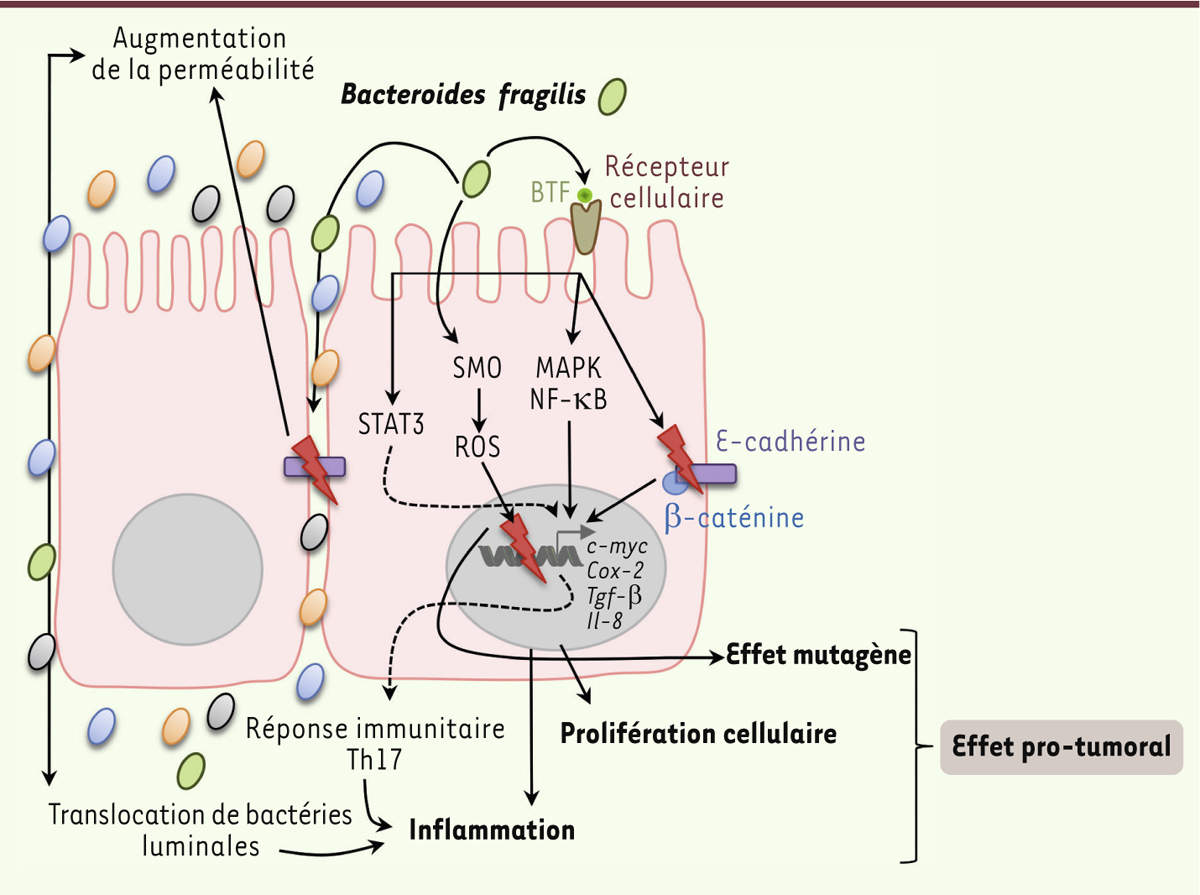
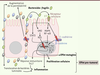 | Figure 2.
Implication de Bacteroides fragilis dans la carcinogenèse colorectale. Certaines souches appartenant à l’espèce Bacteroides fragilis sont dites entérotoxinogènes (ETBF, enterotoxigenic B. fragilis), car elles sécrètent une toxine appelée BFT (B. fragilis toxin) ou fragilysine. La fixation de la fragilysine sur un récepteur, restant encore à identifier et exprimé au niveau des cellules épithéliales intestinales, induit l’activation des voies de signalisation MAPK (mitogen-activated protein kinases), NF-κB (nuclear factor-kappa B), STAT3 (signal transducer and activator of transcription 3) et COX-2 (cyclo-oxygénase-2) et conduit à l’expression et la sécrétion de chimiokines/cytokines telles que le TGF-β (transforming growth factor beta) et l’IL-8 (interleukine-8), et de PGE2 (protaglandine E2) ainsi qu’à la mise en place d’une réponse immunitaire de type Th (T helper) 17 connue pour son association avec un mauvais pronostic de la maladie. L’activation de ces voies de signalisation et la libération de ces molécules dans la sous-muqueuse induit l’inflammation et participe à la promotion du cancer. La fragilysine conduit également au clivage de l’E-cadhérine, induisant la libération de la β-caténine dans le cytoplasme qui peut alors passer dans le noyau et activer la transcription de gènes impliqués dans la prolifération cellulaire tels que l’oncogène c-myc. Le clivage de l’E-cadhérine conduit également à une diminution de la fonction barrière de la muqueuse colique, ce qui pourrait contribuer à l’exacerbation de l’inflammation. Des propriétés mutagènes sont également attribuées aux ETBF, car ils sont capables d’induire l’expression de la spermine oxydase (SMO) qui est responsable de la production d’espèces réactives de l’oxygène (ROS) à l’origine de cassures double brin de l’ADN. |
Fusobacterium nucleatum
Fusobacterium est une bactérie anaérobie commensale à Gram négatif plus fréquemment rencontrée au niveau de la cavité buccale. Elle est associée à des maladies parodontales, à des complications de la grossesse, à des maladies cardiovasculaires, à l’arthrite rhumatoïde, aux appendicites, aux maladies inflammatoires chroniques intestinales (MICI) et au CCR. Une augmentation, d’au moins deux fois, de la prévalence des bactéries appartenant au genre Fusobacterium a été observée au niveau de prélèvements (muqueuse rectale, fèces, tumeurs) chez des patients atteints de CCR, comparativement aux patients contrôles ou à la muqueuse saine adjacente à distance chez ces même patients [ 14]. Comme nous l’avons décrit pour les ETBF, une augmentation de la colonisation par Fusobacterium est observée chez les patients présentant un CCR qui est en relation avec les stades d’avancement de la maladie. Un certain nombre d’informations permettant de comprendre le rôle de Fusobacterium dans le CCR est aujourd’hui disponible. Dans un modèle murin de CCR (souris ApcMin/+
, c’est-à-dire hétérozygotes pour une mutation dans le gène suppresseur de tumeur Apc), l’administration par voie orale de F. nucleatum accélère le développement tumoral en induisant, notamment, l’expression de cytokines pro-inflammatoires comme l’IL(interleukine)-1β, IL-6, IL-8, TNF-α, du facteur pro-tumoral COX-2, ainsi qu’en favorisant l’infiltration des tumeurs par des macrophages présentant un phénotype M2 pro-tumoral [15]. Plusieurs facteurs de virulence de F. nucleatum qui présentent un potentiel oncogénique ont été identifiés (Figure 3). F. nucleatum produit en effet une toxine qui a une activité immunosuppressive, FIP ou FIPA (fusobacterial immunosuppressive protein). Elle est capable d’inhiber le cycle cellulaire, mais son rôle dans le CCR reste à définir [16]. En revanche, l’adhésine FadA (Fusobacterium adhesin A) de F. nucleatum, en se liant à l’E-cadhérine, stimule la croissance tumorale. Cela entraîne l’activation de la voie de signalisation WNT/β-caténine qui induit l’expression de gènes impliqués dans la prolifération cellulaire comme les oncogènes c-myc et cycline D1, et dans l’inflammation comme les gènes codant les cytokines pro-inflammatoires IL-6 et IL-8 [17]. F. nucleatum est également capable d’inhiber l’activité anti-tumorale des cellules NK (natural killer) et des lymphocytes T qui infiltrent les tumeurs en se liant par sa protéine Fap2 (fusobacterial apoptosis protein 2) au récepteur TIGIT (T cell immunoglobulin and ITIM domain) qui est exprimé à la surface de ces cellules immunitaires [18].
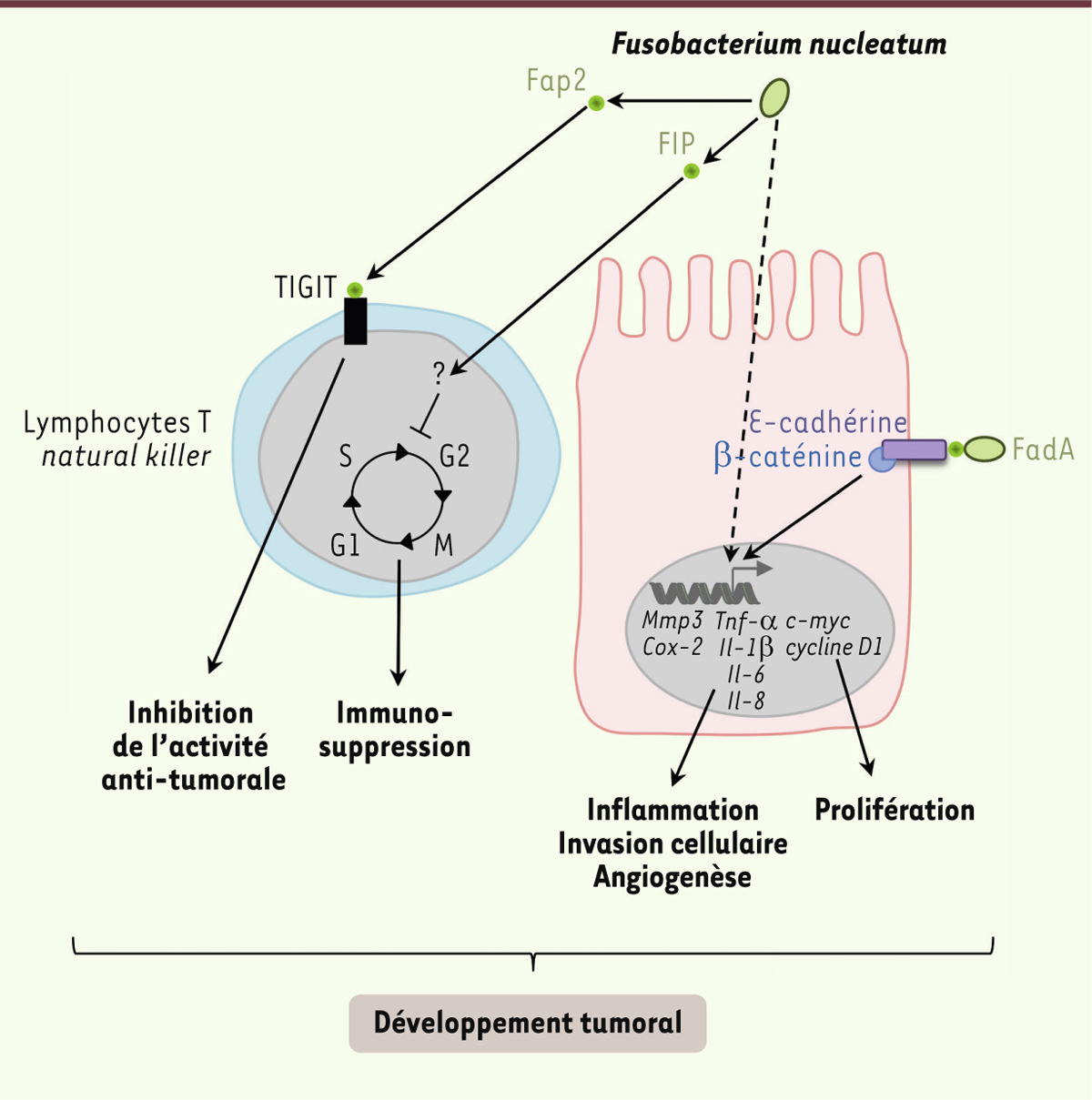
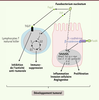 | Figure 3.
Implication de Fusobacterium nucleatum dans la carcinogenèse colorectale.
F. nucleatum est capable, par un mécanisme encore méconnu à ce jour, d’induire l’expression de cytokines pro-inflammatoires telles que l’IL-6, le TNF-α, l’IL-8 et l’IL-1β et des gènes codant les protéines COX-2 (cyclooxygénase 2) et MMP3 (matrix metalloproteinase-3) impliquées dans de nombreux processus pro-tumoraux tels que l’invasion cellulaire. Par ailleurs, trois facteurs de virulence de F. nucleatum ont été identifiés comme pouvant jouer un rôle dans le développement tumoral. L’adhésine FadA (fusobacterium adhesin A) est capable de se lier à l’E-cadhérine et d’activer la voie de signalisation WNT/β-caténine conduisant à l’expression des gènes c-myc et cycline D1 impliqués notamment dans la prolifération cellulaire. La protéine FIP (fusobacterial immunosuppressive protein) produite par F. nucleatum serait capable d’inhiber le cycle cellulaire des lymphocytes T. Par ailleurs, la fixation de Fap2 (fusobacterial apoptosis protein 2) sur le récepteur TIGIT (T cell immunoglobulin and ITIM domain) présent au niveau de la membrane cytoplasmique des lymphocytes T et des cellules NK (natural killer) conduit à une inhibition de leur activité anti-tumorale. |
Escherichia coli
E. coli est une bactérie à Gram négatif aéro-anaérobie facultative commensale intestinale. Certains groupes d’ E. coli, ou pathotypes 2, peuvent être à l’origine d’un large spectre de maladies intestinales et diarrhéiques qui sont associées à la mise en place d’un état inflammatoire aigu, ou chronique, et de maladies extra-intestinales (comme des méningites et des infections urinaires). Huit pathotypes intestinaux d’ E. coli ont été décrits : les E. coli entérohémorragiques (EHEC), les entéropathogènes (EPEC), les entérotoxinogènes (ETEC), les entéroagrégatifs (EAEC), les entéroagrégatifs producteurs de Shiga-toxine (STEAEC), les entéroinvasifs (EIEC) à adhésion diffuse (DAEC) et adhérents et invasifs (AIEC). À l’exception des AIEC associés à la maladie de Crohn, une maladie inflammatoire chronique intestinale dont la caractérisation repose principalement sur des critères phénotypiques d’interaction avec les cellules de l’hôte, les autres pathovars d’ E. coli se distinguent par l’expression de facteurs de virulence spécifiques. Les carcinomes et la muqueuse colique de plus de 50 % des patients atteints de CCR sont anormalement colonisés par un nombre élevé d’E. coli, comparativement à des tissus de sujets contrôles, avec une augmentation de la colonisation des tumeurs qui est en fonction de l’avancement du stade tumoral [19–21]. Les souches d’E. coli qui colonisent les patients atteints de CCR appartiennent majoritairement aux phylogroupes B2 et D qui regroupent majoritairement les E. coli pathogènes [22]. En revanche, elles ne semblent pas appartenir à un pathovar déjà décrit d’E. coli. En effet, 25 % des E. coli isolés d’adénocarcinomes humains hébergent le gène eae (E. coli attaching and effacing) qui est associé aux pathovars EHEC et EPEC [23]. Le groupe de J. Rhodes a montré d’autre part une prévalence augmentée (14/21 patients ; 67 %) de souches positives pour le gène afaC (afimbrial adhesins C) associé aux DAEC chez les patients atteints de CCR, comparativement à des sujets contrôles (4/24 patients ; 17 %) [24]. Cependant, dans l’étude réalisée par Raisch et al., aucune des souches d’E. coli isolées de patients atteints de CCR ne présentait le gène eae et seulement 8,6 % possédaient le gène afa [22]. Ces souches sont peu adhérentes et invasives vis-à-vis de cellules épithéliales intestinales, ce qui les excluent aussi des pathovars AIEC et EIEC. Des études récentes montrent une augmentation de la prévalence d’E. coli producteurs de cyclomodulines, toxines capables d’induire des dommages à l’ADN et/ou de perturber le cycle cellulaire des cellules eucaryotes, en particulier la colibactine et CNF-1 (cytotoxic necrotizing factor-1), chez les patients atteints de CCR, comparativement à des sujets contrôles [19, 22, 24]. La communauté scientifique s’est, pour l’instant, principalement focalisée sur l’étude du rôle joué par la colibactine dans le CCR [25] (→). Une forte prévalence de souches hébergeant l’îlot génomique « pks », qui porte des gènes codant des polykétides synthases (PKS) et des peptides synthases non-ribosomiques (NRPS) impliqués dans la synthèse de cette génotoxine, est en effet associée au CCR [19]. Dans le modèle murin de carcinogenèse (utilisant l’azoxyméthane [AOM] et des souris IL10-/-), une étude récente montre l’existence de remaniements transcriptomiques au sein d’E. coli avec notamment une augmentation de l’expression de gènes de l’îlot pks. Cela suggère que les modifications du microenvironnement intestinal qui sont associées au développement du CCR peuvent influencer le potentiel pro-carcinogène des espèces bactériennes présentes [26]. Les bactéries produisant la colibactine peuvent induire in vitro et in vivo des cassures double brin de l’ADN, avec pour conséquences potentielles l’accumulation d’aberrations chromosomiques et une augmentation de la fréquence des mutations génétiques (Figure 4) [27]. La colibactine est un composé instable qui n’a pas été purifié à ce jour. Cependant, un intermédiaire de sa synthèse, bien qu’incapable de casser l’ADN, est capable d’alkyler l’ADN et d’induire des liens inter-brins [28]. L’hypothèse avancée est que les cassures observées seraient le fait d’une tentative de la cellule infectée de réparer son ADN. Les cellules infectées par les E. coli producteurs de colibactine peuvent également entrer en sénescence. Cela s’accompagne de la production d’espèces oxygénées réactives (ROS) connues pour leurs effets génotoxiques, mais également de la sécrétion de facteurs de croissance, comme l’HGF (hepatocyte growth factor), qui stimulent, par effet collatéral, la prolifération de cellules non infectées adjacentes [29, 30]. Dans des modèles murins de carcinogenèse génétique (souris AOM/IL10-/- ou ApcMin/+) ou chimio-induite, l’infection par des E. coli producteurs de colibactine induit une accélération du développement tumoral, comparativement aux animaux contrôles non infectés ou infectés avec un mutant de ces souches ne produisant pas de colibactine, ou encore aux animaux infectés et traités avec des molécules inhibant la synthèse de la colibactine [19, 20, 31].
(→) Voir la Synthèse de I. Sobhani, m/s n° 4, avril 2004, page 431
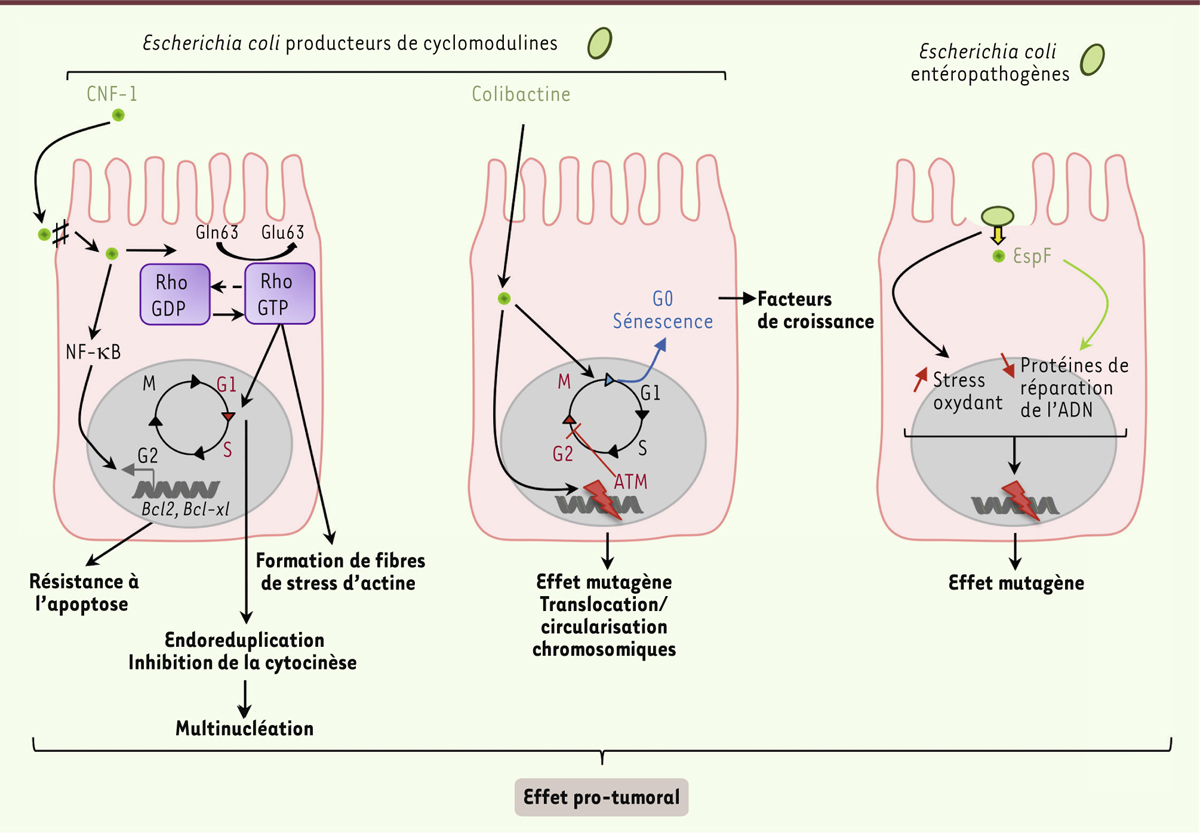
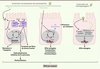 | Figure 4.
Implication d’Escherichia coli dans la carcinogenèse colorectale. Les E. coli producteurs de colibactine induisent des cassures double brin de l’ADN pouvant être à l’origine d’importants remaniements chromosomiques, tels que des translocations et la formation de chromosomes circulaires, conduisant à un arrêt du cycle cellulaire en phase G2. Par ailleurs, les cellules infectées par des E. coli producteurs de colibactine, peuvent sortir du cycle cellulaire et entrer en sénescence. Cela s’accompagne de la sécrétion de facteurs de croissance qui soutiennent le développement tumoral. La toxine CNF-1 (cytotoxic necrotizing factor) se lie au niveau des jonctions serrées des cellules hôtes qui l’internalisent par endocytose. Dans le cytoplasme, CNF-1 induit la désamination du résidu glutamine des GTPases (enzymes qui lient et hydrolysent le GTP, guanine triphosphate) de la famille Rho, ce qui conduit à l’apparition de fibres de stress d’actine, une endoréduplication de l’ADN ainsi qu’une inhibition de la cytocinèse induisant une multi-nucléation. L’activation de la voie NF-κB (nuclear factor-kappa B) par cette toxine induit l’activation de l’expression des gènes Bcl2 (B-cell lymphoma 2) et Bcl-xl (B-cell lymphoma-extra large) induisant la résistance à l’apoptose des cellules. Les souches EPEC sont capables d’augmenter la fréquence de mutations spontanées dans les cellules hôtes en altérant notamment l’expression de protéines de réparation de l’ADN MMR (mismatch repair) par l’induction d’un stress oxydant et par l’action post-transcriptionnelle d’un effecteur bactérien sécrété, EspF (E. coli secreted protein F). ATM : monobactames. |
Dix-huit pour cent des souches d’E. coli isolées de patients atteints de CCR contre seulement 9 % de celles isolées de contrôles, hébergent un gène codant la cyclomoduline CNF-1. Celle-ci est capable d’influencer directement la prolifération en favorisant l’entrée dans le cycle cellulaire et la transition G1/S, mais également renforce la survie cellulaire en induisant notamment l’expression des protéines anti-apoptotiques Bcl-2 (B-cell lymphoma 2) et Bcl-xl (B-cell lymphoma-extra large) (Figure 4) [32]. Toutefois, le rôle de CNF-1 dans le CCR n’a pas encore été exploré. Certaines souches d’E. coli seraient capables d’induire des altérations génomiques indépendamment de l’action de cyclomodulines. En effet, Maddocks et al. ont montré que les EPEC colonisent anormalement les adénocarcinomes de patients et sont capables d’inhiber le système de réparation de l’ADN (MMR, mismatch repair) en induisant un stress oxydant et par l’action post-transcriptionnelle d’un effecteur bactérien sécrété, EspF (E. coli secreted protein F) (Figure 4) [33]. Par ailleurs, les E. coli, infiltrant les tumeurs, pourraient influencer la progression tumorale en persistant dans les cellules immunitaires et en induisant la production de facteurs pro-tumoraux comme COX-2/PGE2 (prostaglandine E2) [34]. |
Les études portant sur la composition du microbiote intestinal chez les patients ont permis une avancée considérable dans la compréhension des mécanismes biologiques mis en jeu dans la carcinogenèse colorectale. Elles ont apporté notamment une meilleure connaissance des remodelages opérés au niveau du microbiote, et ont conduit à l’identification de bactéries commensales pouvant présenter des propriétés oncogéniques et à la caractérisation de leur interaction avec les acteurs cellulaires moteurs du développement tumoral. Cela a donc permis d’ouvrir la réflexion sur de nouvelles perspectives visant à utiliser des marqueurs microbiens comme outils diagnostique et pronostique de la pathologie en elle-même, mais également sur l’efficacité des traitements utilisés, avec la mise en évidence du rôle du microbiote dans le métabolisme des médicaments [35]. Ces découvertes ont également conduit à la prise de conscience que la lutte contre le CCR doit également prendre en compte le rétablissement de l’équilibre et des fonctions du microbiote intestinal, celui-ci entretenant une relation de mutualisme forte et influente sur l’hôte. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient tous les membres de leur laboratoire et leurs collaborateurs pour leur contribution. MA Bringer remercie pour son soutien financier le Conseil régional d’Auvergne et la Ligue contre le cancer (comité du Puy de Dôme). Le travail de doctorat de J Raisch a été financé en partie par la Fondation pour la recherche médicale.
|
|
AIEC
|
Escherichia coli adhérents et invasifs |
|
AOM
|
azoxyméthane |
|
BCL
|
B-cell lymphoma |
|
BFT
|
Bacteroides fragilis toxin |
|
CCR
|
cancer colorectal |
|
CNF-1
|
cytotoxic necrotizing factor-1 |
|
COX-2
|
cyclo-oxygénase-2 |
|
DAEC
|
Escherichia coli à adhésion diffuse |
|
EHEC
|
Escherichia coli entérohémorragiques |
|
EIEC
|
Escherichia coli entéroinvasifs |
|
EPEC
|
Escherichia coli entéropathogènes |
|
ETBF
|
Bacteroides fragilis entérotoxinogènes |
|
FIP
|
fusobacterial immunosuppressive protein |
|
MAPK
|
mitogen-activated protein kinases |
|
MICI
|
maladies inflammatoires chroniques intestinales |
|
MMR
|
mismatch repair |
|
NF-κB
|
nuclear factor-kappa B |
|
NTBF
|
Bacteroides fragilis non-toxinogènes |
|
PGE2
|
prostaglandine E2 |
|
STAT3
|
signal transducer and activator of transcription 3 |
|
TIGIT
|
T cell immunoglobulin and ITIM domain |
|
Footnotes |
1.
Brenner H, Kloor M, Pox CP. Colorectal cancer . Lancet. 2014; ; 383 : :1490.–1502. 2.
Sommer F, Backhed F. The gut microbiota–masters of host development and physiology . Nat Rev Microbiol. 2013; ; 11 : :227.–238. 3.
Jobin C. Microbiome : un nouveau facteur de risque de cancer colorectal ? Med Sci (Paris). 2013; ; 29 : :582.–585. 4.
Normand S, Secher T, Chamaillard M. La dysbiose, une nouvelle entité en médecine ? Med Sci (Paris). 2013; ; 29 : :586.–589. 5.
Allen-Vercoe E, Jobin C. Fusobacterium and Enterobacteriaceae: important players for CRC? Immunol Lett. 2014; ; 162 : :54.–61. 6.
Viljoen KS, Dakshinamurthy A, Goldberg P, Blackburn JM. Quantitative profiling of colorectal cancer-associated bacteria reveals associations between fusobacterium spp., enterotoxigenic Bacteroides fragilis (ETBF) and clinicopathological features of colorectal cancer . PLoS One. 2015; ; 10 : :e0119462.. 7.
Zackular JP, Baxter NT, Iverson KD, et al. The gut microbiome modulates colon tumorigenesis . MBio. 2013; ; 4 : :e00692.–e00613. 8.
Boleij A, Hechenbleikner EM, Goodwin AC, et al. The Bacteroides fragilis toxin gene is prevalent in the colon mucosa of colorectal cancer patients . Clin Infect Dis. 2015; ; 60 : :208.–215. 9.
Wu S, Rhee KJ, Albesiano E, et al. A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cell responses . Nat Med. 2009; ; 15 : :1016.–1022. 10.
Rhee KJ, Wu S, Wu X, et al. Induction of persistent colitis by a human commensal, enterotoxigenic Bacteroides fragilis, in wild-type C57BL/6 mice . Infect Immun. 2009; ; 77 : :1708.–1718. 11.
Wu S, Morin PJ, Maouyo D, Sears CL. Bacteroides fragilis enterotoxin induces c-Myc expression and cellular proliferation . Gastroenterology. 2003; ; 124 : :392.–400. 12.
Kim JM, Lee JY, Kim YJ. Inhibition of apoptosis in Bacteroides fragilis enterotoxin-stimulated intestinal epithelial cells through the induction of c-IAP-2 . Eur J Immunol. 2008; ; 38 : :2190.–2199. 13.
Goodwin AC, Destefano Shields CE, Wu S, et al. Polyamine catabolism contributes to enterotoxigenic Bacteroides fragilis-induced colon tumorigenesis . Proc Natl Acad Sci USA. 2011; ; 108 : :15354.–15359. 14.
Kostic AD, Gevers D, Pedamallu CS, et al. Genomic analysis identifies association of Fusobacterium with colorectal carcinoma . Genome Res. 2012; ; 22 : :292.–298. 15.
Kostic AD, Chun E, Robertson L, et al. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment . Cell Host Microbe. 2013; ; 14 : :207.–215. 16.
Shenker BJ, Datar S. Fusobacterium nucleatum inhibits human T-cell activation by arresting cells in the mid-G1 phase of the cell cycle . Infect Immun. 1995; ; 63 : :4830.–4836. 17.
Rubinstein MR, Wang X, Liu W, et al. Fusobacterium nucleatum promotes colorectal carcinogenesis by modulating E-cadherin/beta-catenin signaling via its FadA adhesin . Cell Host Microbe. 2013; ; 14 : :195.–206. 18.
Gur C, Ibrahim Y, Isaacson B, et al. Binding of the Fap2 protein of Fusobacterium nucleatum to human inhibitory receptor TIGIT protects tumors from immune cell attack . Immunity. 2015; ; 42 : :344.–355. 19.
Arthur JC, Perez-Chanona E, Muhlbauer M, et al. Intestinal inflammation targets cancer-inducing activity of the microbiota . Science. 2012; ; 338 : :120.–123. 20.
Bonnet M, Buc E, Sauvanet P, et al. Colonization of the human gut by E. coli and colorectal cancer risk . Clin Cancer Res. 2014; ; 20 : :859.–867. 21.
Feng Q, Liang S, Jia H, et al. Gut microbiome development along the colorectal adenoma-carcinoma sequence . Nat Commun. 2015; ; 6 : :6528.. 22.
Raisch J, Buc E, Bonnet M, et al. Colon cancer-associated B2 Escherichia coli colonize gut mucosa and promote cell proliferation . World J Gastroenterol. 2014; ; 20 : :6560.–6572. 23.
Maddocks OD, Short AJ, Donnenberg MS, et al. Attaching and effacing Escherichia coli downregulate DNA mismatch repair protein in vitro and are associated with colorectal adenocarcinomas in humans . PLoS One. 2009; ; 4 : :e5517.. 24.
Prorok-Hamon M, Friswell MK, Alswied A, et al. Colonic mucosa-associated diffusely adherent afaC+ Escherichia coli expressing lpfA and pks are increased in inflammatory bowel disease and colon cancer . Gut. 2014; ; 63 : :761.–770. 25.
Lemercier C. Les infections bactériennes vues du génome eucaryote : cassures double-brin, inflammation et cancer . Med Sci (Paris). 2014; ; 30 : :758.–764. 26.
Arthur JC, Gharaibeh RZ, Muhlbauer M, et al. Microbial genomic analysis reveals the essential role of inflammation in bacteria-induced colorectal cancer . Nat Commun. 2014; ; 5 : :4724.. 27.
Cuevas-Ramos G, Petit CR, Marcq I, et al. Escherichia coli induces DNA damage in vivo and triggers genomic instability in mammalian cells . Proc Natl Acad Sci USA. 2010; ; 107 : :11537.–11542. 28.
Vizcaino MI, Crawford JM. The colibactin warhead crosslinks DNA . Nat Chem. 2015; ; 7 : :411.–417. 29.
Cougnoux A, Dalmasso G, Martinez R, et al. Bacterial genotoxin colibactin promotes colon tumour growth by inducing a senescence-associated secretory phenotype . Gut. 2014; ; 63 : :1932.–1942. 30.
Secher T, Samba-Louaka A, Oswald E, Nougayrede JP. Escherichia coli producing colibactin triggers premature and transmissible senescence in mammalian cells . PLoS One. 2013; ; 8 : :e77157.. 31.
Cougnoux A, Delmas J, Gibold L, et al. Small-molecule inhibitors prevent the genotoxic and protumoural effects induced by colibactin-producing bacteria . Gut. 2015 ; pii : gutjnl-2014-307241. 32.
Miraglia AG, Travaglione S, Meschini S, et al. Cytotoxic necrotizing factor 1 prevents apoptosis via the Akt/IkappaB kinase pathway: role of nuclear factor-kappaB and Bcl-2 . Mol Biol Cell. 2007; ; 18 : :2735.–2744. 33.
Maddocks OD, Scanlon KM, Donnenberg MS. An Escherichia coli effector protein promotes host mutation via depletion of DNA mismatch repair proteins . MBio. 2013; ; 4 : :e00152.–e00113. 34.
Raisch J, Rolhion N, Dubois A, et al. Intracellular colon cancer-associated Escherichia coli promote protumoral activities of human macrophages by inducing sustained COX-2 expression . Lab Invest. 2015; ; 95 : :296.–307. 35.
Iida N, Dzutsev A, Stewart CA, et al. Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment . Science. 2013; ; 342 : :967.–970. 36.
Sobhani I. Helicobacter pylori et cancer gastrique . Med Sci (Paris). 2004; ; 20 : :431.–436. |