Le virus de l’hépatite B (VHB) est communément considéré comme un virus non cytopathique, c’est-à-dire n’altérant pas les fonctions métaboliques, biochimiques ou morphologiques des cellules infectées. Les dommages au foie qui sont observés à la suite de l’infection par le VHB sont en fait probablement la conséquence de la réponse immunitaire adaptative de l’hôte. La sévérité de la maladie hépatique varie selon les individus. Dans plus de 90 % des cas, les adultes infectés par le VHB développent une hépatite aiguë et sont capables de contrôler et d’éliminer le virus sans effets indésirables à long terme. En revanche, certains individus ne parviennent pas à éliminer le virus mais restent infectés de façon chronique [11] (→). Ils présentent alors un risque accru de développer des maladies du foie sévères telles que la cirrhose ou le carcinome hépatocellulaire [1]. Selon l’Organisation mondiale de la santé (OMS), 240 millions d’individus seraient porteurs chroniques du VHB à travers le monde. Ces patients souffrent d’une hépatite B chronique (HBC) généralement divisée en 4 phases dont la durée et l’ordre peuvent varier (Tableau I) : la phase d’immunotolérance (IT), la phase immuno-active (eAg+ [hepatitis B e-antigen] active), la phase inactive (IN) et la phase de réactivation virale (eAg- active). Lors de la phase immuno-active, une réponse lymphocytaire T inadéquate peut conduire à d’importants dommages hépatiques dus à l’infiltration de lymphocytes T non spécifiques [2]. A contrario, au cours de la phase d’immunotolérance, une forte charge virale ne conduit pas nécessairement à une forte réponse immunitaire. Dans une étude très intéressante, Pallet et ses collaborateurs [3] ont cherché à comprendre les raisons de ce paradoxe, c’est-à-dire à déterminer comment se réalisent les immunorégulations lors d’une hépatite chronique.
(→) Voir la Nouvelle de J. Lucifora et al., m/s n° 8-9, août-septembre 2014, page 724
Tableau I.
Caractéristiques des phases d’une infection chronique par le virus de l’hépatite B.
| ||||||||||||||||||||||||||||||||
Le rôle central du milieu métabolique dans la régulation de l’immunité et, notamment, le besoin accru en acides aminés pour mettre en place une réponse immunitaire efficace, a été récemment mis en évidence [4]. Précédemment, l’équipe dirigée par Mala Maini avait décrit, chez les patients atteints d’une hépatite B chronique, un défaut de prolifération des lymphocytes T qui était concomitant avec une perte de l’expression de CD3-ζ, une des sous-unités constituant le TCR-CD3 (T cell receptor) [5]. Cette perte d’expression avait été décrite comme un marqueur caractéristique d’une privation en L-arginine (un acide aminé qui joue un rôle important dans la réponse des macrophages). Faisant suite à ces travaux, et pour comprendre les mécanismes sous-jacents, Pallet et al. ont étudié une population hétérogène de cellules immunitaires suppressives myéloïdes (MDSC, myeloid-derived suppressor cell) impliquées dans les régulations métaboliques. De façon intéressante, les auteurs ont montré que ces MDSC étaient impliquées dans l’inhibition de la réponse lymphocytaire T contre le VHB [3]. Les MDSC, et plus précisément les gMDSC (granulocytic MDSC, des MDSC qui possèdent des caractéristiques de granulocyte immature et qui expriment l’arginase1,), sont retrouvés en plus grand nombre dans le sérum et le foie des patients présentant une hépatite B chronique. Cette augmentation, plus prononcée dans le foie [3], est spécifiquement observée chez les patients dont la maladie se situe dans des phases non inflammatoires (phases IT et IN, Tableau I ) et elle est inversement corrélée avec le score de nécro-inflammation hépatique. Chez les patients infectés de façon aiguë par le virus, le nombre de gMDSC est inversement proportionnel au niveau de transaminases sériques (marqueurs de dommages hépatiques). Ces données suggèrent que les gMDSC pourraient supprimer l’inflammation et donc avoir un rôle de protection contre les dommages hépatiques lors d’une infection par le VHB.
Le (ou les) mécanisme(s) impliqué(s) dans la prolifération des gMDSC lors de ces phases, ainsi que les facteurs et les récepteurs responsables de leur recrutement au niveau hépatique, restent cependant à identifier. Pallet et al. ont comparé, sur les gMDSC sériques et les gMDSC hépatiques, l’expression de différents chimiorécepteurs pouvant intervenir dans le recrutement hépatique de ces cellules. La relocalisation hépatique des gMDSC pourrait ainsi résulter de multiples modifications : une diminution de CXCR4 (chemokine [C-X-C motif] receptor 4), ce qui induit une mobilisation des cellules en dehors de la moelle osseuse, et une augmentation de CXCR3 (chemokine [C-X-C motif] receptor 3), conduisant à une interaction avec les cellules hépatiques étoilées2, [3]. Un facteur viral pourrait également participer au recrutement des gMDSC. Auquel cas, le traitement des patients immunotolérants (qui n’est pas préconisé à l’heure actuelle), visant à la réduction des facteurs viraux sanguins, pourrait permettre d’empêcher le recrutement des gMDSC et donc de maintenir une réponse antivirale active.
Plusieurs études avaient montré que les MDSC pouvaient inhiber les réponses immunitaires par la production d’arginase I, enzyme dégradant la L-arginine, privant ainsi les cellules immunitaires de cet acide aminé, dans les infiltrats tumoraux [6]. Par une série d’expériences élégantes, Pallet et al. ont montré que l’augmentation des gMDSC est associée à une accumulation de l’arginase I et à une diminution de la L-arginine sérique. A contrario, un ajout de L-arginine permet de supprimer les symptômes associés à la réplication virale (c’est-à-dire une diminution des transaminases sériques) [3]. Parallèlement, une corrélation inverse est observée entre le nombre de gMDSC et l’expression du récepteur CD3-ζ sur les cellules lymphocytaires T. Ce qui démontre, de façon indirecte, qu’une carence en L-arginine inhibe effectivement la fonction des lymphocytes T [3]. Par ailleurs, compensant la déplétion en L-arginine, une augmentation de l’expression de CD98 (transporteur neutre d’acides aminés) est observée sur les lymphocytes T CD8 hépatiques, ce qui permet d’améliorer le transport des acides aminés en défaut [3]. Dans ce contexte, il serait intéressant de tester in vitro, dans des expériences de co-culture avec les gMDSC, l’effet d’un inhibiteur de l’arginase I sur la fonction des lymphocytes T. En effet, si un inhibiteur de l’arginase I permet de restaurer les fonctions des lymphocytes T, un traitement pourrait alors être envisagé in vivo. Bien que les données obtenues semblent robustes, il ne faut pas oublier que les MDSC pourraient avoir d’autres fonctions aux niveaux sérique et hépatique lors de l’infection par le VHB. Une étude a en effet montré que les MDSC hépatiques pouvaient inhiber la production d’interféron gamma (IFN-γ) par les lymphocytes T et ainsi inhiber l’expression de CD40-L (le ligand de CD40) sur les lymphocytes [7]. Or, cette molécule participe à la formation de la synapse immunologique entre lymphocytes et cellules présentatrices d’antigènes. Elle est, en particulier, nécessaire au changement de la classe d’immunoglobuline [7].
De façon intrigante, Pallet et al. ont montré que l’inhibition immunitaire qu’ils avaient mise en évidence n’était pas spécifique des lymphocytes T dirigés contre le VHB mais qu’elle pouvait être également observée, in vitro, sur des lymphocytes T dirigés contre d’autres virus comme le virus d’Epstein-Barr ou le cytomégalovirus [3]. Si la carence en L-arginine entraînait une inhibition de tous les lymphocytes T activés, une immunodépression devrait donc être observée lors d’une hépatite B chronique. Or, le système immunitaire des patients infectés reste fonctionnel [8]. L’inhibition des lymphocytes T in vivo reste donc, au moins partiellement, spécifique des lymphocytes T dirigés contre le VHB, le mécanisme sous-jacent restant cependant à déterminer. La compréhension de ce(s) mécanisme(s) est donc nécessaire pour parvenir à induire une réactivation de la réponse T chez les patients chroniquement infectés.
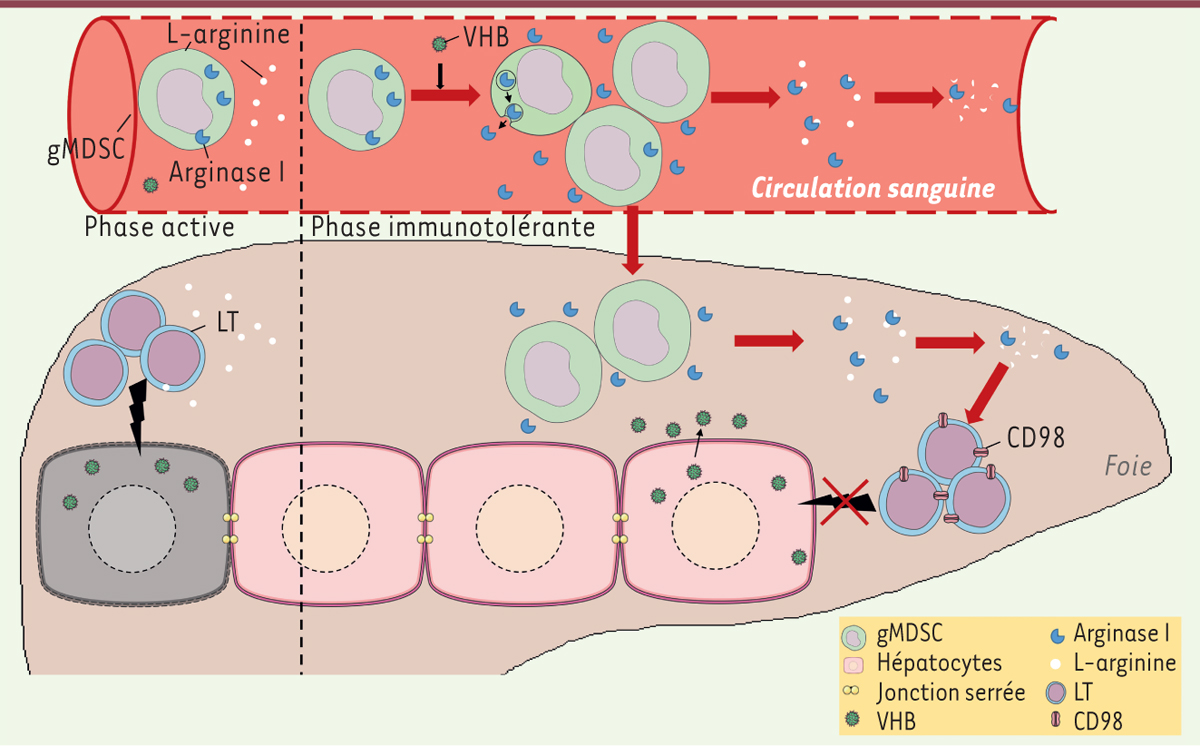
En conclusion, Pallet et al. ont montré que le nombre de gMDSC exprimant l’arginase I est accru lors d’une hépatite B chronique. Ceci entraîne une augmentation de l’arginase I sérique et hépatique, conduisant à une déplétion en L-arginine et donc à l’inhibition de l’activité des lymphocytes T (Figure 1). Ce travail a permis d’identifier une nouvelle population de cellules immunitaires impliquée dans la régulation des réponses immunitaires chez des patients chroniquement infectés par le VHB, les gMDSC, et d’expliquer un mécanisme d’inhibition de la réponse lymphocytaire T. Cette étude suggère que la phase d’immunotolérance est due à une inhibition forte des réponses inflammatoires plutôt qu’à une inaptitude du système immunitaire à induire une réponse T fonctionnelle. Or, le VHB a longtemps été considéré comme un virus silencieux [9] contre lequel aucune réponse immunitaire n’était mise en place puisque le système immunitaire du patient était supposément incapable de détecter ce virus. Depuis quelques années, de plus en plus d’études montrent que, plutôt que d’être un virus silencieux, le VHB peut mettre en place de nombreux mécanismes d’inhibition de l’immunité, à la fois innée et adaptative [10]. Les cellules immunitaires des patients infectés par le VHB seraient donc capables de détecter le virus et pourraient, en cas de levée de l’inhibition induite par le virus, mettre en place une réponse immunitaire efficace. Les données obtenues par Pallet et al. sont encourageantes pour le développement de thérapies innovantes visant la réactivation du système immunitaire chez les patients infectés.
| Figure 1.
Les gMDSC régulent l’immunopathogenèse liée au virus de l’hépatite B grâce à des changements métaboliques. En phase active, les lymphocytes T CD8 détruisent les cellules infectées. En phase immunotolérante, le VHB active la prolifération des gMDSC et les recrute dans le foie, conduisant à une augmentation des taux sérique et hépatique de l’arginase I. Cette augmentation a pour conséquence une déplétion en L-arginine, carençant les lymphocytes T en cet acide aminé, les rendant ainsi inactifs. En compensation, le niveau d’expression de CD98 augmente sur les lymphocytes T. gMDSC : granulocytic myeloid-derived supressor cells ; VHB : virus de l’hépatite B ; LT : lymphocyte T ; CD98 : transporteur neutre des acides aminés. |