| |
| Med Sci (Paris). 32(4): 317–319. doi: 10.1051/medsci/20163204002.Quand la migration de neurones signalisateurs contrôle la régionalisation du cortex cérébral Frédéric Causeret1** and Alessandra Pierani1* 1Institut Jacques Monod, CNRS UMR 7592, Université Paris Diderot, Sorbonne Paris Cité, 15, rue Hélène Brion, Paris, France MeSH keywords: Animaux, Plan d'organisation du corps, Mouvement cellulaire, Cortex cérébral, Facteurs chimiotactiques, Régulation de l'expression des gènes au cours du développement, Humains, Souris, Neurones, Tegmentum du mésencéphale, Synaptobrévine-3, génétique, physiologie, embryologie, croissance et développement, métabolisme, cytologie |
Régionalisation du cortex cérébral en aires fonctionnelles Au milieu du XIXe siècle, plusieurs études impliquant des patients atteints de lésions cérébrales ont permis d’imposer l’idée que le cortex cérébral, siège principal des fonctions cognitives, est une structure régionalisée. De nos jours, on distingue classiquement les aires corticales primaires, qui reçoivent les informations sensorielles et exécutent les commandes motrices, des aires d’ordre supérieur (secondaires et associatives)1 en charge de l’intégration et des fonctions cognitives. Au cours de l’évolution, ces aires d’ordre supérieur se sont développées de manière importante chez les primates, et plus particulièrement chez l’homme, au point d’occuper la majeure partie de la surface corticale. Inversement, chez d’autres mammifères comme la souris, ce sont les aires primaires qui occupent la plus grande partie du cortex cérébral. La compréhension des mécanismes de mise en place des différents territoires corticaux est donc centrale pour appréhender l’évolution particulière des fonctions cognitives chez l’homme. Jusqu’à présent, les mécanismes précis impliqués dans la mise en place des aires secondaires restaient relativement mal déterminés et se heurtaient notamment à leur taille réduite chez la souris. Récemment, un rôle des entrées sensorielles en provenance du thalamus (projections thalamo-corticales2,) a pu être mis en évidence à des stades post-nataux. Il a ainsi été proposé que ces projections thalamo-corticales déterminent la distinction entre aires primaires et secondaires dans le cortex visuel et somato-sensoriel3 [1, 2]. Cependant, il restait à déterminer si les aires d’ordre supérieur étaient spécifiées plus précocement, au cours de l’embryogenèse, ou si elles correspondaient simplement aux champs corticaux laissés libres par les aires primaires. À l’inverse, les mécanismes de mise en place des aires primaires sont relativement bien établis. Il a été montré que le cortex se régionalise tôt au cours du développement embryonnaire, sous l’influence de gradients de morphogènes (appartenant notamment aux familles Fgf [fibroblast growth factor], Wnt [Wingless-related integration site], BMP [bone morphogenetic protein]) qui diffusent à partir de centres signalisateurs. Ces morphogènes régulent l’expression de facteurs de transcription par les progéniteurs corticaux et déterminent ainsi le positionnement et la taille des aires sensorielles et motrices [3]. Cependant, l’implication exclusive de signaux diffusant à partir d’une source focale apparaît difficilement compatible avec l’augmentation de la taille du cortex au cours de l’évolution des mammifères [4]. |
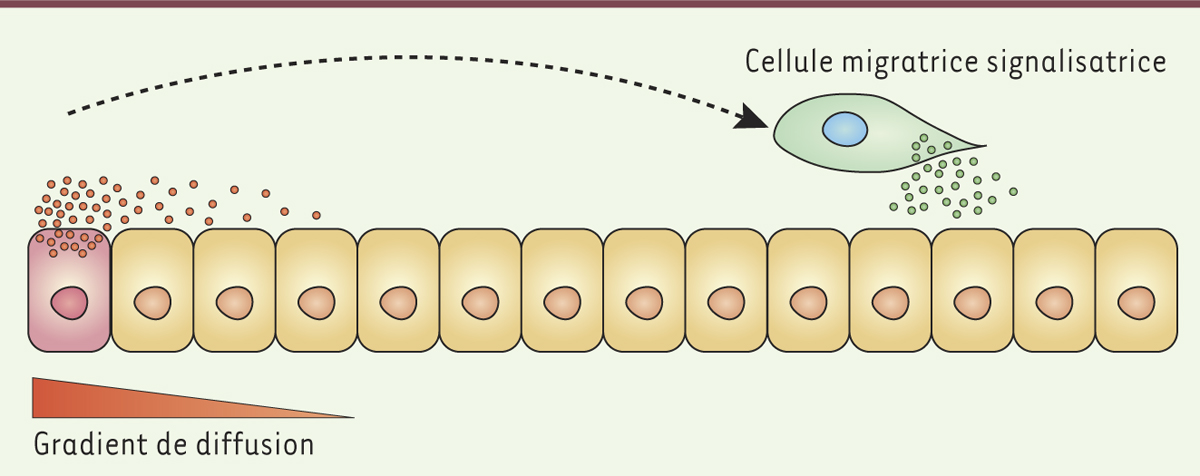
Cellules de Cajal-Retzius et signalisation à longue distance Notre laboratoire a mis en évidence l’existence de mécanismes alternatifs de signalisation à longue distance impliqués dans la mise en place des aires corticales. Nous avons introduit le concept de « cellules migratrices signalisatrices » (Figure 1) [5] en démontrant le rôle des cellules de Cajal-Retzius au cours de la régionalisation précoce du cortex et la formation des aires primaires [6].
 | Figure 1.
Concept de « cellule migratrice signalisatrice ». Le patterning (ou régionalisation) à longue distance fait typiquement intervenir des facteurs capables de diffuser dans le milieu extracellulaire à partir d’une source fixe (cellule sécrétrice, en rose). La formation d’un gradient de diffusion autour de la source limite la distance sur laquelle le signal peut se propager. Le concept de « cellule migratrice signalisatrice » fait intervenir une source mobile (cellule en migration, en vert) qui permet de convoyer un signal sur de longues distances. |
Les cellules de Cajal-Retzius sont parmi les premiers neurones produits au cours du développement cortical. On en distingue au moins trois sous-populations qui migrent tangentiellement à partir de trois sources situées aux bords du cortex pour finalement recouvrir toute sa surface (Figure 2) [7–9]. Des mécanismes de répulsion entre cellules de Cajal-Retzius permettent d’assurer une distribution stéréotypée de chaque sous-population [6, 10]. Les cellules de Cajal-Retzius expriment des morphogènes et sont ainsi capables d’influencer les propriétés de prolifération des progéniteurs corticaux au-dessus desquels elles migrent [6]. Chaque sous-population de cellules de Cajal-Retzius dispose de son propre répertoire de morphogènes, suggérant qu’elles disposent de propriétés signalisatrices distinctes.
 | Figure 2.
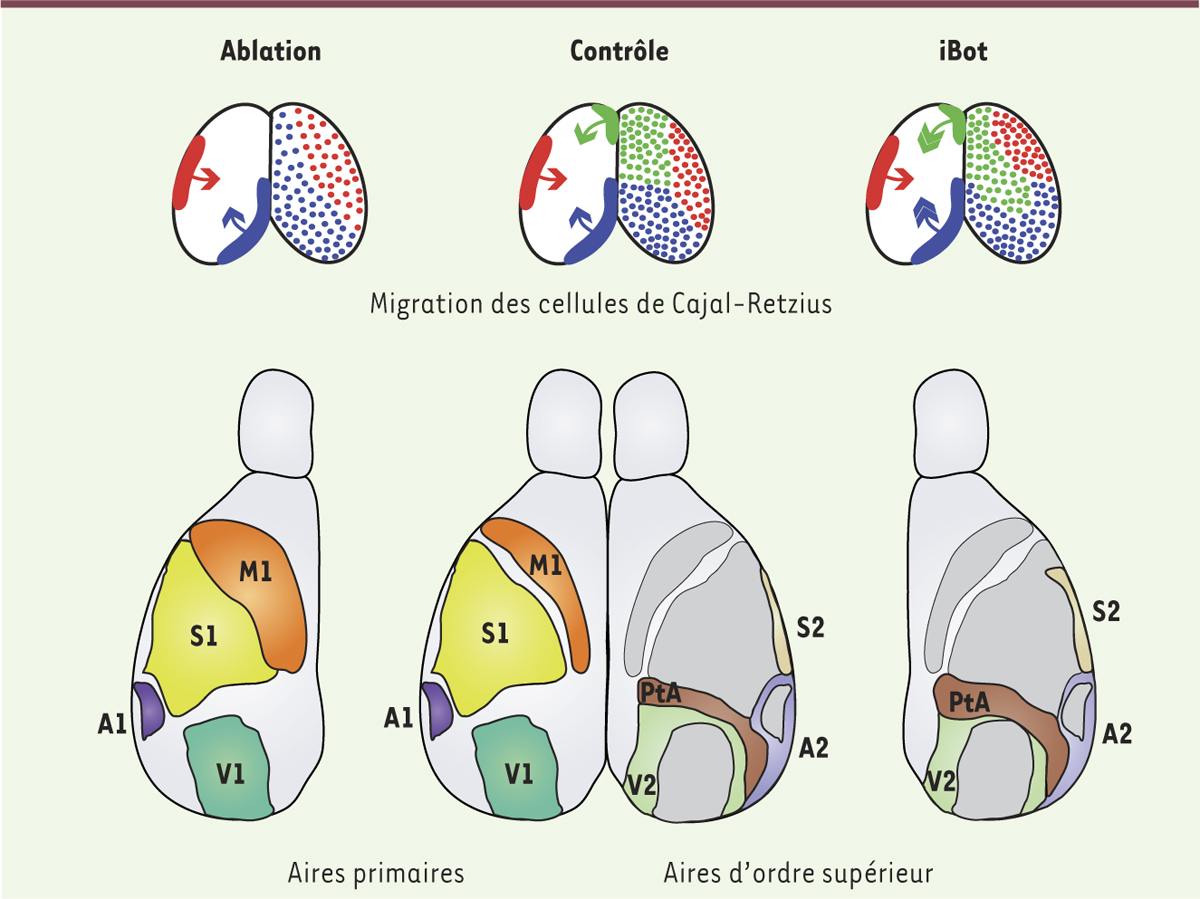
Cellules de Cajal-Retzius et mise en place des aires corticales. Au cours du développement embryonnaire (en haut), trois sous-populations distinctes de cellules de Cajal-Retzius (rouge, bleu, vert) migrent tangentiellement pour couvrir la surface corticale (contrôle). L’ablation d’une sous-population (à gauche) aboutit à la redistribution des deux autres. La perturbation des cinétiques de migration (mutant iBot, à droite) affecte la répartition finale sans modification du nombre total de cellules de Cajal-Retzius. À un stade post-natal (en bas), l’ablation se traduit par des défauts de mise en place des aires primaires tandis que chez les mutants iBot, ce sont les aires d’ordre supérieur qui sont affectées. Aires primaires : motrice (M1), somato-sensorielle (S1), auditive (A1), visuelle (V1). Aires d’ordre supérieur : somato-sensorielle secondaire (S2), auditive secondaire (A2), visuelle secondaire (V2), pariétale associative (PtA). |
|
Cellules de Cajal-Retzius et mise en place des aires corticales Une étude récente menée au sein de notre laboratoire [11] indique que les différentes sous-populations de cellules de Cajal-Retzius n’ont pas les mêmes cinétiques de migration, ce qui détermine leur répartition spécifique à la surface du cortex en développement. Des approches de vidéo-microscopie et des simulations mathématiques nous ont permis de déterminer que la vitesse et la directionalité sont des paramètres essentiels pour la distribution finale de chaque sous-population. Nous avons analysé le transcriptome des différents sous-types de cellules de Cajal-Retzius afin d’identifier les molécules responsables des différences de capacité migratoire. Nous avons ainsi mis en évidence que la protéine VAMP3 (vesicle-associated membrane protein 3), précédemment impliquée dans le trafic vésiculaire [12] (→) mais dont la fonction était considérée comme restreinte aux cellules non-neuronales du cerveau mature, est exprimée de manière différentielle par les sous-populations de cellules de Cajal-Retzius.
(→) Voir la Nouvelle de V. Proux-Gillardeaux et T. Galli, m/s n° 10 octobre 2005, page 789
Afin de tester l’implication de VAMP3 dans la migration des cellules de Cajal-Retzius, nous avons utilisé deux modèles murins : (1) une lignée de souris transgénique (iBot) exprimant de manière conditionnelle, et uniquement dans les cellules de Cajal-Retzius, un fragment de la toxine botulinique qui clive et inactive VAMP3 ; et (2) une lignée de souris mutantes (knock out) pour Vamp3. Dans les deux cas, la perte de fonction de VAMP3 s’est traduite par une modification de la vitesse de migration des cellules de Cajal-Retzius et, par voie de conséquence, par une redistribution des différentes sous-populations à la surface du cortex cérébral. Ainsi, dans ces deux modèles murins, un sous-type de cellules de Cajal-Retzius peut envahir un territoire cortical dont il est normalement exclu par une autre sous-population. Cette redistribution modifie l’exposition des différents territoires corticaux aux signaux sécrétés spécifiquement par chaque sous-population de cellules de Cajal-Retzius. Dans une étude précédente [6], nous avons montré que l’ablation génétique d’une des trois sous-populations de cellules de Cajal-Retzius se traduit par une redistribution des deux autres et s’accompagne de défauts de régionalisation précoce du cortex cérébral. À des stades post-natals, cela se traduit par un changement de la taille et de la position des aires primaires (Figure 2). Nous avons cherché à savoir si les mutants iBot et KO Vamp3 présentaient de tels défauts. À la différence de l’ablation génétique, les modèles de perte de fonction de VAMP3 affectent uniquement la distribution et non le nombre total de cellules de Cajal-Retzius. L’analyse de la régionalisation précoce du cortex chez ces animaux n’a révélé aucun défaut. À des stades plus tardifs, le positionnement et la taille des aires primaires ne se sont pas non plus révélés aberrants. En revanche, nous avons pu mesurer chez les mutants iBot et KO Vamp3 une extension des aires associatives pariétales au dépend des aires secondaires voisines (visuelles et auditives). De plus, les mutants iBot présentent une extension importante de l’aire somato-sensorielle secondaire. Ainsi, une altération de la distribution des cellules de Cajal-Retzius (sans modification de leur nombre) à la surface du cortex cérébral en développement aboutit à un changement de taille des aires d’ordre supérieur (Figure 2). Il apparaît donc que la mise en place des aires associatives et secondaires s’initie dès les stades précoces de la corticogenèse, sous l’influence de signaux produits par les cellules de Cajal-Retzius. |
Notre travail apporte un éclairage nouveau sur la compréhension des mécanismes de régionalisation du cortex cérébral et en particulier de formation des aires d’ordre supérieur. Il pose aussi de nouvelles questions, en particulier concernant les mécanismes moléculaires liant trafic vésiculaire (dont VAMP3 est un acteur majeur) et migration. Les signaux dérivés des cellules de Cajal-Retzius impliqués dans la corticogenèse restent également à déterminer. Enfin, nos résultats suggèrent que la contribution de « cellules migratrices signalisatrices » au patterning (c’est-à-dire à la régionalisation) à longue distance est peut-être plus importante qu’envisagée. Ils ouvrent ainsi la possibilité intéressante qu’un contrôle strict de la cinétique migratoire des sous-populations de cellules de Cajal-Retzius contribue à l’augmentation de la taille des territoires corticaux dédiés aux fonctions cognitives et à l’évolution de la connectivité corticale. |
Les auteurs déclarent n’avoir aucun conflit d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Chou SJ, Babot Z, Leingärtner A, et al. Geniculocortical input drives genetic distinctions between primary and higher-order visual areas . Science. 2013; ; 340 : :1239.–1242. 2.
Pouchelon G, Gambino F, Bellone C, et al. Modality-specific thalamocortical inputs instruct the identity of postsynaptic L4 neurons . Nature. 2014; ; 511 : :471.–474. 3.
O’Leary DD, Sahara S. Genetic regulation of arealization of the neocortex . Curr Opin Neurobiol. 2008; ; 18 : :90.–100. 4.
Arai Y, Pierani A. Development and evolution of cortical fields . Neurosci Res. 2014; ; 86 : :66.–76. 5.
Borello U, Pierani A. Patterning the cerebral cortex : traveling with morphogens . Curr Opin Genet Dev. 2010; ; 20 : :408.–415. 6.
Griveau A, Borello U, Causeret F, et al. A novel role for Dbx1-derived Cajal-Retzius cells in early regionalization of the cerebral cortical neuroepithelium . PLoS Biol. 2010; ; 8 : :e1000440.. 7.
Takiguchi-Hayashi K, Sekiguchi M, Ashigaki S, et al. Generation of reelin-positive marginal zone cells from the caudomedial wall of telencephalic vesicles . J Neurosci. 2004; ; 24 : :2286.–2295. 8.
Bielle F, Griveau A, Narboux-Nême N, et al. Multiple origins of Cajal-Retzius cells at the borders of the developing pallium . Nat Neurosci. 2005; ; 8 : :1002.–1012. 9.
Yoshida M, Assimacopoulos S, Jones KR, Grove EA. Massive loss of Cajal-Retzius cells does not disrupt neocortical layer order . Development. 2006; ; 133 : :537.–545. 10.
Villar-Cerviño V, Molano-Mazón M, Catchpole T, et al. Contact repulsion controls the dispersion and final distribution of Cajal-Retzius cells . Neuron. 2013; ; 77 : :457.–471. 11.
Barber M, Arai Y, Morishita Y, et al. Migration speed of Cajal-Retzius cells modulated by vesicular trafficking controls the size of higher-order cortical areas . Curr Biol. 2015; ; 25 : :2466.–2478. 12.
Proux-Gillardeaux V, Galli T. Rôle du trafic membranaire dans la migration cellulaire : une nouvelle application pour les neurotoxines clostridiales ? Med Sci (Paris). 2005; ; 21 : :789.–790. |