| |
| Med Sci (Paris). 32(4): 339–342. doi: 10.1051/medsci/20163204009.Rôles antitumoraux de l’inhibition de l’autophagie dans le cancer colorectal Le microbiote intestinal et le système immunitaire viennent à la rescousse Jonathan Lévy1 and Béatrice Romagnolo1* 1Institut Cochin, Inserm U1016, CNRS UMR8104, Université Paris Descartes, 24, rue du faubourg Saint-Jacques, 75014Paris, France MeSH keywords: Animaux, Autophagie, Protéine-7 associée à l'autophagie, Tumeurs colorectales, Modèles animaux de maladie humaine, Évolution de la maladie, Régulation négative, Microbiome gastro-intestinal, Gènes APC, Humains, Système immunitaire, Souris, Souris transgéniques, génétique, immunologie, microbiologie, anatomopathologie, physiologie |
L’autophagie est un processus d’autocannibalisme permettant la dégradation via les lysosomes, des constituants cellulaires endommagés ou non essentiels [1]. Il s’agit du principal mécanisme physiologique participant au catabolisme de macromolécules (protéines, lipides, carbohydrates, etc.) et à la dégradation d’organelles (mitochondries, réticulum endoplasmique). Ce processus implique la formation de vésicules, les autophagosomes, faisant intervenir un ensemble de protéines codées par les gènes ATG (autophagy related genes) [1] (→).
(→) Voir la Nouvelle de P. Codogno, m/s n° 8-9, août-septembre 2004, page 734
Récemment, un rôle de l’autophagie en tant que médiateur de réponses pathologiques a été mis en évidence, en particulier dans le cancer [2]. Plusieurs études suggèrent un rôle complexe de l’autophagie dans le cancer. L’autophagie est en effet apparue comme un facteur de survie des cellules cancéreuses qui est essentiel dans les cancers pancréatique et mammaire. Son inhibition s’accompagne en revanche, du développement spontané de lymphomes, d’adénocarcinomes pulmonaires et hépatiques. Ces travaux soulignent donc le rôle ambivalent que présente l’autophagie dans le cancer selon les tissus considérés, le contexte génétique ou le stade auquel l’analyse est réalisée. Notre équipe s’est intéressée au rôle de l’autophagie dans le cancer colorectal. Nous avons entrepris cette étude à partir d’échantillons de cancer coliques humains et dans un modèle murin présentant une mutation du gène suppresseur de tumeur APC (adenomatous polyposis coli). De manière parfaitement concordante, nos études, confirmées et étendues par d’autres équipes, ont montré que, chez la souris, la perte du gène APC entraînait la formation de multiples adénomes intestinaux [3]. Ce modèle murin représente donc un modèle préclinique de choix pour appréhender les mécanismes associés au développement tumoral intestinal. Chez l’homme, la mutation du gène APC est responsable de plus 80 % des cancers colorectaux sporadiques ainsi que de la polypose adénomateuse familiale1,. L’observation d’une augmentation de la transcription de différents gènes de l’autophagie (ATG) au cours de la progression tumorale dans la dysplasie2, les adénomes murins intestinaux et les cancers coliques humains, a été le point de départ de notre recherche sur l’autophagie. Nous avons par la suite mis en évidence la surexpression de la protéine LC3 (microtubule-associated protein 1A/1B-light chain 3) conjuguée au phosphatidylétanomaline (LC3-II), marqueur de l’autophagosome, conjointement à la diminution de la protéine p62 (aussi appelée sequestosome-1), une protéine cible de l’autophagie. La preuve ultime de l’induction de l’autophagie au cours du développement tumoral a été apportée par des analyses de microscopie électronique. Elles ont permis de révéler la présence d’autophagosomes et d’autophagolysosomes au sein des cellules tumorales intestinales. |
Le blocage de l’autophagie supprime le développement tumoral Nous avons étudié le rôle de l’induction de l’autophagie dans le cancer colique en examinant le développement tumoral chez des souris invalidées pour le gène APC (les souris APC+/-) et n’exprimant pas, au sein des cellules épithéliales, le gène autophagique essentiel ATG7 (ATG7-/-) [4]. Un suivi échographique du développement tumoral colique chez ces animaux a montré que le blocage de l’autophagie permet à la fois d’inhiber l’initiation mais également la progression tumorale. Les souris APC+/-
ATG7-/- développent en effet peu ou pas de tumeur et leur croissance tumorale est nettement ralentie par rapport à celle observée dans les souris APC+/- qui expriment le gène ATG7. Nous avons montré que l’inhibition de l’autophagie dans la cellule tumorale entraîne une diminution de la prolifération cellulaire qui est associée à l’induction de la protéine p53, connue pour jouer un rôle fondamental dans la suppression tumorale [5] (→).
(→) Voir la Synthèse de O. Albagli, m/s n° 10, octobre 2015, page 869
De plus, parallèlement à l’induction de p21, une protéine responsable de l’arrêt du cycle cellulaire, les cellules tumorales déficientes en autophagie présentent également une diminution de l’expression des enzymes de la glycolyse et une activation du senseur énergétique AMPK (AMP-activated protein kinase) (Figure 1). Ainsi, en altérant des cibles de la glycolyse, l’inhibition de l’autophagie pourrait conduire non seulement à une modification du métabolisme énergétique mais également à une diminution de la production de biomasse pouvant participer à la suppression tumorale. L’implication de p53 sur les cibles métaboliques dans ce contexte, reste cependant à démontrer.
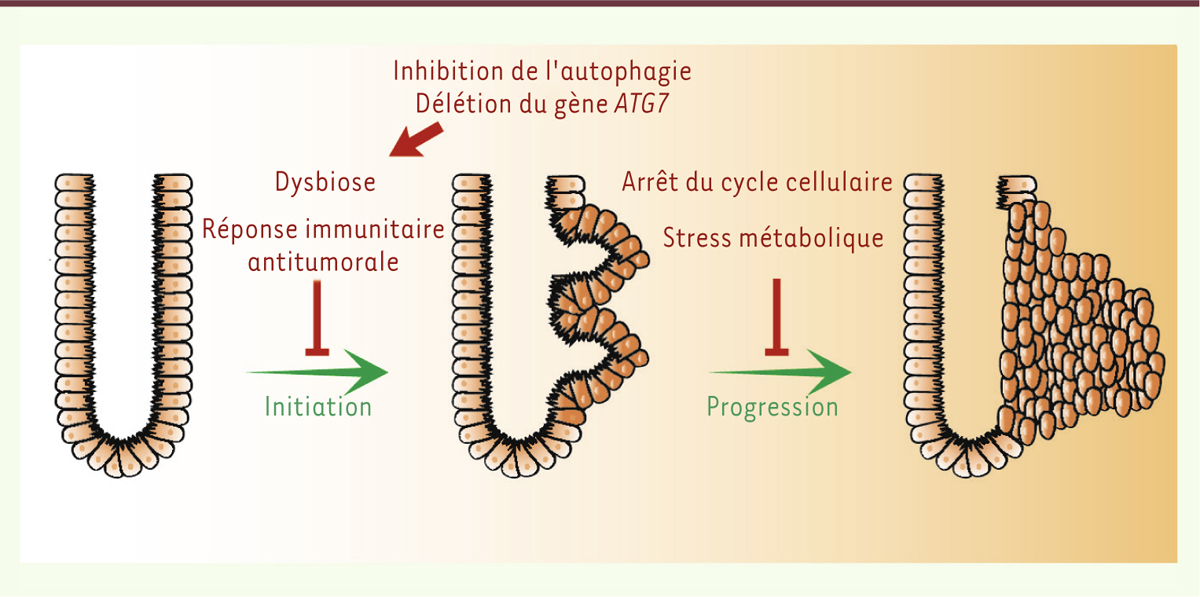
 | Figure 1.
Rôles antitumoraux de l’inhibition de l’autophagie dans la tumorigenèse intestinale. La délétion conditionnelle et inductible du gène ATG7 dans les cellules épithéliales intestinales diminue l’initiation et la progression tumorale intestinale liée à la perte du gène APC. L’inhibition de l’autophagie conduit à une modification de la flore intestinale responsable d’une réponse immunitaire antitumorale. De plus, le blocage de l’autophagie dans la cellule tumorale conduit à un arrêt du cycle cellulaire et un stress métabolique caractérisé par une accumulation de p53, une diminution des enzymes de la glycolyse et une activation de l’AMPK. APC : adenomatous polyposis coli ; ATG7 : autophagy related gene 7. |
|
L’inhibition de l’autophagie dans la cellule épithéliale induit une réponse immunitaire antitumorale Au-delà de son implication dans la progression tumorale, l’invalidation conditionnelle du gène ATG7 s’accompagne d’une impressionnante diminution de la survenue des lésions tumorales résultant de la perte du gène APC. L’identification de signatures immunitaires nous a permis d’identifier les mécanismes antitumoraux provoqués par le blocage de l’autophagie au sein des cellules épithéliales. En collaboration avec l’équipe de Jean-Pierre Couty, nous avons en effet analysé la muqueuse saine des souris APC+/-ATG7-/-, avant l’émergence des tumeurs liées à la perte sporadique du second allèle du gène APC. Ces études ont révélé une activation d’interféron de type I, connu pour jouer un rôle clé dans la réponse antitumorale, ainsi qu’une production d’IL(interleukine)-12 accompagnée d’une infiltration de lymphocytes T CD8+ cytotoxiques, T CD4 de type Th1 et T régulateurs. Associée à cette infiltration, nous avons observé une surexpression des chimiokines CX3CL1 (chemokine [C-X3-C motif] ligand 1 ou fractalkine), CXCL9 (chemokine [C-X-C motif] ligand) et CXCL10. De façon intéressante, chez l’homme, ce profil immunitaire d’infiltration est corrélé à une survie sans récidive prolongée et à un accroissement de la survie globale des patients atteints de tumeurs colorectales [6]. Ces premiers résultats laissaient supposer que l’effet antitumoral observé après l’inhibition de l’autophagie pouvait être relié à une réponse immunitaire antitumorale. Cette hypothèse a été confortée par le fait que l’administration d’anticorps anti-CD8 (dirigés contre les lymphocytes T CD8+ cytotoxiques) permet d’annihiler l’effet antitumoral. |
La flore intestinale agit directement sur le microenvironnement immunitaire Afin de déterminer le mécanisme par lequel l’inhibition de l’autophagie dans la cellule épithéliale altère le microenvironnement immunitaire, nous avons évalué son effet direct sur la cellule épithéliale. Nous avons pu observer que la perte du gène ATG7 altère la différenciation des cellules de Paneth3 [7] (→) et des cellules caliciformes4, deux types de cellules sécrétrices constitutives de l’épithélium intestinal et jouant un rôle fondamental dans la défense antimicrobienne. Les défauts de sécrétion par ces cellules ainsi engendrés sont associés à une augmentation de la perméabilité de la barrière intestinale et à une translocation de certaines bactéries au travers de l’épithélium (pour lequel l’autophagie est inhibée). En collaboration avec Mathias Chamaillard et Patricia Lepage, nous avons pu, de plus, démontrer que ces modifications sont associées à un changement qualitatif et quantitatif de la flore bactérienne qui se caractérise par une surabondance de bactéries Gram+, principalement des Firmicutes et une faible abondance de Proteobacteria [12] (→).
(→) Voir la Nouvelle de B. Romagnolo, m/s n° 12, décembre 2012, page 1058
(→) Voir la Synthèse de J. Raisch et al., m/s n° 2, février 2016, page 175
Afin de déterminer le rôle de la flore dans l’induction de la réponse immunitaire antitumorale associée à l’inhibition de l’autophagie, nous avons administré, par voie orale, aux souris APC+/-
ATG7-/-, une combinaison d’antibiotiques à spectre large. Ce traitement conduit à une abolition de l’expression des cytokines ainsi que de l’infiltration des lymphocytes T CD3, en particulier des lymphocytes T CD8+ cytotoxique. L’effet anticancéreux, relayé par l’inhibition de l’autophagie, est donc absent, ce qui se traduit chez les souris APC+/-ATG7-/- alors dépourvues de flore, par l’apparition de nombreuses lésions. Cette étude souligne l’interaction complexe qui existe entre la flore intestinale, la réponse antitumorale et l’inhibition de l’autophagie [4] (Figure 1). Il reste désormais à déterminer si ce triumvirat est nécessaire à la suppression tumorale ou si une modification de la flore est suffisante pour imposer cette suppression. Les mécanismes par lesquels les bactéries commensales peuvent avoir un effet sur le microenvironnement immunitaire antitumoral restent à définir. Néanmoins, notre étude conforte les données illustrant le rôle clé du microbiote dans la réponse à différentes thérapies antitumorales. Le microbiote pourrait être un marqueur prédictif de la réponse thérapeutique bloquant les molécules de costimulation inhibitrices anti-CTLA-4 (cytotoxic T-lymphocyte-associated protein 4) et anti-PD-1 (programmed cell death 1) [8–11]. |
L’ensemble de ces résultats montre pour la première fois que l’inhibition de l’autophagie dans la cellule épithéliale permettrait d’empêcher le développement d’un cancer colorectal d’un patient à risque. Nos résultats ouvrent également de nouvelles perspectives pour le traitement des cancers colorectaux et soulignent particulièrement l’importance du microbiote dans la mise en place d’une réponse antitumorale. |
Les auteurs déclarent n’avoir aucun conflit d’intérêt concernant les données publiées dans cet article.
|
Ce travail a été soutenu financièrement par l’Inserm, l’Institut National du Cancer, le Comité de Paris de la Ligue Contre le Cancer, la Fondation Arc, et par le Cancer Research Personalized Medicine (CARPEM).
|
Footnotes |
1.
Codogno P. Les gènes ATG et la macro-autophagie . Med Sci (Paris). 2004; ; 20 : :734.–736. 2.
Galluzzi L, Pietrocola F, Bravo-San Pedro JM, et al. Autophagy in malignant transformation and cancer progression . Embo J. 2015; ; 34 : :856.–880. 3.
Zeineldin M, Neufeld KL More than two decades of Apc modeling in rodents . Biochim Biophys Acta. 2013; ; 1836 : :80.–89. 4.
Levy J, Cacheux W, Bara MA, et al. Intestinal inhibition of Atg7 prevents tumour initiation through a microbiome-influenced immune response and suppresses tumour growth . Nat Cell Biol. 2015; ; 17 : :1062.–1073. 5.
Albagli O. Protéger et sévir : p53, métabolisme et suppression tumorale . Med Sci (Paris). 2015; ; 31 : :869.–880. 6.
Tosolini M, Kirilovsky A, Mlecnik B, et al. Clinical impact of different classes of infiltrating T cytotoxic and helper cells (Th1, th2, treg, th17) in patients with colorectal cancer . Cancer Res. 2011; ; 71 : :1263.–1271. 7.
Romagnolo B. Une relation Paneth entre cellules souches et niche intestinale . Med Sci (Paris). 2012; ; 28 : :1058.–1060. 8.
Viaud S, Saccheri F, Mignot G, et al. The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide . Science. 2013; ; 342 : :971.–976. 9.
Iida N, Dzutsev A, Stewart CA, et al. Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment . Science. 2013; ; 342 : :967.–970. 10.
Vetizou M, Pitt JM, Daillere R, et al. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota . Science. 2015; ; 350 : :1079.–1084. 11.
Sivan A, Corrales L, Hubert N, et al. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy . Science. 2015; ; 350 : :1084.–1089. 12.
Raisch J, Dalmasso G, Bonnet R, et al. Certaines bactéries de la flore commensale exacerberaient-elles la carcinogenèse colorectale ? Med Sci (Paris). 2016; ; 32 : :175.–182. |