| |
| Med Sci (Paris). 32(4): 342–344. doi: 10.1051/medsci/20163204010.La taille de l’axone est un facteur majeur influençant la dépense énergétique et la vulnérabilité des neurones dopaminergiques dans la maladie de Parkinson Nicolas Giguère1** and Louis-Éric Trudeau1* 1Départements de Pharmacologie et de Neurosciences, groupe de recherche sur le système nerveux central (GRSNC), faculté de médicine, université de Montréal, CP 6128, succursale centre-ville, Montréal QC, H3C 3J7Québec, Canada MeSH keywords: Animaux, Axones, Taille de la cellule, Survie cellulaire, Cellules cultivées, Neurones dopaminergiques, Métabolisme énergétique, Humains, Plasticité neuronale, Maladie de Parkinson, anatomopathologie, physiologie, métabolisme |
La maladie de Parkinson est la seconde maladie neurodégénérative la plus commune au niveau mondial, touchant 1 % des personnes âgées de 60 ans et plus [1]. Cette maladie est caractérisée, entre autres, par des troubles moteurs comprenant une lenteur des mouvements, de la rigidité, une instabilité posturale et des tremblements. Ces troubles moteurs sont causés par la mort des neurones dopaminergiques [2] (→) de la substance noire compacte (SNc), une région située dans le mésencéphale. Malheureusement, lors de l’apparition de ces troubles du mouvement, une majorité de ces neurones a déjà dégénéré. Les raisons de cette dégénérescence restent à ce jour méconnues, ce qui explique en partie l’absence de traitement curatif.
(→) Voir la Synthèse de D. Thibault et al., m/s n° 2, février 2010, page 165
|
Plusieurs pistes sur la pathogenèse de cette maladie suggèrent que la mort des neurones de la SNc découle de la neuroinflammation, d’altérations dans les mécanismes de dégradation protéique, d’accumulation de protéines mal repliées ou d’altérations dans la fonction mitochondriale [3]. À titre d’exemple, plusieurs mutations dans des gènes incluant LRRK2 (leucine-rich repeat kinase 2), l’α-synucléine, Parkin, Pink1 (PTEN [phosphatase and tensin homo-log]-induced putative kinase 1) ou DJ-1, ont été identifiées comme causes de certaines formes familiales de la maladie de Parkinson. Bien que le rôle exact de plusieurs de ces protéines soit méconnu, elles semblent toutes influencer à un certain niveau la fonction mitochondriale et réguler des mécanismes comme l’autophagie, la mitophagie, le transport axonal et la fonction synaptique. Qu’une dysfonction de mécanismes cellulaires aussi ubiquitaires cause une mort sélective de sous-groupes limités de neurones, incluant les neurones de la SNc, reste un des principaux mystères de la maladie de Parkinson. |
Caractéristiques bioénergétiques particulières des neurones dopaminergiques de la SNc Une hypothèse pouvant potentiellement expliquer la grande vulnérabilité des neurones dopaminergiques de la SNc face à une dysfonction mitochondriale, serait que ces neurones possèdent des propriétés bioénergétiques qui les distinguent des neurones moins vulnérables. à ce jour, aucune étude n’avait évalué cette possibilité directement. Récemment [4], nous avons comparé, dans un modèle de culture primaire, la fonction mitochondriale des neurones dopaminergiques de la SNc à celle des neurones dopaminergiques de l’aire tegmentaire ventrale (VTA), une région voisine dans le mésencéphale, qui est peu affectée dans la maladie de Parkinson. Nous avons démontré qu’en plus d’avoir un niveau de base de phosphorylation oxydative deux fois plus élevé, les neurones dopaminergiques de la SNc ont une capacité énergétique de réserve qui est de 50 % inférieure à celle des neurones dopaminergiques de la VTA. Cela pourrait être un facteur majeur les rendant plus vulnérables à divers stress oxydatifs, malgré une densité plus importante de mitochondries au niveau axonal et une production accrue d’ATP. Cette marge de manœuvre énergétique limitée, couplée à la présence plus importante de dérivés réactifs de l’oxygène (ROS) au niveau axonal, pourrait alors expliquer la vulnérabilité sélective de ces neurones dans le contexte de la maladie de Parkinson. Une production accrue ou une élimination déficiente de ces dérivés réactifs de l’oxygène avec l’âge, ou dans divers contextes de stress environnemental ou génétique, pourraient être une des causes de la maladie. Toutefois, les raisons des besoins énergétiques décuplés des neurones dopaminergiques de la SNc restent nébuleuses. |
Les canaux calciques de type L Une hypothèse récente [5] propose que la demande énergétique élevée et la vulnérabilité accrue des neurones dopaminergiques de la SNc puissent être expliquées par le fait que ces neurones déchargent (c’est-à-dire qu’ils émettent des potentiels d’action) de façon autonome (décharge de type « pacemaker »). Ce type de décharge serait associé à une élévation cyclique importante des niveaux de calcium intracellulaire dans le compartiment somatodendritique de ces neurones, une propriété qui dépend de la présence de canaux calciques voltage-dépendants de type L1 de la famille Cav1.3. Ces canaux seraient moins abondants dans les neurones dopaminergiques de la VTA. Cet influx calcique répété, causé par la décharge pacemaker, pourrait être associé avec une demande énergétique et un stress oxydatif accrus [6]. Cette hypothèse a récemment été soutenue par certains travaux montrant qu’un bloqueur de ce type de canaux diminue la dépense énergétique des neurones de la SNc et s’avère neuroprotecteur sous certaines conditions, dans différents modèles [4, 7]. Cependant, elle n’explique pas complètement la différence entre les neurones dopaminergiques de la SNc et de la VTA d’un point de vue bioénergétique, puisque leur phosphorylation oxydative de base reste différente, même après blocage des canaux de type L. Il faut donc conclure que la demande énergétique supérieure des neurones dopaminergiques de la SNc est certainement secondaire à d’autres caractéristiques fondamentales particulières de cette population neuronale. |
Les neurones dopaminergiques de la SNc sont dotés d’une arborisation axonale massive Une des principales causes des besoins énergétiques élevés des neurones de la SNc pourrait être le fait qu’ils sont dotés d’une arborisation axonale de taille particulièrement imposante. Il a récemment été estimé que les neurones dopaminergiques de la SNc pourraient posséder jusqu’à plus de 100 000 terminaisons chez la souris et jusqu’à un million chez l’humain [8]. Ceci pourrait représenter, par neurone, près de 4,5 mètres d’arborisation axonale bout à bout [8]. Selon un récent modèle computationnel [9], l’énergie nécessaire au transport axonal, à la transmission des potentiels d’action le long de l’axone et au fonctionnement des terminaisons axonales croît de façon exponentielle avec la taille de l’axone. En conséquence, le maintien de mitochondries fonctionnelles et la production d’énergie nécessaire au fonctionnement d’une structure aussi complexe imposent certainement un lourd fardeau énergétique à ces neurones de la SNc. Dans le contexte de ce modèle, les neurones dopaminergiques de la VTA pourraient être moins vulnérables dans la maladie de Parkinson s’il s’avérait qu’ils possèdent une arborisation axonale moins élaborée et des besoins énergétiques plus modestes. Toutefois, cette hypothèse souffre d’un manque flagrant de données empiriques pour appuyer le modèle. En effet, aucune comparaison directe n’avait jusqu’à présent été effectuée entre l’arborisation axonale des neurones dopaminergiques de la SNc et de la VTA. Dans notre récente étude [4], réalisée à l’aide d’un modèle de neurones en culture primaire, nous avons démontré que l’axone des neurones dopaminergiques de la SNc est doté d’une arborisation axonale de taille 2 fois plus grande que celle des neurones dopaminergiques de la VTA, sans changement observable au niveau des dendrites. Parallèlement, nous avons démontré que l’inhibition de la décharge des neurones de la SNc par un bloqueur de canaux sodiques réduit la phosphorylation oxydative dans ces neurones à un niveau comparable à celui des neurones de la VTA. Ces données suggèrent que la différence énergétique entre ces deux types de neurones réside principalement dans les besoins énergétiques accrus associés à un axone plus complexe et à un nombre de terminaisons axonales plus grand chez les neurones de la SNc. En plus d’appuyer l’hypothèse d’une vulnérabilité élevée causée par une demande énergétique augmentée par la taille de l’axone, ces données suggèrent que la croissance accrue de l’axone des neurones dopaminergiques de la SNc est une caractéristique intrinsèque de ces neurones qui est maintenue in vitro, même en l’absence de cellules cibles. Une question fondamentale est de savoir s’il existe une relation de cause à effet entre une arborisation axonale de grande taille, une dépense énergétique élevée et une vulnérabilité accrue. Jusqu’à récemment, aucune étude n’avait abordé cette question importante. |
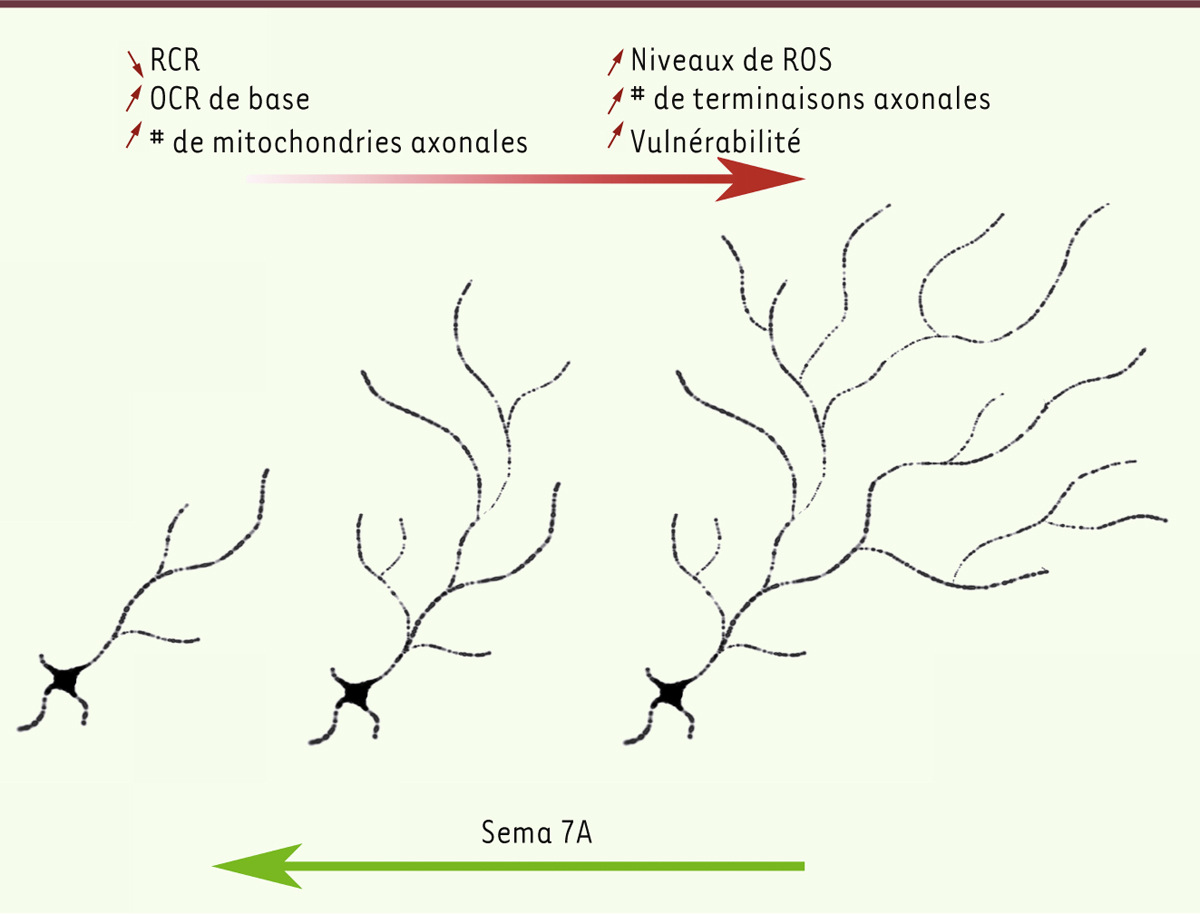
La taille de l’arborisation axonale, facteur important pour la demande énergétique et la vulnérabilité accrue des neurones dopaminergiques de la SNc Dans notre étude [4], nous avons découvert qu’un traitement avec la sémaphorine 7A, un facteur de guidage axonal, est en mesure de réduire de 50 % la taille de l’arborisation axonale des neurones dopaminergiques de la SNc, sans avoir d’effet sur la taille de leurs dendrites. Parallèlement, nous avons observé une diminution proportionnelle de la dépense énergétique de base, illustrée par une baisse des niveaux basaux de phosphorylation oxydative et une augmentation importante des capacités énergétiques de réserve de ces neurones. La sémaphorine 7A n’a cependant eu aucun effet sur l’arborisation axonale ou la dépense énergétique des neurones dopaminergiques de la VTA. De fait, le traitement a essentiellement aboli la différence d’arborisation axonale et de phosphorylation oxydative de base entre les neurones de ces deux régions, transformant en quelque sorte les neurones de la SNc en une population de neurones avec des propriétés semblables à celles des neurones de la VTA. Ces effets du traitement à la sémaphorine 7A se sont traduits par une baisse importante des niveaux de dérivés réactifs de l’oxygène et par une baisse notoire de la vulnérabilité des neurones de la SNc face à plusieurs traitements neurotoxiques, utilisés in vitro comme modèles de la maladie de Parkinson. Ensemble, ces données représentent la preuve la plus directe que la grande vulnérabilité des neurones dopaminergiques de la SNc dans la maladie de Parkinson découle de leur demande énergétique élevée, qui serait tributaire de la taille massive de leur arborisation axonale (Figure 1). Ces neurones seraient donc plus vulnérables à une augmentation chronique du stress oxydatif en réponse à diverses altérations génétiques, au vieillissement ou à l’exposition à des toxines environnementales.
 | Figure 1.
Représentation schématique du modèle de vulnérabilité induite par une demande énergétique accrue en lien avec la taille de l’arborisation axonale. L’augmentation de la taille et de la complexité de l’axone chez les neurones dopaminergiques de la substance noire compacte (SNc) augmente le taux de consommation d’oxygène (OCR) de base, diminue la capacité énergétique de réserve (RCR) et nécessite une augmentation du nombre de mitochondries axonales. Il s’en suit une augmentation de la production de dérivés réactifs de l’oxygène (ROS) dans l’axone, ce qui rendrait les neurones plus vulnérables à de nombreux stress cellulaires. Le facteur de guidage axonal sémaphorine 7A permet de réduire la taille de l’arborisation axonale et de renverser l’augmentation de la vulnérabilité en diminuant la consommation d’oxygène de base. OCR : oxygen consumption rate ; RCR : respiratory control ratio ; ROS : reactive oxygen species ; Sema 7A : sémaphorine 7A ; # : nombre (inspiré de la figure 1 de [ 10]). |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
De Lau LM, Breteler MM. Epidemiology of Parkinson’s disease . Lancet Neurol. 2006; ; 5 : :525.–535. 2.
Thibault D, Kortleven C, Fasano C, et al. Découvertes récentes sur la fonction et la plasticité des voies dopaminergiques du cerveau . Med Sci (Paris). 2010; ; 26 : :165.–170. 3.
Shulman JM, Jager PLD, Feany MB. Parkinson’s disease : genetics and pathogenesis . Annu Rev Pathol Mech Dis. 2011; ; 6 : :193.–222. 4.
Pacelli C, Giguère N, Bourque MJ, et al. Elevated mitochondrial bioenergetics and axonal arborization size are key contributors to the vulnerability of dopamine neurons . Curr Biol. 2015; ; 25 : :2349.–2360. 5.
Surmeier DJ, Guzman JN, Sanchez-Padilla J, et al. The origins of oxidant stress in Parkinson’s disease and therapeutic strategies . Antioxid Redox Signal. 2011; ; 14 : :1289.–1301. 6.
Dryanovski DI, Guzman JN, Xie Z, et al. Calcium entry and α-synuclein inclusions elevate dendritic mitochondrial oxidant stress in dopaminergic neurons . J Neurosci. 2013; ; 33 : :10154.–10164. 7.
Ilijic E, Guzman JN, Surmeier DJ. The L-type channel antagonist isradipine is neuroprotective in a mouse model of Parkinson’s disease . Neurobiol Dis. 2011; ; 43 : :364.–371. 8.
Bolam JP, Pissadaki EK. Living on the edge with too many mouths to feed : why dopamine neurons die . Mov Disord. 2012; ; 27 : :1478.–1483. 9.
Pissadaki EK, Bolam JP. The energy cost of action potential propagation in dopamine neurons : clues to susceptibility in Parkinson’s disease . Front Comput Neurosci. 2013; ; 7 : :13.. 10.
Franco-Iborra S, Perier C. Neurodegeneration : the size takes it all . Curr Biol. 2015; ; 25 : :R797.–R800. |