| |
| Med Sci (Paris). 32(5): 435–438. doi: 10.1051/medsci/20163205003.Les calpaïnes Une arme à double tranchant Emmanuel Letavernier1* and Laurent Baud1** 1Sorbonne Universités, UPMC Univ Paris 06, UMR_S 1155 et Inflammation-Immunopathology-Biotherapy Department (DHU i2B), hôpital Tenon, 4, rue de la Chine, F-75020, Paris, France MeSH keywords: Animaux, Anti-inflammatoires, Calpain, Humains, Inflammation, Médiateurs de l'inflammation, Transduction du signal, métabolisme, pharmacologie, physiologie, étiologie, thérapie, immunologie |
L’inflammation est une réaction aiguë de défense de l’organisme face à une agression par exemple d’origine infectieuse ou traumatique. Elle permet la restitution de tissus morphologiquement et fonctionnellement normaux. Néanmoins, pour éviter que son développement se perpétue et conduise lui-même à de nouvelles lésions, il est nécessaire qu’elle se résolve rapidement [1]. L’interruption de la réaction inflammatoire suppose que l’afflux de cellules et la libération ou la fonction de médiateurs inflammatoires soient progressivement limités. C’est le rôle des médiateurs anti-inflammatoires, protéiques et lipidiques, qui sont synthétisés très tôt après l’apparition des premières lésions. Un très bel exemple de résolution de l’inflammation est donné par la cascade de médiateurs lipidiques décrite par Charles Serhan [2]. L’initiation de la réaction inflammatoire est caractérisée par la synthèse, à partir de l’acide arachidonique, de médiateurs (prostaglandine E2[PGE2] et leucotriène B4 [LTB4]) qui favorisent l’afflux de polynucléaires neutrophiles. Un changement (en anglais, switch) dans le métabolisme de l’acide arachidonique se produit ensuite, conduisant à la synthèse préférentielle d’un nouveau dérivé lipidique, la lipoxine, qui en limitant l’afflux de polynucléaires neutrophiles et en favorisant leur apoptose et leur élimination par des macrophages permet la résolution de l’inflammation. Au cours de ces dix dernières années, notre groupe a mis en évidence un nouvel exemple de switch, cette fois dans l’activité d’une protéase, la calpaïne, qui, de pro-inflammatoire dans le cytoplasme, devient anti-inflammatoire et réparatrice, simplement en passant du cytosol au milieu extracellulaire de la cellule qui la produit. |
Les calpaïnes intracellulaires, des médiateurs de l’inflammation Les calpaïnes sont des endopeptidases à cystéine de type papaïne dont l’activité dépend du calcium (l’appellation calpaïne provient d’ailleurs de la fusion des mots calcium et papaïne) [3] (→).
(→) Voir la Synthèse de L. Baud et al., m/s n° 1, janvier 2003, page 71
Elles comptent 14 membres dont les principaux sont les calpaïnes µ (ou calpaïne 1 [CAPN1]) et m (ou CAPN2), parce qu’elles sont respectivement actives à des concentrations micromolaires et millimolaires de calcium. Elles sont toutes les deux associées à la sous-unité régulatrice calpaïne 4 (ou Css1 pour calpain small subunit 1). Présentes dans le cytoplasme de chaque cellule, leur activité est physiologiquement limitée par un pseudosubstrat, la calpastatine, qui mime mais ne présente pas l’activité du substrat. Leur implication dans la réaction inflammatoire a été démontrée initialement grâce à l’administration d’inhibiteurs pharmacologiques qui leur étaient plus ou moins spécifiques. Par la suite, des expériences ont été réalisées en utilisant des souris transgéniques surexprimant la calpastatine soit dans l’organisme entier, soit dans des tissus cibles. Grâce à cette technique beaucoup plus spécifique, nous avons montré en particulier, que les calpaïnes amplifiaient la réaction inflammatoire dans des modèles de glomérulonéphrite1 [4], d’hypertension artérielle [5], de rejet d’allogreffe [6] ou de septicémie [7]. Les mécanismes moléculaires de cette augmentation de l’inflammation impliquant les calpaïnes, reposent sur l’activation du facteur de transcription clé de l’inflammation NF-κB, l’induction du facteur chimiotactique pour les monocytes MCP-1 (monocyte chemoattractant protein-1 ou CCL2 [chemokine (C-C motif) ligand 2]), la dégradation de la chaîne γc2, du récepteur de l’IL(interleukine)-2 (facteur limitant la production d’IL-17 par les cellules T), et la libération de microparticules procoagulantes. Les calpaïnes participent également au développement de la fibrose « cicatricielle » qui accompagne la réaction inflammatoire, par exemple dans les atteintes vasculaires de l’hypertension artérielle [5] et myocardiques associées à l’infarctus [8]. Dans leur ensemble, ces études et bien d’autres suggèrent que les calpaïnes intracellulaires jouent un rôle important dans le développement de l’inflammation et de la fibrose cicatricielle. |
Les calpaïnes sont extériorisées Seules quelques études ont montré que les calpaïnes peuvent être présentes dans le milieu extracellulaire bien sûr en cas de mort cellulaire, mais également en l’absence de toute lésion de la cellule. La calpaïne ne comporte pas dans sa structure de peptide signal dans son domaine aminoterminal qui lui permettrait d’être adressée à la membrane pour être excrétée. Il faut donc admettre que cette sécrétion se réalise selon un mode non conventionnel grâce, par exemple, à l’activité de transporteurs membranaires comme ceux de la famille ABC (ATP binding cassette)3 [11] (→).
(→) Voir la Synthèse de M. Mourez et al., m/s n° 3, mars 2000, page 386
Nous avons démontré en effet que les lymphocytes murins et humains sécrètent les calpaïnes µ et m en utilisant le système de transport membranaire ABCA1 (Figure 1). Ainsi, l’inhibition pharmacologique spécifique de la voie ABCA1 par le glyburide, ou sa suppression par une technique de siARN (small interfering RNA), diminuent la sécrétion de calpaïnes et favorisent ainsi l’accumulation de la protéase dans le cytosol de la cellule [9]. Au contraire, l’activation d’ABCA1 par l’apolipoprotéine A1(ApoA-1) ou son peptide actif 4F, augmente la sécrétion des calpaïnes, limitant ainsi leur activité à l’intérieur de la cellule. Comment l’activité d’ABCA1 permet l’externalisation des calpaïnes n’a pas été démontré dans ces études mais il est vraisemblable qu’elle implique la formation de microvésicules. En effet, grâce à son activité floppase4,, le transporteur ABCA1 participe à la formation de microvésicules dont nous avons montré qu’elles contiennent les calpaïnes µ et m [9]. Ces microvésicules sont instables. Elles pourraient être rapidement rompues, libérant les protéases dans le milieu extracellulaire où la concentration de calcium considérablement plus élevée que dans le cytosol, permettrait leur activation. Il est donc très important de connaître le rôle des calpaïnes externalisées.
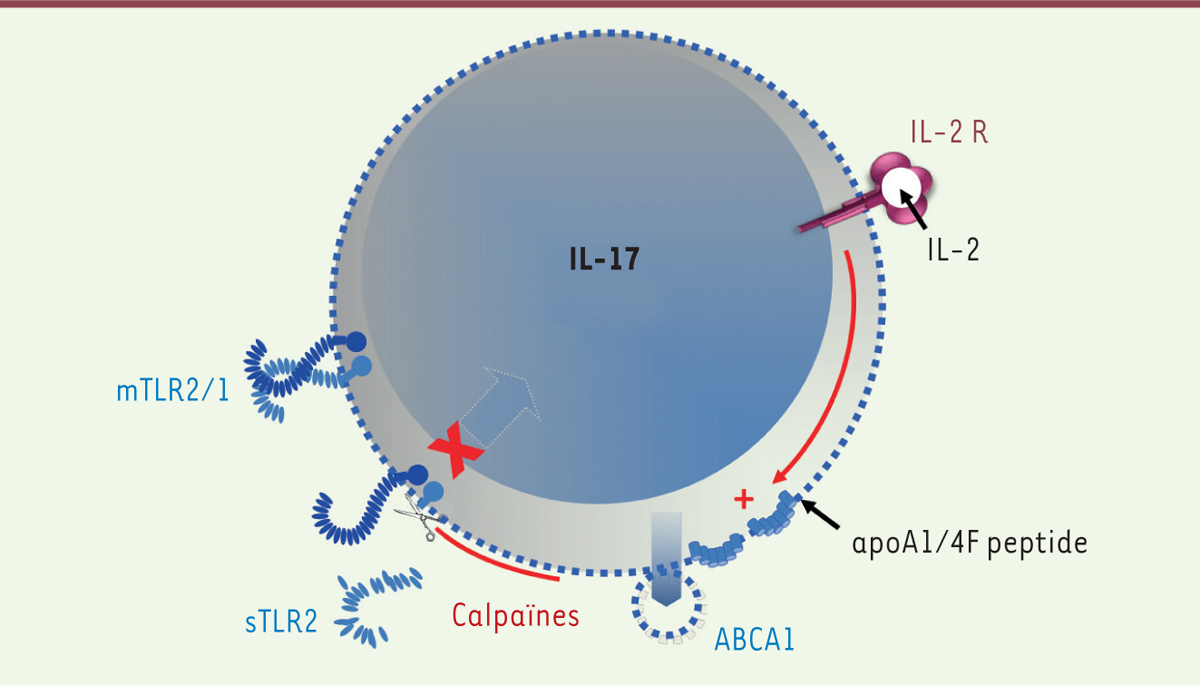
 | Figure 1.
Mécanismes de la sécrétion des calpaïnes et de l’action anti-inflammatoire des calpaïnes sécrétées. Les lymphocytes T sécrètent les calpaïnes dans des microvésicules grâce à l’activité du transporteur ABCA1 (ATP-binding cassette transporter A1). Celles-ci se rompent et libèrent les calpaïnes qu’elles contiennent dans le milieu extracellulaire où leur activité est amplifiée par les concentrations élevées de calcium. Les calpaïnes ainsi libérées coupent le domaine extracellulaire de TLR2 (toll-like receptor 2), puis le dégradent. Il en résulte en particulier une diminution de l’expression TLR2-dépendante d’une cytokine pro-inflammatoire, l’IL(interleukine)-17. ApoA1 : apolipoprotéine A1 ; IL-2 R : récepteur de l’IL-2 ; sTLR2 : forme soluble de TLR2 ; mTLR1/2 : forme membranaire de TLR1/2. |
|
Les calpaïnes extracellulaires limitent l’inflammation et favorisent sa résolution Afin d’identifier les fonctions des calpaïnes extracellulaires, des lymphocytes spléniques murins ont été activés par un anticorps anti-CD3 (spécifique du TcR [T-cell receptor]) puis exposés à la calpaïne µ purifiée. Les cytokines produites ont ensuite été évaluées [9]. Nous avons ainsi observé que la production d’IFN(interféron)-γ (cytokine caractéristique des lymphocytes de type Th1), d’IL-4 (caractéristique des lymphocytes Th2), d’IL-2, d’IL-6, d’IL-12 et de TNF(tumor necrosis factor)-α n’est pas modifiée par la calpaïne. En revanche, la sécrétion d’IL-10 et surtout d’IL-17 diminue très significativement par rapport aux taux mesurés avec des cellules activées mais pas exposées à la calpaïne. Nous avons donc particulièrement analysé le rôle des calpaïnes extracellulaires sur l’expression de l’IL-17 par les lymphocytes. Dans les lymphocytes activés via leur TcR, les calpaïnes endogènes sécrétées créent un rétrocontrôle négatif sur l’expression d’IL-17, qui augmente lorsque le transporteur ABCA1 est stimulé par l’ApoA-1 et diminue lorsque l’activité calpaïne est bloquée spécifiquement dans le milieu extracellulaire. Ce contrôle s’exerce au niveau de la transcription du gène de la cytokine. Afin de caractériser la cible moléculaire des calpaïnes impliquée dans ce rétrocontrôle, nous avons recherché quelle(s) protéine(s) présente(s) à la surface des lymphocytes et exposée(s) à l’action protéasique de la calpaïne extracellulaire, pouvai(en)t être dégradée(s). Par électrophorèse et MALDI-TOF/TOF5,, nous avons pu identifier la protéine chaperonne grp94 (également appelée gp96) dans le milieu extracellulaire. gp96 n’est pas dégradée par les calpaïnes mais elle est détachée de son support membranaire. gp96 est un ligand du récepteur de l’immunité innée TLR2 (toll-like receptor 2) avec lequel elle est associée. Des analyses ultérieures ont pu montrer en effet que les calpaïnes clivaient en fait le domaine extracellulaire de TLR2, au ras de la membrane plasmique, libérant ainsi gp96. Ceci conduit à la génération d’une forme soluble du récepteur, avant qu’il ne soit coupé en de multiples petits fragments (Figure 1). L’implication de cette cible dans le contrôle d’IL-17 par les calpaïnes extracellulaires a pu être confirmée par l’observation que le rétrocontrôle est amplifié par l’addition d’un ligand spécifique de TLR2 (le Pam3Cys6) et annihilé lorsque TLR2 est bloqué ou absent. Nous avons également examiné si des mécanismes physiologiques de contrôle d’IL-17 pouvaient impliquer la sécrétion de calpaïnes. L’IL-2 est classiquement décrite pour limiter l’expression d’IL-17. Cette interleukine amplifie effectivement la concentration d’ABCA1 dans la membrane plasmique des lymphocytes. Elle accélère la sécrétion de calpaïnes et limite ainsi l’expression de TLR2 et donc d’IL-17 induite par un ligand spécifique du récepteur. Il est intéressant de noter que cette régulation de l’IL-17 par l’IL-2 n’est obtenue que pour de faibles doses d’IL-2 (0,001-0,01 ng/mL) dont les effets anti-inflammatoires et immunosuppresseurs sont bien établis chez les patients atteints de maladie auto-immune. Est-ce qu’un contrôle de l’expression d’IL-17 par les calpaïnes extracellulaires intervient in vivo ? Pour répondre à cette question, des souris transgéniques (CRP/Cast) qui expriment la calpastatine (Cast), inhibiteur de l’activité des calpaïnes, sous le contrôle du promoteur/peptide signal de la CRP (C-reactive protein) humaine ont été générées [9]. Cette construction a l’avantage d’associer une faible expression basale du transgène (gène intégré) dans le foie. Par contre elle permet d’obtenir une augmentation de l’expression qui est significative en réponse à un stimulus inflammatoire et une sécrétion de la protéine dans le sang et le milieu extracellulaire. Avec cet outil, nous avons montré, dans un modèle de péritonite aiguë provoquée par l’injection de Pam3Cys, qu’une diminution de l’activité calpaïne extracellulaire induite par le produit du transgène, élève effectivement les concentrations locales d’IL-17 et aggrave, proportionnellement, l’infiltration du péritoine par des polynucléaires neutrophiles. Avec ce même outil, nous avons analysé un modèle d’arthrite rhumatoïde, une pathologie qui implique à la fois la gp96, le TLR2 et l’IL-17 [9]. Dans ce cas, la présence de calpastatine extracellulaire chez les souris CRP/Cast augmente l’incidence de la maladie et aggrave les lésions de synovite et de destruction du cartilage articulaire. Finalement, les calpaïnes extracellulaires ne limitent pas seulement la réaction inflammatoire. Elles favorisent aussi sa résolution et la réparation tissulaire. Les calpaïnes extracellulaires dégradent en effet la fibronectine de la matrice extracellulaire avec pour conséquence (1) une diminution de l’ancrage des cellules épithéliales à cette matrice, ce qui favorise leur migration et la colonisation de zones détruites par l’inflammation, et (2) la génération de fragments de fibronectine ce qui accélère la prolifération des cellules endothéliales et la formation de nouveaux tubes capillaires [10]. |
Quelles opportunités pour une nouvelle approche thérapeutique ? Moduler l’activité calpaïne extracellulaire est potentiellement intéressant en thérapeutique. Cela permettrait de contrôler la production de l’IL17, soit pour l’augmenter (pour un traitement anti-cancéreux par exemple), soit pour la limiter (dans le cadre d’un traitement anti-inflammatoire par exemple). Dans le premier cas, l’activité calpaïne extracellulaire pourrait être bloquée par l’administration de calpastatine ou de certains de ses fragments. Dans le second cas, elle devrait être amplifiée par l’administration de calpaïne (calpaïne 4 ou stabilisateur de calpaïnes), ce qui aurait une action plus directe que celle induite par les activateurs d’ABCA1 (4F ou faibles doses d’IL-2), qui sont maintenant bien établis. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Nathan C, Ding A. Nonresolving inflammation . Cell. 2010; ; 140 : :871.–882. 2.
Buckley CD, Gilroy DW, Serhan CN. Proresolving lipid mediators and mechanisms in the resolution of acute inflammation . Immunity. 2014; ; 40 : :315.–327. 3.
Baud L, Fouqueray B, Bellocq A, Peltier J. Les calpaïnes participent au développement de la réaction inflammatoire . Med Sci (Paris). 2003; ; 19 : :71.–76. 4.
Peltier J, Bellocq A, Perez J, et al. Calpain activation and secretion promote glomerular injury in experimental glomerulonephritis: evidence from calpastatin-transgenic mice . J Am Soc Nephrol. 2006; ; 17 : :3415.–3423. 5.
Letavernier E, Perez J, Bellocq A, et al. Targeting the calpain/calpastatin system as a new strategy to prevent cardiovascular remodeling in angiotensin II-induced hypertension . Circ Res. 2008; ; 102 : :720.–728. 6.
Letavernier E, Dansou B, Lochner M, et al. Critical role of the calpain/calpastatin balance in acute allograft rejection . Eur J Immunol. 2011; ; 41 : :473.–484. 7.
Zafrani L, Gerotziafas G, Byrnes C, et al. Calpastatin controls polymicrobial sepsis by limiting procoagulant microparticle release . Am J Respir Crit Care Med. 2012; ; 185 : :744.–755. 8.
Wan F, Letavernier E, Le Saux CJ, et al. Calpastatin overexpression impairs postinfarct scar healing in mice by compromising reparative immune cell recruitment and activation . Am J Physiol Heart Circ Physiol. 2015; ; 309 : :H1883.–H1893. 9.
Perez J, Dansou B, Hervé R, et al. Calpains released by T Lymphocytes cleave TLR2 to control IL-17 expression . J Immunol. 2016; ; 196 : :168.–181. 10.
Letavernier B, Zafrani L, Nassar D, et al. Calpains contribute to vascular repair in rapidly progressive form of glomerulonephritis: potential role of their externalization . Arterioscler Thromb Vasc Biol. 2012; ; 32 : :335.–342. 11.
Mourez M, Jéhanno M, Hofnung M, Dassa E. Rôle, fonctionnement et structure des transporteurs à ATP binding cassette (ABC). Med Sci (Paris) (Paris). 2000; ; 16 : :386.–394. |