| |
| Med Sci (Paris). 32(5): 461–469. doi: 10.1051/medsci/20163205012.L’altération de la perméabilité intestinale : chaînon manquant entre dysbiose et inflammation au cours de l’obésité ? Laurent Genser,1,2,3* Christine Poitou,1,2,3,4 Édith Brot-Laroche,1,5 Monique Rousset,1,5 Jean-Christophe Vaillant,6 Karine Clément,1,2,3,4 Sophie Thenet,1,5 and Armelle Leturque1,5 1Institut de cardiométabolisme et nutrition, ICAN, hôpital Pitié-Salpêtrière, F-75013, Paris, France 2Sorbonne universités, université Paris 06, UMR-S 1166, Nutriomics Team, F-75013Paris, France 3Inserm, UMRS 1166, Nutriomics, F-750135Paris, France 4Assistance-Publique Hôpitaux de Paris, groupe hospitalier Pitié-Salpêtrière, service de nutrition, 47-83, boulevard de l’Hôpital, F-75013Paris, France 5Centre de recherche des Cordeliers, Inserm, UMPC université Paris 6, université Paris Descartes Paris 5, CNRS, EPHE laboratoire de pharmacologie cellulaire et moléculaire, 75006Paris, France 6Assistance-Publique Hôpitaux de Paris, groupe hospitalier Pitié-Salpêtrière, service de chirurgie digestive, hépato-bilio-pancréatique, transplantation hépatique, F-75013Paris, France |
Vignette (Photo © Inserm-Rafael Oriol). L’obésité, maladie multifactorielle associant des déterminants génétiques et environnementaux, est un problème majeur de santé publique mondiale car elle est responsable de l’augmentation de la prévalence de nombreuses pathologies métaboliques et cardiovasculaires [1]. Nos équipes ont participé à la démonstration que l’obésité et les maladies cardiométaboliques associées sont caractérisées par une inflammation systémique [2, 3] et tissulaire de bas grade1 [4–6] (→) perturbant la sensibilité à l’insuline, ainsi que par des changements du microbiote en lien avec les modifications des apports alimentaires [7]. Les récents travaux ayant mis en lumière l’importance du microbiote intestinal dans le métabolisme et la réponse immunitaire de l’hôte ont conduit naturellement à poser la question d’un rôle de la barrière intestinale en physiopathologie et particulièrement dans les maladies métaboliques. Des travaux pionniers réalisés sur des rongeurs rendus obèses par un régime hyperlipidique ont montré que le changement de composition du microbiote et l’inflammation systémique étaient effectivement associés à une altération de la perméabilité intestinale et de la sensibilité à l’insuline [8]. Cependant, les altérations de la perméabilité intestinale et ses liens potentiels avec l’inflammation et le microbiote intestinal restent à explorer dans l’obésité humaine.
(→) Voir la Synthèse de E. Dalmas et al., m/s n° 11, novembre 2011, page 993
|
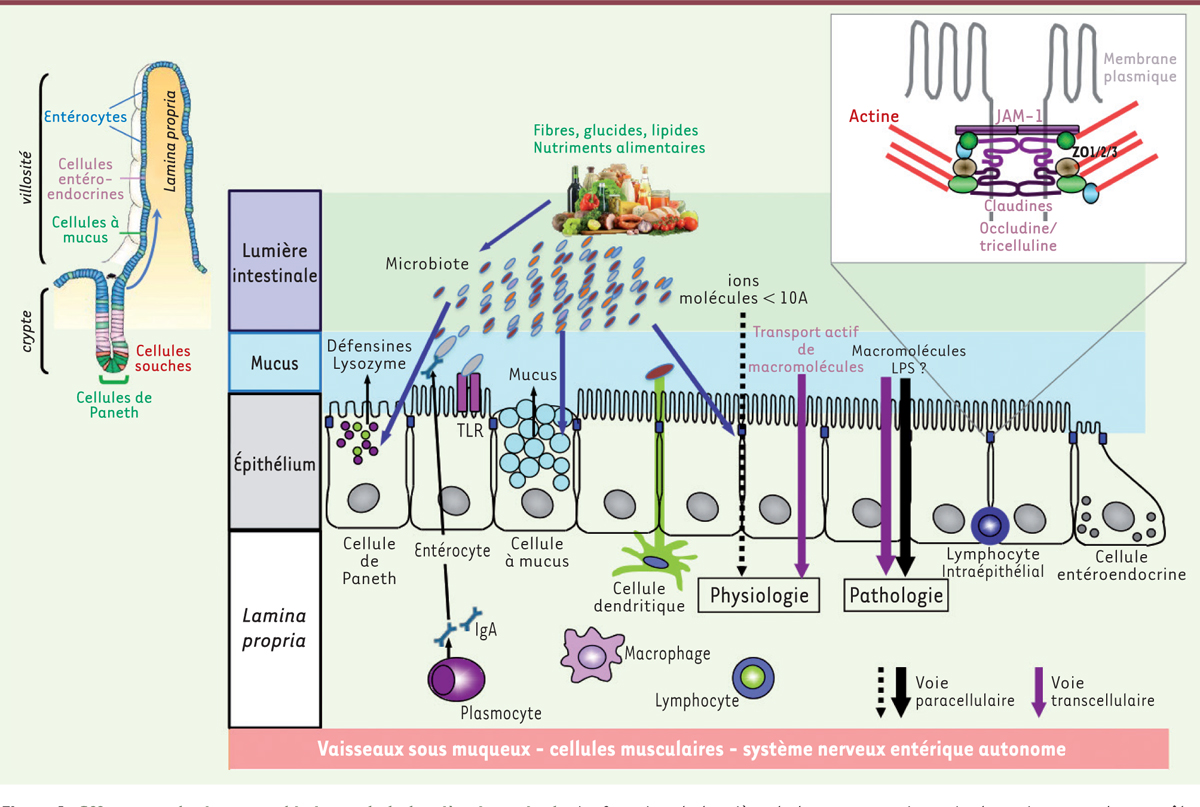
Concepts de barrière et perméabilité intestinale La « barrière intestinale » est une entité fonctionnelle complexe, tant en ce qui concerne les cellules qui la composent que les éléments mécaniques et chimiques qui y sont associés [9] (Figure 1). La fonction première de cette barrière est de limiter l’accès du contenu de la lumière intestinale, qui inclut en particulier les composants bactériens du microbiote, au milieu intérieur et à la circulation. Cette fonction de barrière physique est assurée par une monocouche de cellules épithéliales, étroitement reliées entre elles par des jonctions intercellulaires (jonctions serrées, adhérentes et desmosomes2), ainsi que par le mucus qui recouvre la surface apicale des cellules, dont les constituants, les mucines, sont sécrétés par les cellules caliciformes. Le terme de barrière intestinale est également utilisé dans un sens plus large incluant un rôle protecteur contre l’invasion des pathogènes environnementaux, tout en permettant une tolérance vis-à-vis de la flore commensale et des aliments. Cette fonction met en jeu des molécules sécrétées par les cellules épithéliales, en particulier les défensines et le lysozyme, molécules antimicrobiennes qui sont synthétisées par les cellules de Paneth localisées à la base des cryptes de l’intestin grêle ; elle fait également intervenir des cellules de l’immunité innée et adaptative (cellules dendritiques, macrophages, lymphocytes), présentes dans la lamina propria et des immunoglobulines A (IgA) sécrétées par les plasmocytes situés à ce niveau, et transportées à travers l’épithélium vers la lumière intestinale ; des lymphocytes intra-épithéliaux et des follicules lymphoïdes associés à la muqueuse (plaques de Peyer) y participent également [10].
 | Figure 1.
Effecteurs physiques et chimiques de la barrière intestinale. La fonction de barrière de la muqueuse intestinale, qui permet de contrôler le flux paracellulaire d’antigènes bactériens ou alimentaires tout en maintenant un transport actif transcellulaire de macromolécules (en particulier des nutriments), est assurée au niveau de l’intestin grêle, par une monocouche de cellules épithéliales spécialisées le long de l’axe crypto-villositaire (schéma de gauche). Ces cellules épithéliales polarisées comprennent les cellules de Paneth, au fond des cryptes, et les entérocytes, population majoritaire (> 80 %) ayant une fonction d’absorption des nutriments, les cellules caliciformes qui sécrètent le mucus et les cellules entéro-endocrines au niveau des villosités. Au pôle luminal de l’épithélium qui est tapissé d’un gel de mucus, sont présents des peptides antimicrobiens sécrétés par les cellules de Paneth, des IgA sécrétoires et le microbiote qui, sous l’influence du régime alimentaire, interagit avec ces différents éléments. Au pôle basal ( lamina propria) patrouillent des cellules immunitaires. Des lymphocytes intra-épithéliaux complètent la barrière. Cette organisation diffère en plusieurs points au niveau du côlon, qui ne comporte que des cryptes et pas de villosités. Les cellules à mucus y sont beaucoup plus nombreuses, la flore intestinale et la couche de mucus sont plus abondantes et la perméabilité paracellulaire est plus faible que dans l’intestin grêle. L’étanchéité de l’épithélium est assurée par les jonctions serrées, qui sont des complexes protéiques situés à l’apex de la membrane plasmique des cellules (encadré). En situation pathologique, une désorganisation des jonctions serrées aboutit à l’augmentation du flux paracellulaire et au passage de molécules de plus grande taille. Une augmentation du passage transcellulaire pourrait aussi expliquer l’augmentation de la perméabilité intestinale vis-à-vis de certaines macromolécules comme les antigènes alimentaires et des LPS bactériens. JAM-1 : junctional adhesion molecule 1 ; LPS : lipopolysacharides ; TLR : toll like receptor (d’après [ 10, 11, 14]). |
La perméabilité est la propriété de l’intestin qui permet les échanges entre sa lumière et le milieu intérieur. Elle s’opposerait donc à la barrière, mais dans l’intestin ni l’une ni l’autre n’est absolue. La perméabilité paracellulaire (qui correspond au passage entre les cellules) est strictement régulée en conditions physiologiques. Elle diminue de l’intestin grêle au côlon. Le contrôle de la perméabilité paracellulaire passive est indispensable pour que les fonctions de transport actif transcellulaire de l’épithélium intestinal s’exercent correctement. Ce sont les jonctions serrées qui contrôlent le flux paracellulaire de l’eau, des ions et celui des molécules en fonction de leur taille (de 6 à 60 Å, du sommet des villosités à la base des cryptes, dans l’intestin grêle) [11]. L’expression différentielle d’un répertoire de protéines transmembranaires, les claudines (Figure 1), permet de contrôler la charge et la taille des petites molécules (ions, sucres) qui traversent les pores des jonctions serrées. Des voies de passage possible pour des molécules de plus grandes tailles sont générées par l’endocytose de l’occludine et par la contraction du cytosquelette d’actine qui régulent les jonctions serrées ou, à l’extrême, par la mort de cellules épithéliales [11]. Une augmentation de la perméabilité intestinale paracellulaire et/ou transcellulaire, permettant le passage à travers l’épithélium de macromolécules (antigènes alimentaires, fragments bactériens), est impliquée dans plusieurs pathologies intestinales (ulcères gastro-duodénaux, diarrhées infectieuses, syndrome de l’intestin irritable, maladies inflammatoires chroniques de l’intestin, maladie cœliaque, cancers digestifs) et potentiellement extra-intestinales (allergies, infections respiratoires, arthrite, choc septique, etc.). De nombreuses méthodes, plus ou moins invasives, permettent de mesurer la perméabilité intestinale dans des situations pathologiques. Les mesures ex vivo, sur des explants tissulaires en chambre de Ussing3, de flux de traceurs inertes ou de la résistance électrique transépithéliale restent les références pour évaluer la perméabilité paracellulaire vis-à-vis respectivement des (macro)molécules ou des ions. On notera qu’il reste difficile d’évaluer la contribution du passage transcellulaire (versus paracellulaire) dans l’augmentation de la perméabilité intestinale vis-à-vis des macromolécules biologiquement actives [12]. |
Perméabilité intestinale et obésité : des données chez la souris qui restent à confirmer chez l’homme Le concept d’une hyperperméabilité intestinale dans l’obésité repose sur une série de travaux réalisés chez les rongeurs génétiquement obèses ou rendus obèses par un régime hyperlipidique [13, 14]. Dans ces modèles animaux, une augmentation du passage des ions et des traceurs de grande taille (4 kDa) et une altération des protéines des jonctions serrées ont été observées [8]. Si les données sont concordantes chez les rongeurs soumis à un régime hyperlipidique, plusieurs études montrent cependant que tous les paramètres de la perméabilité ne sont pas modifiés chez les rongeurs génétiquement obèses [15, 16]. Chez l’homme, les données sur les changements de la perméabilité intestinale dans l’obésité sont rares et discordantes (Tableau I). Alors qu’en 2010, une étude ne montrait aucune modification de la perméabilité (au niveau du grêle et du côlon) telle que mesurée par l’excrétion urinaire de sucres [17], en 2012, le même test mettait en évidence une légère augmentation chez les sujets obèses [18]. Une troisième étude objectivait une perméabilité gastroduodénale augmentée chez les sujets obèses, sans différence au niveau de l’intestin grêle et du côlon [19]. Chez des sujets sains, une corrélation positive est observée entre la perméabilité au niveau du côlon et la quantité de graisse viscérale, sans qu’il y ait de relation avec l’indice de masse corporelle (IMC, déterminé par : masse [en kg]/taille [en m]2) [20]. De même, 6 mois après une chirurgie bariatrique4, (par by-pass gastrique), la perméabilité intestinale, mesurée par le ratio lactulose/mannitol5, ne semble pas significativement modifiée [21], même si l’augmentation du taux de certaines protéines de jonctions serrées (claudines 3 et 4), rapportée dans une autre étude [22], pourrait évoquer une diminution de la perméabilité après chirurgie. Des analyses de perméabilité intestinale réalisées sur un plus grand nombre de patients issus de populations plus homogènes, combinant différentes approches expérimentales de mesure, incluant le passage des macromolécules, sont donc nécessaires pour étayer les conclusions quant à la pathogénicité de l’augmentation de la perméabilité intestinale dans l’obésité humaine. L’utilisation de stratégies d’analyse intégrée des données obtenues à partir des phénotypes cliniques et des mesures de perméabilité sera utile pour mieux stratifier les phénotypes complexes qui sont associés à l’obésité chez l’homme.
Tableau I.
| Méthodes de mesure |
Paramètres utilisés |
Segment d’intestin étudiée |
Bio-ressource |
Inconvénients |
Références obésité humaine |
Différence obèse versus non obèse (nombre de sujets étudiés) |
|
Ex vivo :
|
|
|
|
|
|
|
| Chambres de Ussing |
H2O, ions, sucres, traceurs fluoromarqués, etc. |
Dépend du site prélevé |
Déchet opératoire ou biopsies |
Invasif, peu de données |
[22] |
pas de sujets minces (n = 33 Ob) |
| Expression de protéines de jonctions serrées |
ARN (qPCR), Western blot
|
|
|
|
[22] |
pas de sujets minces (n = 33 Ob) |
| Marquage des cellules à mucus |
Histologie |
|
|
|
- |
|
| Analyse du mucus |
Histologie/coloration (bleu Alcian) |
|
|
|
- |
|
| Brèches épithéliales |
Histologie-microscopie électronique |
|
|
|
- |
|
| Perte des cellules de Paneth |
Histologie |
|
|
|
- |
|
| Expression des défensines |
ARN (qPCR), Western blot
|
|
|
|
|
|
|
|
In vivo : Tests de perméabilité de molécules
|
|
|
|
|
|
|
| Oligosaccharides de poids moléculairesdifférents |
lactulose/mannitol (CPG-SM) |
Intestin grêle |
Urine |
Temps de réalisation, |
[18] |
+ 25 % (NS) (n = 20 Ob versus 19 NO) |
|
lactulose/mannitol (CPG-SM) |
Intestin grêle |
Urine |
Reproductibilité |
[21] |
pas de sujets minces (n = 16 Ob) |
|
sucralose/lactulose/mannitol (CPG-SM) |
Intestin grêle ; côlon |
Urine |
|
[17] |
+ 9 % intestin grêle (NS) (n = 13 Ob versus 11 NO) |
|
sucrose/lactulose/rhamnose/sucralose |
Estomac-duodénum ; |
Urine |
|
[19] |
estomac-duodénum : + 100% ; intestin grêle et côlon : pas de différence (n = 15 Ob versus 13 NO) |
| Polyéthylène glycols |
/érythritol (CPG-SM) |
intestin grêle ; côlon |
Urine |
Radioactivité |
- |
|
| Marqueur radioactif |
PEG 4000/40051Cr-EDTA |
Tout le tube digestifTout le tube digestif |
Urine |
|
- |
|
|
|
In vivo : Passage bactérien
|
|
|
|
|
|
|
| Endotoxémie |
LPS plasmatique (LAL) |
Tout le tube digestif |
Plasma |
|
[36] |
+ 100 % (n = 65 Ob versus 55 NO) |
|
LBP sérique (ELISA) |
Tout le tube digestif |
Sérum |
|
[32] |
+ 31 % (n = 127 Ob versus 112 NO) |
|
|
|
Sérum |
|
[33] |
+ 73 % (n = 98 Ob versus 124 NO) |
| Métabolite bactérien |
|
|
Plasma |
|
[34] |
+ 176 % (n = 559 Ob versus 500 NO) |
| Production de butyrate |
LPS sérique (ELISA-EndoCAb) |
Tout le tube digestif |
Sérum |
|
- |
|
| Passage de pathogènes |
D-lactate |
Tout le tube digestif |
Plasma |
Peu spécifique |
- |
|
| Tests respiratoires à l’H2 |
Bactéries productrices de butyrate (PCR) |
Côlon |
Selles |
Peu de données |
- |
|
|
Test à l’hémolysine (culture cellulaire) |
Côlon |
Selles |
|
- |
|
|
Quantification de pullulation bactérienne (CPG-SM) |
Tout le tube digestif |
Air expiré |
Peu de donnéesPeu spécifique |
[44] |
Positivité 7 fois plus fréquente chez les sujets obèses (n = 140 Ob versus 40 NO) |
|
|
In vivo : Biomarqueurs de lésion épithéliale
|
|
|
|
|
|
|
|
Citrulline |
Intestin grêle |
Plasma |
Peu de données |
- |
|
|
Zonuline |
Tout le tube digestif |
Sérum |
Peu de données |
[39] |
|
|
Claudines 3-4 |
Tout le tube digestif |
Urine |
Peu de données |
- |
+ 34 % (n = 33 Ob versus 90 NO) |
|
|
In vivo : Autres
|
|
|
|
|
|
+ 14 % (NS) (n = 13 Ob versus 11 NO) |
| Microinflammation intestinale |
Calprotectine |
Côlon |
Selles |
Peu spécifique |
[17] |
|
|
|
|
|
|
[19] |
Association avec la composition du microbiote (n = 15 Ob versus 13 NO) |
Méthodes de mesures directes et indirectes de la perméabilité intestinale en pathologie humaine et applications dans l’obésité. Ensemble des méthodes d’évaluation ex vivo et in vivo de la perméabilité intestinale utilisées en pathologie chez l’homme (d’après [ 14]). Seules certaines d’entre elles ont été appliquées dans le contexte de l’obésité. Dans ce cas, le tableau renvoie au numéro de la référence de l’article. LPS : lipopolysaccharide ; LBP : LPS binding protein ; LAL : limulus amebocyte lysate assay ; EndoCAb : circulating endotoxin core antibodies ; CPG : chromatographie phase gazeuse ; SM : spectrométrie de masse ; PEG : polyéthylène glycol ; EDTA : acide éthylène diamine tétraacétique ; H2 : hydrogène; Ob : sujets obèses ou obèses morbides ; NO : sujets non obèses ; - : non évalué ; NS : non significatif. Suite du
Tableau I
page 465. |
|
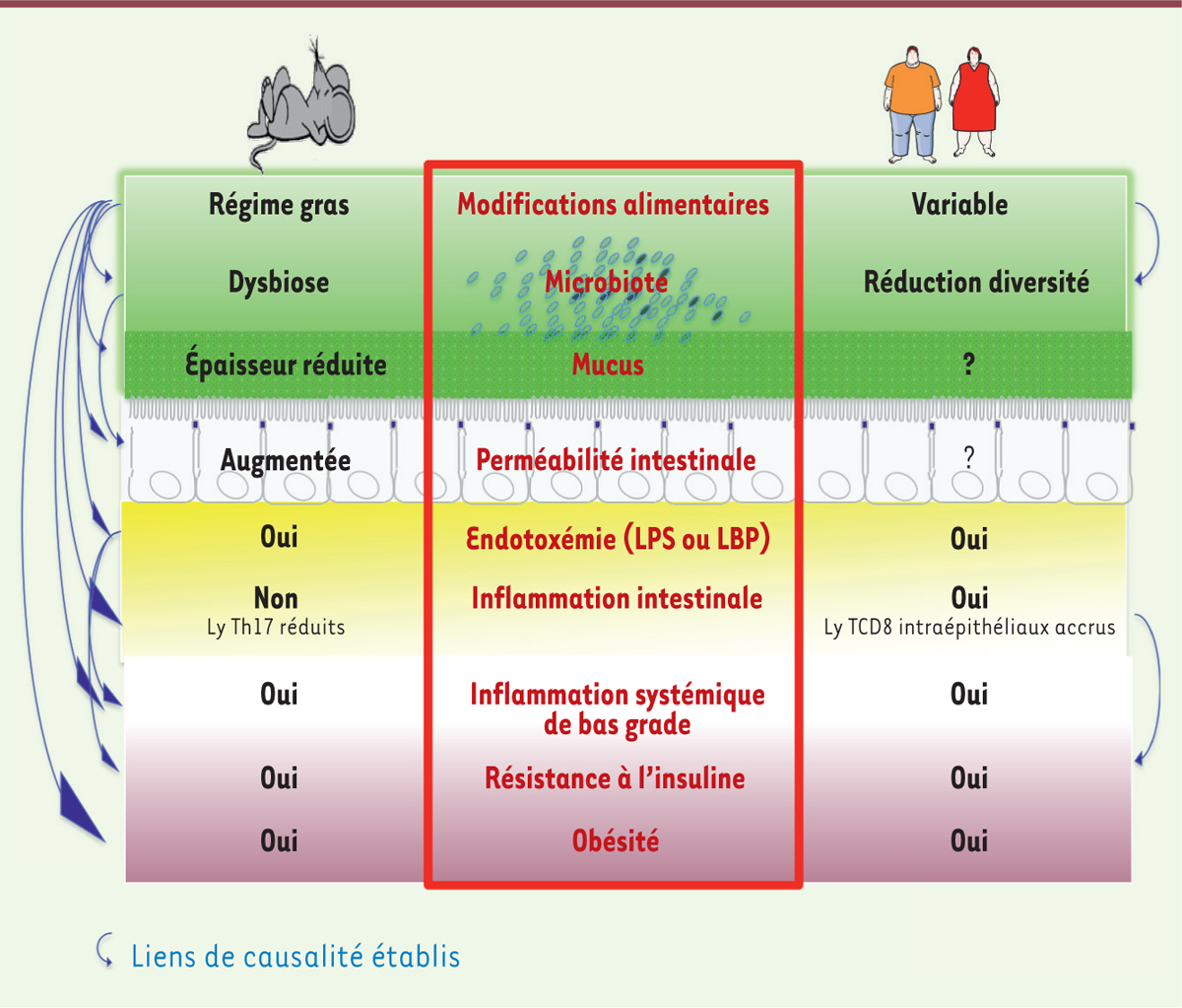
Quels sont les régulateurs potentiels de la perméabilité intestinale pouvant être affectés au cours de l’obésité ? Les liens établis entre perméabilité intestinale et obésité chez l’homme et dans les modèles murins sont présentés dans la
Figure 2
.
 | Figure 2.
Rôle de la barrière intestinale dans les maladies métaboliques chez les rongeurs et chez l’homme. Chez les rongeurs, la consommation de lipides en excès provoque une dysbiose, une augmentation de la perméabilité intestinale, et un passage systémique de LPS. Cette endotoxémie provoque une inflammation systémique de bas grade. Ce sont des causes probables d’altérations métaboliques qui conduisent à l’obésité. Chez l’homme obèse, la modification de la perméabilité intestinale reste à documenter et les liens de causalité entre les différents paramètres modifiés restent à établir. LPS : lipopolysaccharide ; LBP : LPS binding protein ; Ly : lymphocytes. |
Perméabilité intestinale et microbiote Le microbiote intestinal est composé d’environ un millier d’espèces bactériennes commensales du tube digestif, avec une abondance et probablement une composition qui sont variables le long du tractus digestif. Les écosystèmes bactériens varient également en fonction de leur positionnement, dans la lumière ou dans les couches de mucus [ 45] ( →), mais les connaissances dans ce domaine restent limitées. Chez l’homme et les rongeurs, les groupes dominants retrouvés dans les fèces sont les Bacteroidetes et les Firmicutes [ 23, 24] ( →).
(→) Voir la Nouvelle de J. L. Desseyn et al., m/s n° 12, décembre 2015, page 1063
(→) Voir la Synthèse de R. Burcelin et al., m/s n° 8-9, août-septembre 2013, page 800
À noter que le microbiote fécal n’est qu’un reflet partiel de la distribution des bactéries intestinales. Le microbiote contribue à la maturation du système immunitaire intestinal et à la défense de l’hôte contre les agents pathogènes [24]. Il permet également le renforcement de la barrière en induisant la production de mucus, la sécrétion de défensines et d’immunoglobulines A sécrétoires (IgAs) et la synthèse des protéines de jonction serrée par les entérocytes [10, 14, 24]. De plus, il favorise la digestion des aliments, notamment la fermentation de polysaccharides alimentaires qui conduisent à la production d’énergie par la fabrication d’acides gras à chaîne courte, principalement l’acétate, le propionate et le butyrate. Le microbiote a fait l’objet de nombreux travaux dans le contexte de l’obésité et des maladies cardiométaboliques [23] (→).
(→) Voir la Synthèse de R. Burcelin et al., m/s n° 8-9, août-septembre 2013, page 800
Initialement, son rôle a été établi dans l’obésité par des observations réalisées chez les rongeurs et des expériences de transfert fécal. Ainsi la prise de poids, induite par un régime gras, est moindre chez des souris axéniques (nées et élevées en milieu stérile donc exemptes de bactéries) par rapport à des souris conventionnelles [25] et la transplantation d’un microbiote fécal chez ces souris induit une augmentation de la masse grasse plus importante lorsque la flore provient d’une souris obèse que lorsqu’elle provient d’une souris mince [26]. L’ensemble de ces données suggère donc que, chez le rongeur, la composition du microbiote, qui dépend du profil alimentaire de l’animal, affecterait la composition corporelle et contribuerait à la prise de poids. Chez les souris rendues obèses par un régime hyperlipidique, la dysbiose6, observée au cours de l’obésité est associée à une altération de la perméabilité intestinale [8, 13]. La dysbiose est définie comme un déséquilibre du microbiote. Elle est associée à différentes pathologies de l’hôte l’hébergeant. L’administration d’antibiotiques atténue les effets du régime hyperlipidique sur les paramètres de la perméabilité intestinale [8] et plusieurs travaux suggèrent qu’il est possible de modifier ces paramètres par traitement avec des bactéries commensales ou des pré- et probiotiques7,, suggérant que la composition du microbiote peut moduler l’efficacité de la barrière intestinale [13, 14]. Les données obtenues chez l’homme ont montré une dysbiose chez les sujets obèses par rapport à des sujets minces, qui est différente de celle rapportée chez les rongeurs [26–28], avec un impact rapide du régime hyperlipidique sur la composition du microbiote [29]. La dysbiose est associée à une augmentation des risques cardiométaboliques. Une de ses caractéristiques est la perte de diversité du microbiote que l’on observe chez certaines (20 à 40 %) personnes obèses, accompagnée de l’enrichissement ou la perte de certains groupes bactériens. La diversité bactérienne peut être améliorée, au moins partiellement, par un régime riche en fibres et en protéines [7]. La perméabilité intestinale, mesurée in vivo, n’est, pour l’heure, pas associée aux changements de composition du microbiote fécal [19]. Ceci n’exclut cependant pas le rôle que pourraient jouer certaines bactéries présentes au niveau de segments plus proximaux de l’intestin. Perméabilité intestinale et modifications immuno-inflammatoires systémiques et tissulaires Perméabilité intestinale et inflammation systémique Parmi les facteurs susceptibles de déclencher et d’entretenir l’inflammation de bas grade que l’on rencontre dans l’obésité, l’augmentation de la perméabilité intestinale est un paramètre à prendre en compte car elle permettrait le passage au travers de la barrière de produits bactériens comme les lipopolysaccharides (LPS) présents dans la lumière [ 30, 31]. Les LPS (endotoxines) entrent dans la composition de la paroi des bactéries à Gram négatif ; ce sont des molécules de poids moléculaires variables (entre 4 et 40 kDa) en raison de leur degré de glycosylation et de leur capacité à s’agréger entre elles. Leur reconnaissance par les récepteurs transmembranaires de la famille des TLR ( toll-like receptors), principalement le TLR4, déclenche des cascades de signalisation à l’origine de la réponse inflammatoire. Une endotoxémie (taux d’endotoxine dans le sang) élevée, c’est-à-dire de 20 à 50 fois supérieure à la valeur normale, accompagne un choc septique (sepsis) tandis qu’une endotoxémie modérément élevée (environ 2 fois) a été qualifiée d’endotoxémie métabolique [ 30]. Ainsi, chez la souris, une perfusion de LPS pendant 4 semaines, permettant de doubler son niveau sérique, mime les effets métaboliques qui sont induits par un régime riche en graisse [ 30]. L’élévation des taux sériques de LPS est considérée comme un signe de perméabilité intestinale détériorée, bien que les modalités du passage de LPS par les voies paracellulaires et/ou transcellulaires soient peu documentées et restent débattues. Chez l’homme, en situation de sepsis, une corrélation a été montrée entre les taux sériques de LPS et de LBP (LPS-binding protein) plasmatique, une protéine qui interagit avec le complexe récepteur aux lipopolysaccharides [14]. Des taux plus élevés de LBP ont été rapportés chez des sujets en surpoids et obèses [32–34]. Ils pourraient être liés à l’inflammation systémique de bas grade que l’on observe chez ces sujets. Une seule étude a rapporté une diminution significative des taux sériques de LPS après chirurgie bariatrique, sans qu’il n’y ait de corrélation avec une amélioration des paramètres métaboliques [35]. Chez des volontaires sains minces, une association a été établie entre la consommation d’un repas riche en graisses et les concentrations sériques de LPS [36]. Une étude récente montre que cette endotoxémie post-prandiale est plus élevée chez les sujets obèses que chez les sujets minces [37]. Cependant, le taux de LPS circulant n’est pas toujours couplé à la perméabilité intestinale, telle qu’évaluée par l’excrétion de traceurs [14], ce qui limite son utilisation en clinique comme biomarqueur de la perméabilité. La zonuline est un analogue endogène eucaryote d’une endotoxine produite par la bactérie responsable du choléra. Comme l’endotoxine, elle désorganise les jonctions serrées intercellulaires et altère la perméabilité intestinale [38]. Le taux de zonuline est augmenté dans le sérum de patients ayant une maladie cœliaque en phase active et chez les patients souffrant de diabète de type 1. Une élévation modeste de zonuline circulante (20 %), corrélée à l’IMC et l’insulino-résistance, ainsi qu’aux paramètres de l’inflammation systémique, a été observée chez des sujets en surpoids et obèses. Mais cette augmentation sérique ne reflète pas la concentration locale au niveau de l’intestin [39]. La zonuline est un précurseur de l’haptoglobine 2, un marqueur non spécifique de l’inflammation systémique. Un anticorps permettant de différencier les deux protéines est donc indispensable avant de pouvoir faire de la zonuline un biomarqueur fiable de la perméabilité intestinale. La question de l’événement déclencheur de l’inflammation chez la souris obèse reste entière. Les LPS ne sont pas les seuls composés bactériens retrouvés dans l’organisme des souris soumises à un régime hyperlipidique. Des travaux du groupe de R. Burcelin rapportent en effet la présence d’ADN bactérien dans le sang et de bactéries commensales dans le tissu adipeux mésentérique [31]. Toutefois, les liens de causalité entre la translocation de bactéries vivantes à travers l’intestin et l’inflammation dans l’obésité restent à confirmer. Perméabilité intestinale et inflammation intestinale L’inflammation intestinale est caractérisée par une infiltration de la muqueuse par des cellules immunitaires (lymphocytes intra-épithéliaux, macrophages, etc.) et par la production de cytokines, pro- ou anti-inflammatoires, par de nombreux types cellulaires y compris les entérocytes. Dans les maladies inflammatoires chroniques de l’intestin, l’augmentation de la perméabilité intestinale conduit à une réponse exacerbée de l’immunité locale et de la sécrétion de cytokines pro-inflammatoires (TNF[ tumor necrosis factor]-α, IFN[interféron]-γ, etc.) qui altèrent les jonctions serrées, augmentant ainsi la translocation de macromolécules à l’origine d’un cercle vicieux [ 11]. Dans les modèles de maladies métaboliques, comme chez la souris rendue obèse par un régime hyperlipidique, l’augmentation de la perméabilité intestinale ne semble pas s’accompagner immédiatement d’une inflammation intestinale [ 15]. Augmentation de la perméabilité et inflammation intestinale ne semblent donc pas systématiquement associées chez la souris. Nous avons récemment démontré que l’obésité chez l’homme (IMC > 35) était en revanche associée à une inflammation de l’intestin grêle caractérisée, entre autres, par une augmentation du nombre de lymphocytes T intra-épithéliaux (CD8 αβ) qui participent à une altération de la fonction épithéliale [4]. L’impact de cette inflammation sur la perméabilité reste cependant à démontrer. |
Perspectives thérapeutiques Des stratégies thérapeutiques ont été mises en place pour certaines pathologies intestinales dans le but de maintenir l’intégrité de la barrière intestinale [9]. Parmi celles-ci, plusieurs ont été appliquées à l’obésité. En effet, la modulation du microbiote dans cette pathologie, qui peut être obtenue par l’utilisation de prébiotiques (constituants alimentaires bénéfiques pour certaines bactéries) ou de probiotiques (bactéries ou levures), donne un aperçu des liens qui existent entre le microbiote et l’obésité de même que les altérations métaboliques qui y sont associées. Les relations entre microbiote et perméabilité intestinale restent cependant à explorer. L’ajout d’acides gras à chaîne courte, produits par le microbiote, à des cultures de cellules épithéliales intestinales permet de renforcer les jonctions serrées et la résistance trans-épithéliale [40]. Chez l’homme, les travaux ayant évalué le rôle des probiotiques sur la perméabilité intestinale sont peu nombreux et restent discordants [41]. Récemment, il a été montré que l’adjonction, pendant 3 mois, de prébiotiques, sous forme de fibres alimentaires de type fructans (un polymère de fructose), dans l’alimentation des sujets obèses était associée à des modifications discrètes du microbiote et à une diminution très limitée de la masse grasse [42]. La perméabilité intestinale n’a pas été mesurée dans cette étude mais une diminution significative des LPS sériques a été rapportée. Chez la souris, l’administration intraveineuse du facteur de croissance épithélial GLP-2 (glucagon-like peptide-2) [43] permet de réduire les taux de LPS circulants et la perméabilité intestinale. Cependant, dans le contexte des maladies métaboliques chez l’homme, les effets bénéfiques du GLP-2 sur la perméabilité intestinale restent discutables. |
Conclusion : quels liens entre microbiote, perméabilité intestinale, inflammation, obésité ? L’ensemble des données obtenues chez les rongeurs suggère qu’au cours de l’obésité et des maladies métaboliques, les altérations du microbiote induites par le régime alimentaire peuvent affecter la perméabilité intestinale et s’accompagner d’une inflammation chronique de bas grade (Figure 2). Chez l’homme, bien que la littérature comporte de nombreux articles de revue spéculant sur une association entre ces altérations et l’obésité, les données obtenues ne reposent que sur un faible nombre d’études aux effectifs limités [14]. Ces études, qui utilisent des méthodes de mesure peu reproductibles et ne donnent souvent qu’une information partielle et indirecte de la modification de la perméabilité intestinale, n’ont pas encore permis d’établir des relations causales avec l’obésité. Une meilleure caractérisation des mécanismes à l’origine de l’inflammation observée dans l’obésité chez l’homme est désormais nécessaire afin d’élargir les possibilités, pour les patients, tant pour la prédiction des risques que pour l’adoption de stratégies thérapeutiques ciblées. |
Les auteurs déclarent ces financements : Investissements d’avenir ANR-10-IAHU ICAN; Institut Appert (UPPIA) ; Institut Benjamin Delessert ; Groupe Lipides et Nutrition ; Associations ARCEC et AAID ; Société française de chirurgie digestive (SFCD) ; programme Européen Métacardis (HEALTH-F4-2012-305312) ; Fondation Obélisque ; Metagenopolis INRA.
|
Footnotes |
1.
Ng M, Fleming T, Robinson M, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980–2013: a systematic analysis for the Global burden of disease study 2013 . Lancet. 2014; ; 384 : :766.–781. 2.
Poitou C, Dalmas E, Renovato M, et al. CD14dimCD16+ and CD14+CD16+ monocytes in obesity and during weight loss: relationships with fat mass and subclinical atherosclerosis . Arterioscler Thromb Vasc Biol. 2011; ; 31 : :2322.–2330. 3.
Magalhaes I, Pingris K, Poitou C, et al. Mucosal-associated invariant T cell alterations in obese and type 2 diabetic patients . J Clin Invest. 2015; ; 125 : :1752.–1762. 4.
Monteiro-Sepulveda M, Touch S, Mendes-Sa C, et al. Jejunal T cell inflammation in human obesity correlates with decreased enterocyte insulin signaling . Cell Metab. 2015; ; 22 : :113.–124. 5.
Dalmas E, Tordjman J, Guerre-Millo M, Clement K. Le tissu adipeux : un nouveau terrain de jeu pour les cellules immunitaires . Med Sci (Paris). 2011; ; 27 : :993.–999. 6.
Dalmas E, Venteclef N, Caer C, et al. T cell-derived IL-22 amplifies IL-1beta-driven inflammation in human adipose tissue: relevance to obesity and type 2 diabetes . Diabetes. 2014; ; 63 : :1966.–1977. 7.
Cotillard A, Kennedy SP, Kong LC, et al. Dietary intervention impact on gut microbial gene richness . Nature. 2013; ; 500 : :585.–588. 8.
Cani PD, Bibiloni R, Knauf C, et al. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice . Diabetes. 2008; ; 57 : :1470.–1481. 9.
Odenwald MA, Turner JR. Intestinal permeability defects: is it time to treat? . Clin Gastroenterol Hepatol. 2013; ; 11 : :1075.–1083. 10.
Garrett WS, Gordon JI, Glimcher LH. Homeostasis and inflammation in the intestine . Cell. 2010; ; 140 : :859.–870. 11.
Turner JR, Buschmann MM, Romero-Calvo I, et al. The role of molecular remodeling in differential regulation of tight junction permeability . Semin Cell Dev Biol. 2014; ; 36 : :204.–212. 12.
Menard S, Cerf-Bensussan N, Heyman M. Multiple facets of intestinal permeability and epithelial handling of dietary antigens . Mucosal Immunol. 2010; ; 3 : :247.–259. 13.
Moreira AP, Texeira TF, Ferreira AB, et al. Influence of a high-fat diet on gut microbiota, intestinal permeability and metabolic endotoxaemia . BrJ Nutr. 2012; ; 108 : :801.–809. 14.
Bischoff SC, Barbara G, Buurman W, et al. Intestinal permeability: a new target for disease prevention and therapy . BMC Gastroenterol. 2014; ; 14 : :189.. 15.
Johnson AM, Costanzo A, Gareau MG, et al. High fat diet causes depletion of intestinal eosinophils associated with intestinal permeability . PLoS One. 2015; ; 10 : :e0122195.. 16.
Suzuki T, Hara H. Dietary fat and bile juice, but not obesity, are responsible for the increase in small intestinal permeability induced through the suppression of tight junction protein expression in LETO and OLETF rats . Nutr Metab (Lond). 2010; ; 7 : :19.. 17.
Brignardello J, Morales P, Diaz E, et al. Pilot study: alterations of intestinal microbiota in obese humans are not associated with colonic inflammation or disturbances of barrier function . Aliment Pharmacol Ther. 2010; ; 32 : :1307.–1314. 18.
Teixeira TF, Souza NC, Chiarello PG, et al. Intestinal permeability parameters in obese patients are correlated with metabolic syndrome risk factors . Clin Nutr. 2012; ; 31 : :735.–740. 19.
Verdam FJ, Fuentes S, de Jonge C, et al. Human intestinal microbiota composition is associated with local and systemic inflammation in obesity . Obesity (Silver Spring). 2013; ; 21 : :E607.–E615. 20.
Gummesson A, Carlsson LM, Storlien LH, et al. Intestinal permeability is associated with visceral adiposity in healthy women . Obesity (Silver Spring). 2011; ; 19 : :2280.–2282. 21.
Savassi-Rocha AL, Diniz MT, Vilela EG, et al. Changes in intestinal permeability after Roux-en-Y gastric bypass . Obes Surg. 2014; ; 24 : :184.–190. 22.
Casselbrant A, Elias E, Fandriks L, Wallenius V. Expression of tight-junction proteins in human proximal small intestinal mucosa before and after Roux-en-Y gastric bypass surgery . Surg Obes Relat Dis. 2015; ; 11 : :45.–53. 23.
Burcelin R, Chabo C, Blasco-Baque V, et al. Le microbiote intestinal à l’originr de nouvelles perspectives thérapeutiques pour les maladies métaboliques ? . Med Sci (Paris). 2013; ; 29 : :800.–806. 24.
Cerf-Bensussan N, Gaboriau-Routhiau V. The immune system and the gut microbiota: friends or foes? . Nat Rev Immunol. 2010; ; 10 : :735.–744. 25.
Ding S, Chi MM, Scull BP, et al. High-fat diet: bacteria interactions promote intestinal inflammation which precedes and correlates with obesity and insulin resistance in mouse . PLoS One. 2010; ; 5 : :e12191.. 26.
Turnbaugh PJ, Ley RE, Mahowald MA, et al. An obesity-associated gut microbiome with increased capacity for energy harvest . Nature. 2006; ; 444 : :1027.–1031. 27.
Turnbaugh PJ, Hamady M, Yatsunenko T, et al. A core gut microbiome in obese and lean twins . Nature. 2009; ; 457 : :480.–484. 28.
Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Microbial ecology: human gut microbes associated with obesity . Nature. 2006; ; 444 : :1022.–1023. 29.
Wu GD, Chen J, Hoffmann C, et al. Linking long-term dietary patterns with gut microbial enterotypes . Science. 2011; ; 334 : :105.–108. 30.
Cani PD, Amar J, Iglesias MA, et al. Metabolic endotoxemia initiates obesity and insulin resistance . Diabetes. 2007; ; 56 : :1761.–1772. 31.
Amar J, Chabo C, Waget A, et al. Intestinal mucosal adherence and translocation of commensal bacteria at the early onset of type 2 diabetes: molecular mechanisms and probiotic treatment . EMBO Mol Med. 2011; ; 3 : :559.–572. 32.
Gonzalez-Quintela A, Alonso M, Campos J, et al. Determinants of serum concentrations of lipopolysaccharide-binding protein (LBP) in the adult population: the role of obesity . PLoS One. 2013; ; 8 : :e54600.. 33.
Moreno-Navarrete JM, Ortega F, Serino M, et al. Circulating lipopolysaccharide-binding protein (LBP) as a marker of obesity-related insulin resistance . Int J Obes. 2012; ; 36 : :1442.–1449. 34.
Sun L, Yu Z, Ye X, et al. A marker of endotoxemia is associated with obesity and related metabolic disorders in apparently healthy Chinese . Diabetes Care. 2010; ; 33 : :1925.–1932. 35.
Clemente-Postigo M, Roca-Rodriguez Mdel M, Camargo A, et al. Lipopolysaccharide and lipopolysaccharide-binding protein levels and their relationship to early metabolic improvement after bariatric surgery . Surg Obes Relat Dis. 2015; ; 11 : :933.–939. 36.
Erridge C, Attina T, Spickett CM, Webb DJ. A high-fat meal induces low-grade endotoxemia: evidence of a novel mechanism of postprandial inflammation . Am J Clin Nutr. 2007; ; 86 : :1286.–1292. 37.
Vors C, Pineau G, Drai J, et al. Postprandial endotoxemia linked with chylomicrons and lipopolysaccharides handling in obese versus lean men: a lipid dose-effect trial . J Clin Endocrinol Metab. 2015; ; 100 : :3427.–3435. 38.
Fasano A. Zonulin and its regulation of intestinal barrier function: the biological door to inflammation, autoimmunity, and cancer . Physiol Rev. 2011; ; 91 : :151.–175. 39.
Moreno-Navarrete JM, Sabater M, Ortega F, et al. Circulating zonulin, a marker of intestinal permeability, is increased in association with obesity-associated insulin resistance . PLoS One. 2012; ; 7 : :e37160.. 40.
Peng L, Li ZR, Green RS, et al. Butyrate enhances the intestinal barrier by facilitating tight junction assembly via activation of AMP-activated protein kinase in Caco-2 cell monolayers . J Nutr. 2009; ; 139 : :1619.–1625. 41.
Delzenne NM, Neyrinck AM, Backhed F, Cani PD. Targeting gut microbiota in obesity: effects of prebiotics and probiotics . Nat Rev Endocrinol. 2011; ; 7 : :639.–646. 42.
Dewulf EM, Cani PD, Claus SP, et al. Insight into the prebiotic concept: lessons from an exploratory, double blind intervention study with inulin-type fructans in obese women . Gut. 2013; ; 62 : :1112.–1121. 43.
Delzenne NM, Cani PD. Interaction between obesity and the gut microbiota: relevance in nutrition . Annu Rev Nutr. 2011; ; 31 : :15.–31. 44.
Sabate JM, Jouet P, Harnois F, et al. High prevalence of small intestinal bacterial overgrowth in patients with morbid obesity: a contributor to severe hepatic steatosis . Obes Surg. 2008; ; 18 : :371.–377. 45.
Desseyn JL, Gouyer V, Gottrand F. Modification à façon des propriétés physiques du mucus . Med Sci (Paris). 2015; ; 31 : :1063.–1066. |