| |
| Med Sci (Paris). 32(5): 491–496. doi: 10.1051/medsci/20163205016.L’AMPK, régulateur de l’énergie et des fonctions des spermatozoïdes Thi Mong Diep Nguyen,1,2,3 Pascal Froment,1,2 Yves Combarnous,1,2 and Élisabeth Blesbois1,2* 1INRA, UMR85 CNRS, UMR7247, Physiologie de la reproduction et des comportements, F-37380Nouzilly, France 2Université de Tours François Rabelais, F-37000Tours, France 3Quy Nhon university, VietNam |

Vignette (Photo © Inserm-Frédérique Koulikoff). Les spermatozoïdes sont des cellules spécialisées. Leur principale fonction est de transporter en toute sécurité le génome du père pour qu’il puisse fusionner avec celui de la mère au cours de la fécondation. Pour y parvenir, dans les espèces à fécondation interne, les spermatozoïdes ont besoin de beaucoup d’énergie pour assurer leur mobilité tout au long du parcours dans les voies génitales mâles puis femelles, et pour, ensuite, réussir leur réaction acrosomique1 sur le site de fécondation et leur pénétration dans l’ovocyte. L’AMPK (5’adenosine monophosphate-activated protein kinase) contrôle l’homéostasie énergétique en stimulant les voies productrices d’ATP et en inhibant les voies qui en consomment [1]. Présente dans différents compartiments subcellulaires des spermatozoïdes [2–4], l’AMPK pourrait impacter les fonctions biologiques des gamètes. |
Structure et expression de l’AMPK Parmi les protéines de signalisation ayant un fort impact sur la régulation des fonctions des cellules somatiques et germinales, l’AMPK est un senseur clé du métabolisme énergétique cellulaire qui participe à de multiples cascades de kinases. Cette sérine-thréonine protéine kinase a été conservée tout au long de l’évolution des eucaryotes, de la levure aux mammifères [5]. L’AMPK est un complexe hétérotrimérique formé d’une sous-unité catalytique α et de deux sous-unités régulatrices, β et γ [6]. Des gènes homologues codant les différentes sous-unités de l’AMPK ont été identifiés chez toutes les espèces animales dont le génome a été séquencé [7]. Les trois sous-unités présentent plusieurs isoformes (α1, α2, β1, β2, γ1, γ2, et γ3) qui sont codées par sept gènes dont certains subissent des épissages alternatifs, aboutissant ainsi à une diversité importante d’hétérotrimères [8]. Les différentes isoformes permettent la formation de 12 complexes (βαγ) différents. L’AMPK participe à la détection et au contrôle de l’équilibre énergétique cellulaire de l’ensemble de l’organisme par sa sensibilité à l’AMP et à l’ADP. Son activité est régulée allostériquement par la liaison de l’AMP/ADP ou de l’ATP à la sous-unité régulatrice γ [1, 9, 10], par la phosphorylation de la sous-unité α, sur la thréonine 172, par une AMPK kinase [11] - dont STK11 (serine/threonine kinase 11) aussi appelée LKB1 (liver kinase B1) ou CaMKKβ (calmodulin-dependent kinase-β) - et sa déphosphorylation par les phosphatases (protein phosphatase-2 [PP2A ou PP2C]). L’activation de l’AMPK permet de compenser la perte d’ATP en stimulant des mécanismes cataboliques et en inhibant des mécanismes anaboliques (Figure 1). Régulateur majeur de l’énergie aux niveaux cellulaire, tissulaire et corporel, l’AMPK participe à la régulation des métabolismes lipidiques, glucidiques et protéiques de tous les tissus. Au niveau central (hypothalamus), la kinase est impliquée dans la régulation des dépenses énergétiques et de la prise alimentaire [12]. Elle a aussi été localisée dans les tissus reproducteurs mâle et femelle. En plus de sa sensibilité aux hormones et aux cytokines, dont certaines impliquées dans la reproduction, l’AMPK peut moduler la synthèse des hormones stéroïdiennes gonadiques en contrôlant le niveau de cholestérol et l’expression des enzymes de la stéroïdogenèse. Au cours des dernières années, son implication a été mise en évidence dans la reproduction, chez la femelle [13–17]. La démonstration, plus récente, de la présence d’AMPK au niveau de la gonade mâle et des spermatozoïdes de plusieurs espèces a permis d’aborder son rôle dans la reproduction chez le mâle [2, 3, 18–23], rôle que nous allons préciser ci-après.
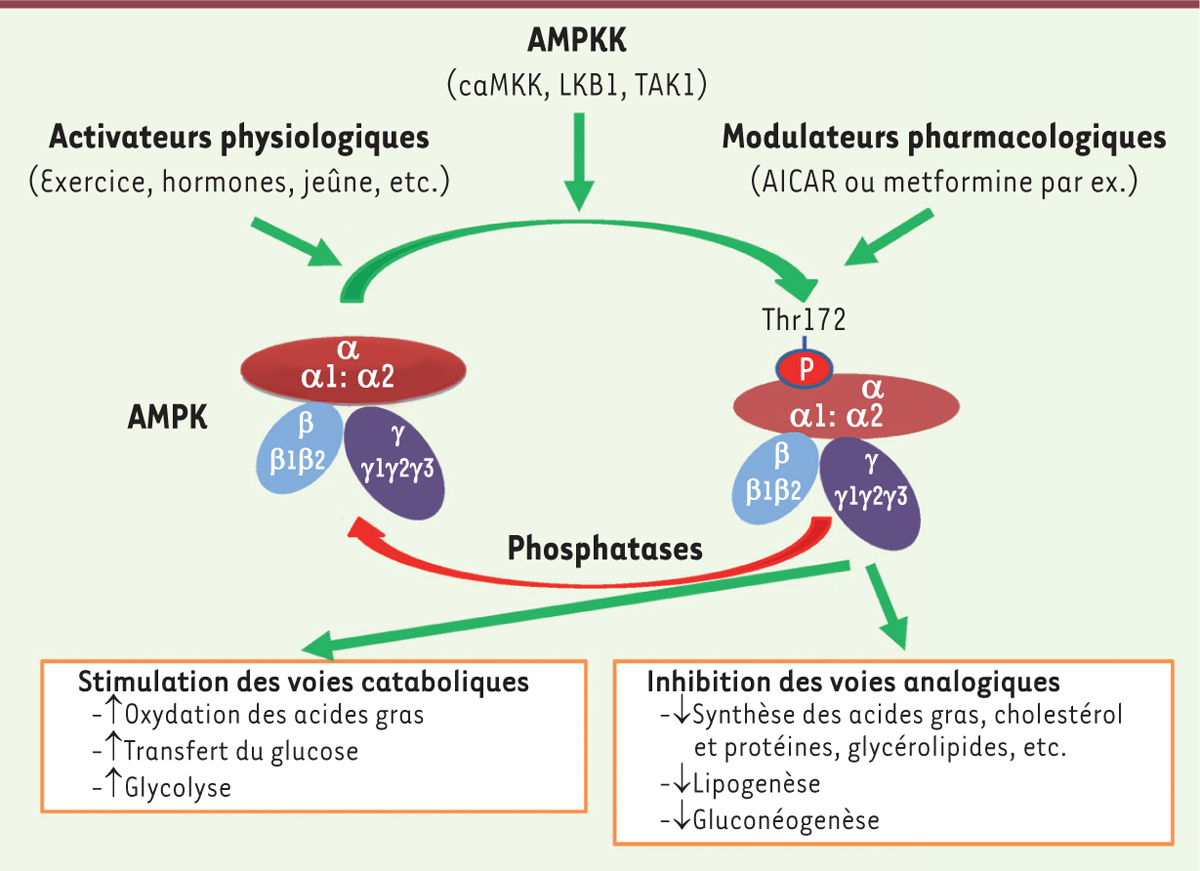
 | Figure 1.
Régulation et rôles de l’AMPK. L’AMPK est un complexe hétérotrimérique formé d’une sous-unité catalytique α et de deux sous-unités régulatrices β et γ. L’AMPK phosphorylée au niveau de la thréonine 172 stimule les voies cataboliques, productrices d’ATP, et inhibe les voies anaboliques, consommatrices d’ATP. L’AMPK peut être activée par plusieurs facteurs comme les activateurs physiologiques, les modulateurs pharmacologiques, ou une autre kinase (dont LKB1, CaMKK et TAK1), et déphosphorylée par les phosphatases PP2A ou PP2C (figure adaptée de [ 46]). AMPKK : AMPK kinase ; LKB1 : liver kinase B1 ; CaMKK : Ca2+/calmodulin-dependent protein kinase kinase ; TAK1 : TGF-activated kinase-1 ; AICAR : acadésine ; PP2 : protein phosphatase 2. |
|
Localisation de l’AMPK dans la gonade mâle et les spermatozoïdes L’AMPK a été identifiée pour la première fois dans le testicule de rat [18], plus précisément dans les cellules germinales en cours de spermatogenèse, dans les cellules de Leydig2, et dans les cellules de Sertoli3 [19–21]. Dans les cellules de Sertoli, la voie de signalisation AMPK/mTOR (mammalian target of rapamycin) participe à la régulation de l’autophagie et de l’apoptose induite par des substances toxiques [24]. Plus récemment, la présence de l’AMPK, notamment sous sa forme active, phosphorylée sur la thréonine 172 (phospho-AMPK-Thr172), a été mise en évidence dans les spermatozoïdes de verrat4,, d’étalon, de souris et de coq [2–4]. Chez le verrat, la forme phospho-AMPK est principalement localisée dans l’acrosome et le sous-segment équatorial de la tête ainsi que dans la pièce intermédiaire du spermatozoïde [2]. Chez l’étalon, la phospho-AMPK est retrouvée au niveau de la pièce principale du flagelle et de la région subéquatoriale de la tête [3]. Chez le coq, l’AMPK est principalement localisée dans l’acrosome, la pièce intermédiaire et l’ensemble du flagelle, mais sa forme phosphorylée est surtout présente dans le flagelle et l’acrosome et, avec une intensité beaucoup plus faible, dans la pièce intermédiaire [4]. Cette localisation au niveau du flagelle et de l’acrosome suggère donc des rôles importants de l’AMPK dans la mobilité et dans la réaction acrosomique. Néanmoins, les relations entre les différences de localisation subcellulaire de l’AMPK selon les espèces et les spécificités biologiques des spermatozoïdes n’ont pas encore été définies. À noter qu’en 2013, l’AMPK a également été mise en évidence chez des invertébrés, dans les cellules germinales mâles et femelles d’huître où elle est impliquée dans le métabolisme du glucose et des acides gras [25]. |
Rôle de l’AMPK dans la gonade mâle et la production spermatique Chez les mammifères, le système reproducteur mâle comprend les testicules et les voies génitales mâles composées de l’épididyme, des canaux déférents et glandes accessoires, et finalement du pénis. Une coordination parfaite est nécessaire pour le bon déroulement de la spermatogenèse puis, en post-testiculaire, de la maturation des spermatozoïdes. Ces étapes sont contrôlées, au niveau central, par le système hypothalamo-hypophysaire par l’action des gonadotropines [26]. Les testicules sont tout d’abord responsables de la production des spermatozoïdes (spermatogenèse) mais ils sont également le siège de la synthèse, stimulée par les gonadotropines, des hormones stéroïdes sexuelles (stéroïdogenèse) [27, 28] qui contrôlent les caractères physiologiques et comportementaux de la reproduction. Plusieurs auteurs ont récemment étudié l’activité de l’AMPK dans les différents types de cellules testiculaires. Dans les testicules de rats, l’activité totale de l’AMPK repose principalement sur l’AMPKα1 [18]. Les spermatides de rongeurs possèdent une isoforme spécifique de LKB1, l’AMPK kinase impliquée dans l’activation de l’AMPK, la LKB1S, illustrant l’importance de cette voie dans la fertilité masculine. Ainsi, chez les souris dont le gène LKB1 a été délété (LKB1 KO [knock-out]), l’absence de la forme courte de la kinase5 entraîne une diminution de la spermatogenèse avec pour conséquence une réduction du nombre de spermatozoïdes matures dans l’épididyme et une augmentation des spermatozoïdes morphologiquement anormaux et non-mobiles [29]. Dans les cellules de Sertoli, qui sont les cellules nourricières de la lignée germinale, l’activation de la voie de l’AMPK conduit, chez le rat et la souris, à une production accrue de lactate, en réponse à une augmentation de l’absorption du glucose et, en conséquence, des niveaux de GLUT1 (transporteur 1 de glucose) et MCT4 (transporteur 4 mono-carboxylate) [19, 30] (→).
(→) Voir la synthèse de L. Tosca et al., m/s n° 3, mars 2008, page 297
Ces données indiquent ainsi que la voie de l’AMPK est également impliquée dans la modulation de la fonction nutritionnelle de la lignée germinale. |
Rôle de l’AMPK dans les fonctions des spermatozoïdes Rôle de l’AMPK dans la qualité des spermatozoïdes L’AMPK est exprimée dans les spermatozoïdes. Chez le coq, son activation pharmacologique influence la mobilité et la réaction acrosomique des spermatozoïdes ainsi que leur capacité à réussir la fécondation [ 4, 22]. L’AMPK participe également à l’organisation de la membrane plasmique des spermatozoïdes. Son inhibition induit en effet une désorganisation des lipides de la membrane plasmique et une réduction de la translocation de la phosphatidylsérine vers la surface externe des spermatozoïdes [ 2]. Ces différentes observations ont conduit à envisager que l’AMPK était impliquée dans les fonctions des spermatozoïdes de mammifères à différents niveaux. Tartarin et al. ont étudié le rôle de cette kinase sur la fonction reproductrice mâle chez des souris KO pour l’AMPKα1 [ 21]. Ces auteurs ont rapporté une réduction significative de la capacité de ces animaux à féconder en raison d’une asthénozoospermie (défaut de mobilité) et d’un taux important d’anomalies morphologiques (fragilité membranaire de la tête, anomalies des mitochondries) des spermatozoïdes. Toutefois, aucune altération de la morphologie des testicules ou de la production de sperme n’a été observée. Des niveaux élevés d’androgènes, avec une augmentation du cholestérol et de la testostérone intra-testiculaires, ont également été mesurés chez ces animaux, avec, en outre, des niveaux d’hormones gonadotropes hypophysaires (hormone lutéinisante [LH] et hormone folliculo-stimulante [FSH]) plus faibles dans les souris KO, en relation avec l’augmentation des taux de testostérone. L’absence d’activation de l’AMPK semble donc, en augmentant les niveaux d’androgènes, affecter la qualité des spermatozoïdes et leur aptitude à la fécondation [ 21]. La localisation de la forme active phospho-AMPK au niveau du flagelle et/ou de la pièce intermédiaire des spermatozoïdes chez les espèces où elle a été recherchée (verrat, coq) suggère que l’AMPK agit par phosphorylation des substrats protéiques participant au fonctionnement de l’appareil central de l’axonème6 qui sont essentiels pour la mobilité flagellaire. Le mécanisme impliqué pourrait être similaire à celui qui a été mis en évidence pour une AMPK-related kinase des testicules, la TSSK2 (testis-specific serine kinase 2), une Ser/Thr protéine kinase proche de l’AMPK [31]. In vitro, TSKK2 phosphoryle SPAG16L (sperm-associated antigen 16), une protéine de l’appareil central de l’axonème qui est essentielle à la mobilité flagellaire des spermatozoïdes de souris [32]. Chez le coq, en revanche, la phospho-AMPK-Thr-172 est principalement localisée dans le flagelle et la région de l’acrosome, avec une expression réduite dans la pièce intermédiaire [4]. Ces résultats sont en accord avec le fait que la production d’ATP ne se limite pas à la pièce intermédiaire des spermatozoïdes (respiration mitochondriale), mais elle peut également avoir d’autres origines via la glycolyse anaérobie [33, 34]. La répartition différente de l’AMPK suggère qu’elle peut favoriser selon les espèces, à la fois la mobilité des spermatozoïdes et leur réaction acrosomique [4]. Rôle de l’AMPK dans la gestion de la peroxydation lipidique et des enzymes antioxydantes L’AMPK semble participer aux mécanismes conduisant à la production de radicaux libres de l’oxygène (ROS). Bien qu’il reste encore des facteurs inconnus ou des difficultés à évaluer leur importance, l’objectif de nombreuses recherches est de prévenir ou de neutraliser les effets délétères de ces radicaux responsables de nombreux dommages moléculaires et cellulaires. Ils sont impliqués dans de nombreuses affections (sclérose latérale amyotrophique, cancer, athérosclérose, maladies cardiovasculaires, diabète, Alzheimer) et de nombreuses maladies inflammatoires. Dans les formes de diabète où l’activité de l’AMPK est très altérée, la réactivation de la kinase pourrait ainsi contrecarrer les effets négatifs du stress oxydatif lié à cette maladie métabolique [ 35]. Dans un modèle murin de diabète de type II, un activateur de l’AMPK, le resvératrol, permet en effet de diminuer la production d’anion superoxyde et la carbonylation 7 des protéines par un mécanisme qui dépend de la kinase [ 36]. De même, chez la souris obèse Ob/Ob soumise au régime gras, mais également chez l’homme, la metformine réduit la stéatose hépatique non alcoolique [ 37], un effet qui dépendrait de l’activation de l’AMPK, secondaire à l’inhibition du complexe I de la chaîne respiratoire et à la carence énergétique ainsi engendrée. Un effet « antioxydant » de l’AMPK a été mis en évidence dans différents modèles, en particulier, dans les cellules d’adénocarcinome du poumon déficientes en LKB1, les cellules de la lignée A549. Dans ce modèle, l’AMPK semble augmenter les niveaux de NADPH (nicotinamide adénine dinucléotide phosphate) intracellulaire par différents mécanismes : l’activation de l’oxydation des acides gras et l’inhibition de la synthèse des acides gras pour neutraliser les ROS cytotoxiques [38]. Dans la fonction reproductrice mâle, un lien entre mécanismes antioxydants et AMPK a également été décrit. Ainsi, dans les testicules de rats diabétiques et obèses, la metformine permet de réduire les niveaux de peroxydation des lipides (LPO) avec, associées, une stimulation de la stéroïdogenèse, une restauration de la spermatogenèse, et une augmentation de la concentration des spermatozoïdes et de leur motilité [39, 40]. Au cours des dernières années, l’implication de l’AMPK dans la régulation des concentrations de ROS ou de LPO, ainsi que dans l’activité des principales enzymes antioxydantes présentes au niveau des spermatozoïdes, a été mise en évidence [41]. Chez le coq, l’ajout, avant cryoconservation de sperme, d’activateur de l’AMPK (metformine ou AICAR [acadesine]), permet ainsi d’augmenter la phosphorylation de la kinase après décongélation tout en diminuant la production de LPO et de ROS. Simultanément, l’AICAR et la metformine augmentent l’activité des enzymes antioxydantes - superoxyde dismutase (SOD), glutathione peroxidase (GPx) et glutathione réductase (GR) - dans la semence cryopréservée. Cependant, les mécanismes par lesquels les activateurs de l’AMPK pourraient agir sur les systèmes d’enzymes antioxydantes dans les spermatozoïdes sont encore mal connus. Pourtant, l’AMPK est impliquée dans le renouvellement du contenu mitochondrial des cellules. Elle stimule en effet la dégradation des mitochondries défectueuses par l’intermédiaire d’ULK1/2 (Unc51-like kinase), une kinase associée au processus d’autophagie, et en activant la biogenèse de nouvelles mitochondries, via PGC1α (peroxisome proliferator-activated receptor γ coactivator 1a) impliqué dans leur régulation, et donc, indirectement, les systèmes antioxydants [42, 43]. Mais la stimulation de la régénération du NADPH par l’AMPK [44], par la voie des pentoses phosphates, mise en évidence dans les spermatozoïdes de mammifères, et qui contribue au système antioxydant par la stimulation de la GPx (NADPH-dependent glutathione peroxidase-like protein), pourrait également avoir un rôle dans cette fonction. Ces données pourraient être d’une grande utilité pour développer et améliorer les méthodes utilisées pour la manipulation et le stockage du sperme. Par ailleurs, les effets positifs de la stimulation de l’AMPK sur les fonctions des spermatozoïdes sont conservés après cryopréservation (chez le coq et la souris), ce qui conforte l’hypothèse de son rôle « protecteur » après exposition des gamètes aux conditions de stress thermique et osmotique extrêmes auxquels ils sont confrontés au cours du processus de congélation/décongélation du sperme [23, 41]. L’AMPK des spermatozoïdes : un lien entre métabolisme énergétique et fertilité L’énergie des spermatozoïdes délivrée sous la forme d’ATP, est obtenue principalement à partir des voies métaboliques aérobies (impliquant le cycle de Krebs et la phosphorylation oxydative) et/ou anaérobies, par glycolyse anaérobie. Les voies métaboliques des spermatozoïdes sont localisées principalement dans les mitochondries (cycle de Krebs, phosphorylation oxydative), le cytoplasme, la gaine fibreuse du flagelle et l’acrosome [45]. L’AMPK contribue à réguler le potentiel de membrane mitochondriale dans les spermatozoïdes, chez le verrat [2] et la souris [21]. Chez le coq, une production d’ATP et de lactate a pu être observée dans les spermatozoïdes après stimulation par des activateurs pharmacologiques de l’AMPK (metformine ou AICAR) [4, 41]. L’AICAR stimule également la production de citrate, un intermédiaire du cycle de Krebs. Dans le cas particulier de la cryopréservation, de nombreux spermatozoïdes meurent ou sont incapables de se mouvoir, après décongélation, en raison des altérations du flagelle ou de la pièce intermédiaire, ou parce qu’ils sont incapables de réussir la réaction acrosomique. Toutes ces altérations ont pour conséquence une diminution de leur fertilité. Dans ces conditions particulières, les spermatozoïdes nécessitent une quantité très importante d’énergie pour restaurer leur pouvoir fécondant. L’ajout de metformine ou d’AICAR avant cryoconservation permettrait donc de restaurer une partie de cette énergie nécessaire, en stimulant le métabolisme anaérobie et, pour l’AICAR, le métabolisme aérobie [41]. L’AMPK est donc essentielle pour maintenir, dans les spermatozoïdes, un niveau d’énergie qui est nécessaire pour la conduite de la fécondation, en particulier en conditions « stressantes ». |
L’ensemble de ces données suggère donc un rôle important de l’AMPK dans le développement de la gonade mâle et la production spermatique (Figure 2). Cette kinase participe également aux fonctions des spermatozoïdes (Figure 3) (mobilité et réaction acrosomique), mais aussi aux capacités énergétiques et d’oxydo-réduction qui régulent les processus cellulaires essentiels à la réussite de la fécondation. Son rôle dans la régulation des défenses antioxydantes de la cellule a des conséquences sur les capacités de conservation in vitro comme dans le cas de la congélation de semence. Plus généralement, l’AMPK pourrait devenir une cible thérapeutique en vue de limiter les infertilités et améliorer les biotechnologies utilisées pour l’insémination artificielle et la conservation de semence. D’autres travaux seront néanmoins nécessaires pour étudier l’implication de l’AMPK dans la fonction reproductrice chez l’homme.
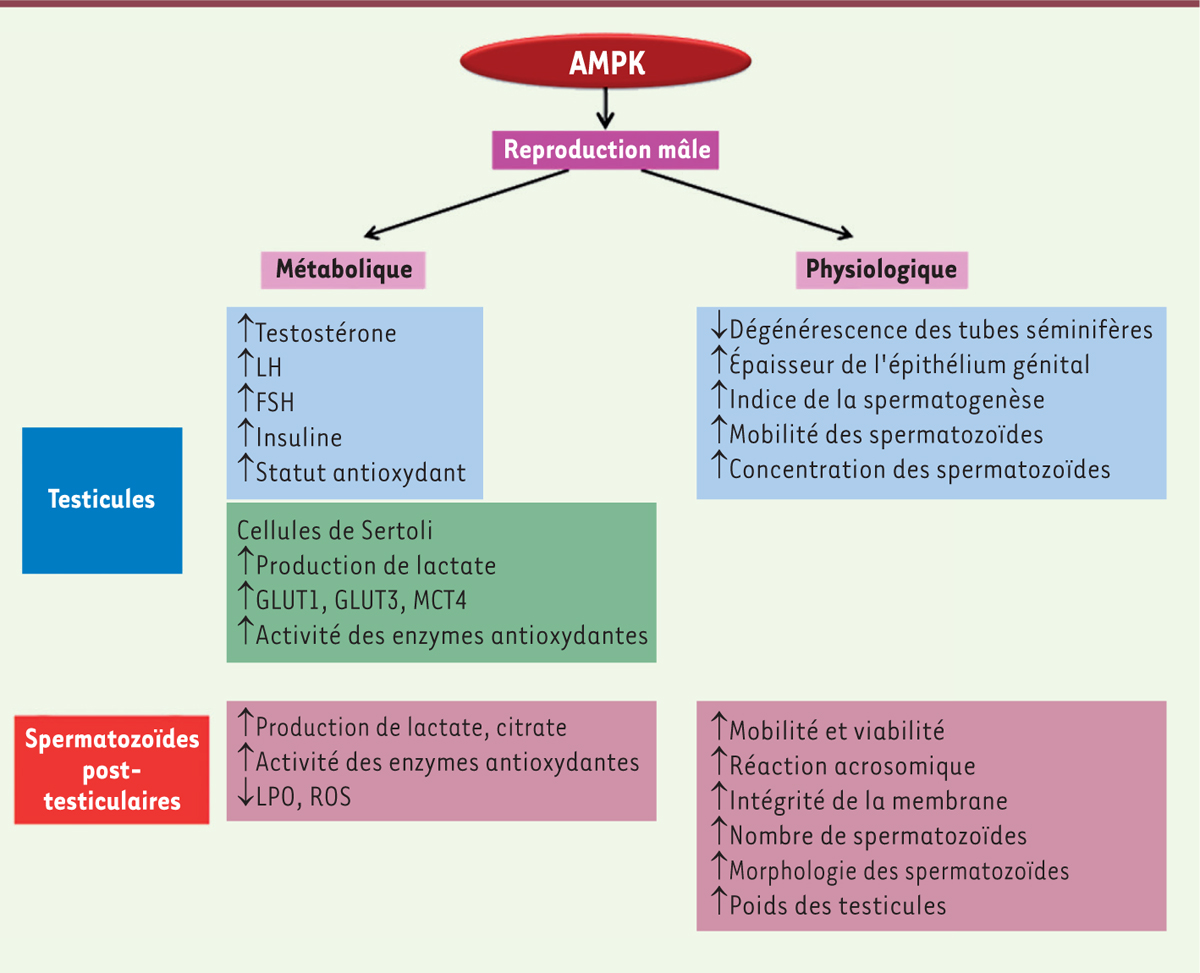
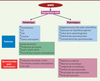 | Figure 2.
Schéma de la régulation de l’activité de l’AMPK dans la reproduction mâle. Le schéma représente un résumé des actions de l’AMPK dans le système de la reproduction mâle (testicules, cellules de Sertoli, spermatozoïdes). LH : hormone lutéinisante ; FSH : hormone folliculo-stimulante ; GLUT : transporteur de glucose ; MCT : transporteur monocarboxylate ; ROS : radicaux libres de l’oxygène ; LPO : peroxydation des lipides. ↑ : augmentation, ↓ : diminution. |
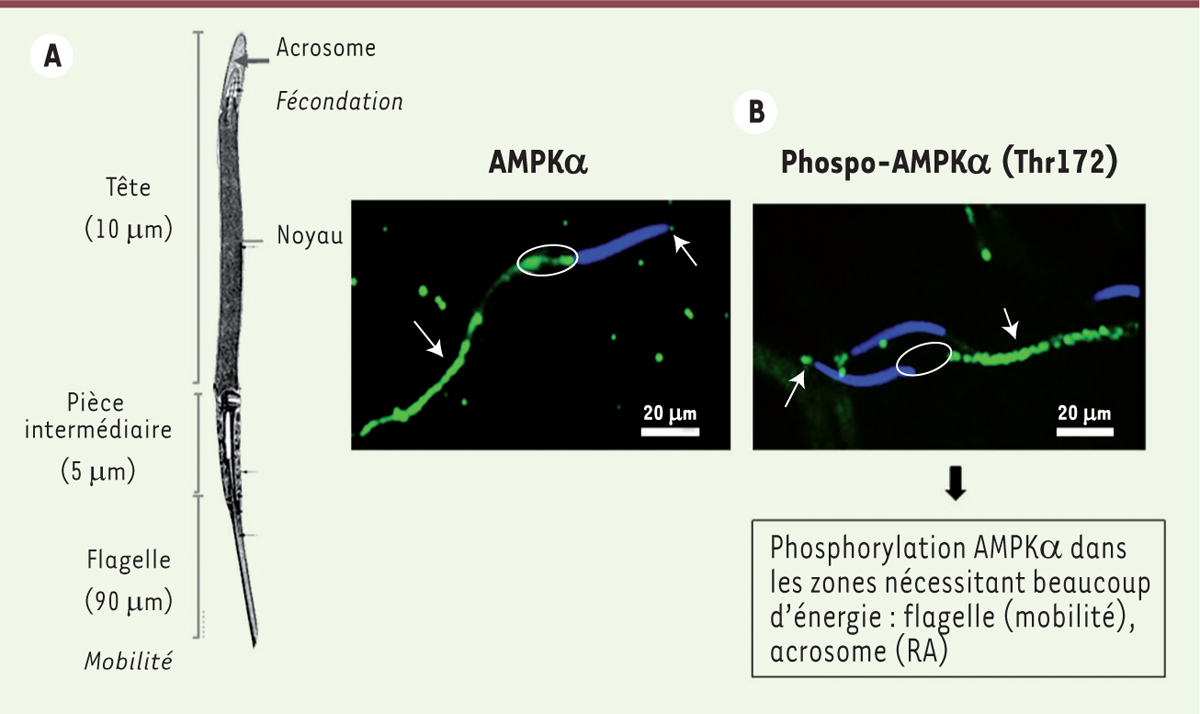
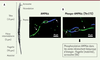 | Figure 3.
L’AMPK dans le spermatozoïde de coq : un lien entre localisation et fonction. A. Ultrastructure d’un spermatozoïde de coq (d’après [ 47]). B. Localisation de l’AMPK (à gauche) de la phospho-AMPK (Thr172) (à droite) dans le spermatozoïde de coq (d’après [ 48]). En bleu apparaissent les noyaux, en vert la phospho-AMPK et l’AMPK. Les flèches indiquent les régions contenant la phospho-AMPK et l’AMPK ; les cercles, des régions où seule la forme non phosphorylée est présente. RA : réaction acrosomique. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Hardie DG, Hawley SA, Scott JW. AMP-activated protein kinase-development of the energy sensor concept . J Physiol. 2006; ; 574 : :7.–15. 2.
Hurtado de Llera A, Martin-Hidalgo D, Rodriguez-Gil JE, et al. AMP-activated kinase, AMPK, is involved in the maintenance of plasma membrane organization in boar spermatozoa . Biochim Biophys Acta. 2013; ; 1828 : :2143.–2151. 3.
Cordova A, Strobel P, Vallejo A, et al. Use of hypometabolic TRIS extenders and high cooling rate refrigeration for cryopreservation of stallion sperm: presence and sensitivity of 5’ AMP-activated protein kinase (AMPK) . Cryobiology. 2014; ; 69 : :473.–481. 4.
Nguyen TMD, Alves S, Grasseau I, et al. Central role of 5’-AMP-activated protein kinase in chicken sperm functions . Biol Reprod. 2014; ; 91 : :121.. 5.
Hardie DG. The AMP-activated protein kinase cascade: the key sensor of cellular energy status . Endocrinology. 2003; ; 144 : :5179.–5183. 6.
Wong KA, Lodish HF. A revised model for AMP-activated protein kinase structure: the alpha-subunit binds to both the beta- and gamma-subunits although there is no direct binding between the beta- and gamma-subunits . J Biol Chem. 2006; ; 281 : :36434.–36442. 7.
Hardie DG, Scott JW, Pan DA, et al. Management of cellular energy by the AMP-activated protein kinase system . FEBS Lett. 2003; ; 546 : :113.–120. 8.
Stapleton D, Mitchelhill KI, Gao G, et al. Mammalian AMP-activated protein kinase subfamily . J Biol Chem. 1996; ; 271 : :611.–614. 9.
Scott JW, Hawley SA, Green KA, et al. CBS domains form energy-sensing modules whose binding of adenosine ligands is disrupted by disease mutations . J Clin Invest. 2004; ; 113 : :274.–284. 10.
Towler MC, Hardie DG. AMP-activated protein kinase in metabolic control and insulin signaling . Circ Res. 2007; ; 100 : :328.–341. 11.
Carling D, Sanders MJ, Woods A. The regulation of AMP-activated protein kinase by upstream kinases . Int J Obes (Lond). 2008; ; 32 : :S55.–S59. 12.
Minokoshi Y, Alquier T, Furukawa N, et al. AMP-kinase regulates food intake by responding to hormonal and nutrient signals in the hypothalamus . Nature. 2004; ; 428 : :569.–574. 13.
Carattino MD, Edinger RS, Grieser HJ, et al. Epithelial sodium channel inhibition by AMP-activated protein kinase in oocytes and polarized renal epithelial cells . J Biol Chem. 2005; ; 280 : :17608.–17616. 14.
Tosca L, Froment P, Solnais P, et al. Adenosine 5’-monophosphate-activated protein kinase regulates progesterone secretion in rat granulosa cells . Endocrinology. 2005; ; 146 : :4500.–4513. 15.
Tosca L, Crochet S, Ferre P, et al. AMP-activated protein kinase activation modulates progesterone secretion in granulosa cells from hen preovulatory follicles . J Endocrinol. 2006; ; 190 : :85.–97. 16.
Tosca L, Chabrolle C, Uzbekova S, et al. Effects of metformin on bovine granulosa cells steroidogenesis: possible involvement of adenosine 5’ monophosphate-activated protein kinase (AMPK) . Biol Reprod. 2007; ; 76 : :368.–378. 17.
Stricker SA, Swiderek L, Nguyen T. Stimulators of AMP-activated kinase (AMPK) inhibit seawater- but not cAMP-induced oocyte maturation in a marine worm: implications for interactions between cAMP and AMPK signaling . Mol Reprod Dev. 2010; ; 77 : :497.–510. 18.
Cheung PC, Salt IP, Davies SP, et al. Characterization of AMP-activated protein kinase gamma-subunit isoforms and their role in AMP binding . Biochem J. 2000; ; 346 : :659.–669. 19.
Galardo MN, Riera MF, Pellizzari EH, et al. The AMP-activated protein kinase activator, 5-aminoimidazole-4-carboxamide-1-b-D-ribonucleoside, regulates lactate production in rat Sertoli cells . J Mol Endocrinol. 2007; ; 39 : :279.–288. 20.
Tanwar PS, Kaneko-Tarui T, Zhang L, et al. Altered LKB1/AMPK/TSC1/TSC2/mTOR signaling causes disruption of Sertoli cell polarity and spermatogenesis . Hum Mol Genet. 2012; ; 21 : :4394.–4405. 21.
Tartarin P, Guibert E, Toure A, et al. Inactivation of AMPKalpha1 induces asthenozoospermia and alters spermatozoa morphology . Endocrinology. 2012; ; 153 : :3468.–3481. 22.
Hurtado de Llera A, Martin-Hidalgo D, Gil MC, et al. AMP-activated kinase AMPK is expressed in boar spermatozoa and regulates motility . PLoS One. 2012; ; 7 : :e38840.. 23.
Bertoldo MJ, Guibert E, Tartarin P, et al. Effect of metformin on the fertilizing ability of mouse spermatozoa . Cryobiology. 2014; ; 68 : :262.–268. 24.
Duan P, Hu C, Quan C, et al. 4-Nonylphenol induces apoptosis, autophagy and necrosis in Sertoli cells: involvement of ROS-mediated AMPK/AKT-mTOR and JNK pathways . Toxicology. 2016 ; :S0300.–483X : 30004-X. 25.
Guevelou E, Huvet A, Galindo-Sanchez CE, et al. Sex-specific regulation of AMP-activated protein kinase (AMPK) in the Pacific oyster Crassostrea gigas . Biol Reprod. 2013; ; 89 : :100.. 26.
Caroppo E. Male reproductive medicine: anatomy and physiology . In : Niederberger I, Craig S. eds. An introduction to male reproductive medicine . New York: : Cambridge University Press; , 2011 : :1.–28. 27.
Rato L, Alves MG, Socorro S, et al. Metabolic regulation is important for spermatogenesis . Nat Rev Urol. 2012; ; 9 : :330.–338. 28.
Alves MG, Rato L, Carvalho RA, et al. Hormonal control of Sertoli cell metabolism regulates spermatogenesis . Cell Mol Life Sci. 2013; ; 70 : :777.–793. 29.
Towler MC, Fogarty S, Hawley SA, et al. A novel short splice variant of the tumour suppressor LKB1 is required for spermiogenesis . Biochem J. 2008; ; 416 : :1.–14. 30.
Tosca L, Chabrolle C, Dupont J. L’AMPK : un lien entre métabolisme et reproduction ? Med Sci (Paris). 2008; ; 24 : :297.–300. 31.
Xu B, Hao Z, Jha KN, et al. Validation of a testis specific serine/threonine kinase [TSSK] family and the substrate of TSSK1 and 2, TSKS, as contraceptive targets . Soc Reprod Fertil. 2007; ; 63 ((suppl)) : :87.–101. 32.
Zhang Z, Kostetskii I, Tang W, et al. Deficiency of SPAG16L causes male infertility associated with impaired sperm motility . Biol Reprod. 2006; ; 74 : :751.–759. 33.
Mukai C, Okuno M. Glycolysis plays a major role for adenosine triphosphate supplementation in mouse sperm flagellar movement . Biol Reprod. 2004; ; 71 : :540.–547. 34.
Takei GL, Miyashiro D, Mukai C, et al. Glycolysis plays an important role in energy transfer from the base to the distal end of the flagellum in mouse sperm . J Exp Biol. 2014; ; 217 : :1876.–1886. 35.
Ceolotto G, Gallo A, Papparella I, et al. Rosiglitazone reduces glucoseinduced oxidative stress mediated by NAD(P)H oxidase via AMPK-dependent mechanism . Arterioscler Thromb Vasc Biol. 2007; ; 27 : :2627.–2633. 36.
Chang CC, Chang CY, Wu YT, et al. Resveratrol retards progression of diabetic nephropathy through modulations of oxidative stress, proinflammatory cytokines, and AMP-activated protein kinase . J Biomed Sci. 2011; ; 18 : :47.. 37.
Viollet B, Guigas B, Sanz Garcia N, et al. Cellular and molecular mechanisms of metformin: an overview . Clin Sci (Lond). 2012; ; 122 : :253.–270. 38.
Jeon SM, Chandel NS, Hay N. AMPK regulates NADPH homeostasis to promote tumour cell survival during energy stress . Nature. 2012; ; 485 : :661.–665. 39.
Fang X, Xu QY, Jia C, et al. Metformin improves epididymal sperm quality and antioxidant function of the testis in diet-induced obesity rats . Zhonghua Nan Ke Xue. 2012; ; 18 : :146.–149. 40.
Nasrolahi O, Khaneshi F, Rahmani F, et al. Honey and metformin ameliorated diabetes-induced damages in testes of rat; correlation with hormonal changes . Iran J Reprod Med. 2013; ; 11 : :1013.–1020. 41.
Nguyen TMD, Seigneurin F, Froment P, et al. The 5’-AMP-activated protein kinase (AMPK) is involved in the augmentation of antioxidant defenses in cryopreserved chicken sperm . PLoS One. 2015; ; 10 : :e0134420.. 42.
Canto C, Gerhart-Hines Z, Feige JN, et al. AMPK regulates energy expenditure by modulating NAD+ metabolism and SIRT1 activity . Nature. 2009; ; 458 : :1056.–1060. 43.
Aquilano K, Vigilanza P, Baldelli S, et al. Peroxisome proliferator-activated receptor gamma co-activator 1alpha (PGC-1alpha) and sirtuin 1 (SIRT1) reside in mitochondria: possible direct function in mitochondrial biogenesis . J Biol Chem. 2010; ; 285 : :21590.–21599. 44.
Williams AC, Ford WC. Functional significance of the pentose phosphate pathway and glutathione reductase in the antioxidant defenses of human sperm . Biol Reprod. 2004; ; 71 : :1309.–1316. 45.
Ferramosca A, Zara V. Bioenergetics of mammalian sperm capacitation . Biomed Res Int. 2014; ; 2014 : :902953.. 46.
Long YC, Zierath JR. AMP-activated protein kinase signaling in metabolic regulation . J Clin Invest. 2006; ; 116 : :1776.–1783. 47.
De Reviers M., Sauveur B. Appareil génital mâle et production de spermatozoïdes . Reproduction des volailles et production d’œufs . Paris: : Éditions Inra; , 1988 : :141.–180. 48.
Nguyen TM, Alves S, Grasseau I, et al. Central role of 5’-AMP-activated protein kinase in chicken sperm functions . Biol Reprod. 2014; ; 91 : :121.. |