| |
| Med Sci (Paris). 32(6-7): 553–555. doi: 10.1051/medsci/20163206008.Actine et annexine A2 Partenaires essentiels pour le contrôle de la sécrétion neuroendocrine Marion Gabel,1 Franck Delavoie,2 Nicolas Vitale,1 Marie-France Bader,1 and Sylvette Chasserot-Golaz1 1Institut des neurosciences cellulaires et intégratives, CNRS - UPR 3212 et université de Strasbourg, 5, rue Blaise Pascal, F-67084, Strasbourg, France 2Laboratoire de biologie moléculaire eucaryote, UMR5099 CNRS-université de Toulouse III Paul Sabatier, 118, route de Narbonne, F-31000, Toulouse, France MeSH keywords: Actines, Animaux, Annexine A2, Membrane cellulaire, Cytosquelette, Humains, Cellules neuroendocrines, Voie de sécrétion, physiologie, métabolisme, sécrétion, génétique |
Le fonctionnement des systèmes nerveux et neuroendocrine repose sur une communication cellulaire élaborée soutenue par un trafic membranaire intense. Les molécules impliquées dans cette communication sont stockées dans des granules de sécrétion et libérées dans le milieu extracellulaire par fusion des granules avec la membrane plasmique, un processus appelé exocytose régulée [1]. Dans les cellules neuroendocrines, l’arrimage des granules de sécrétion à la membrane plasmique, puis leur fusion, se font au niveau de sites membranaires dont l’architecture est portée par des lipides spécifiques. Ces domaines lipidiques, aussi appelés radeaux lipidiques, correspondent aux sites d’exocytose de la membrane plasmique et peuvent se former de façon transitoire selon l’état d’activation des cellules [2]. Ils recrutent, activent ou séparent les acteurs de l’exocytose comme les protéines du complexe SNARE (soluble N-ethylmaleimide-sensitive factor attachment protein receptor), nécessaires à l’arrimage et à la fusion des granules à la membrane plasmique [3, 4] (→).
(→) Voir la Synthèse de T. Galli et al., m/s n° 11, novembre 2002, page 1113 et la Nouvelle de O. El Far et M. Seagar, m/s n° 1, janvier 2011, page 28
L’annexine A2 a été l’une des premières protéines identifiées au niveau des sites d’exocytose [5]. Elle fait partie de la famille des annexines, protéines capables de s’associer aux membranes biologiques en présence de calcium. Une des particularités de l’annexine A2 est sa capacité à lier simultanément les phospholipides et le cytosquelette d’actine [6], deux acteurs majeurs de l’exocytose. Bien que de nombreuses études aient suggéré un rôle important de l’annexine A2 au cours de l’exocytose, sa fonction précise est restée longtemps énigmatique. Dans des cellules chromaffines1,, modèle classiquement utilisé pour étudier les modalités moléculaires de la sécrétion neuroendocrine, nous avons montré que l’annexine A2 est à l’origine de domaines lipidiques, riches en ganglioside2 GM1 et en phospho-inositides, nécessaires à l’exocytose [7 , 8]. Nos travaux récents révèlent comment l’annexine A2, en établissant un étroit partenariat avec le cytosquelette d’actine, forme des plateformes lipidiques dont le rôle est le recrutement spatio-temporel des différents acteurs de l’exocytose [9]. |
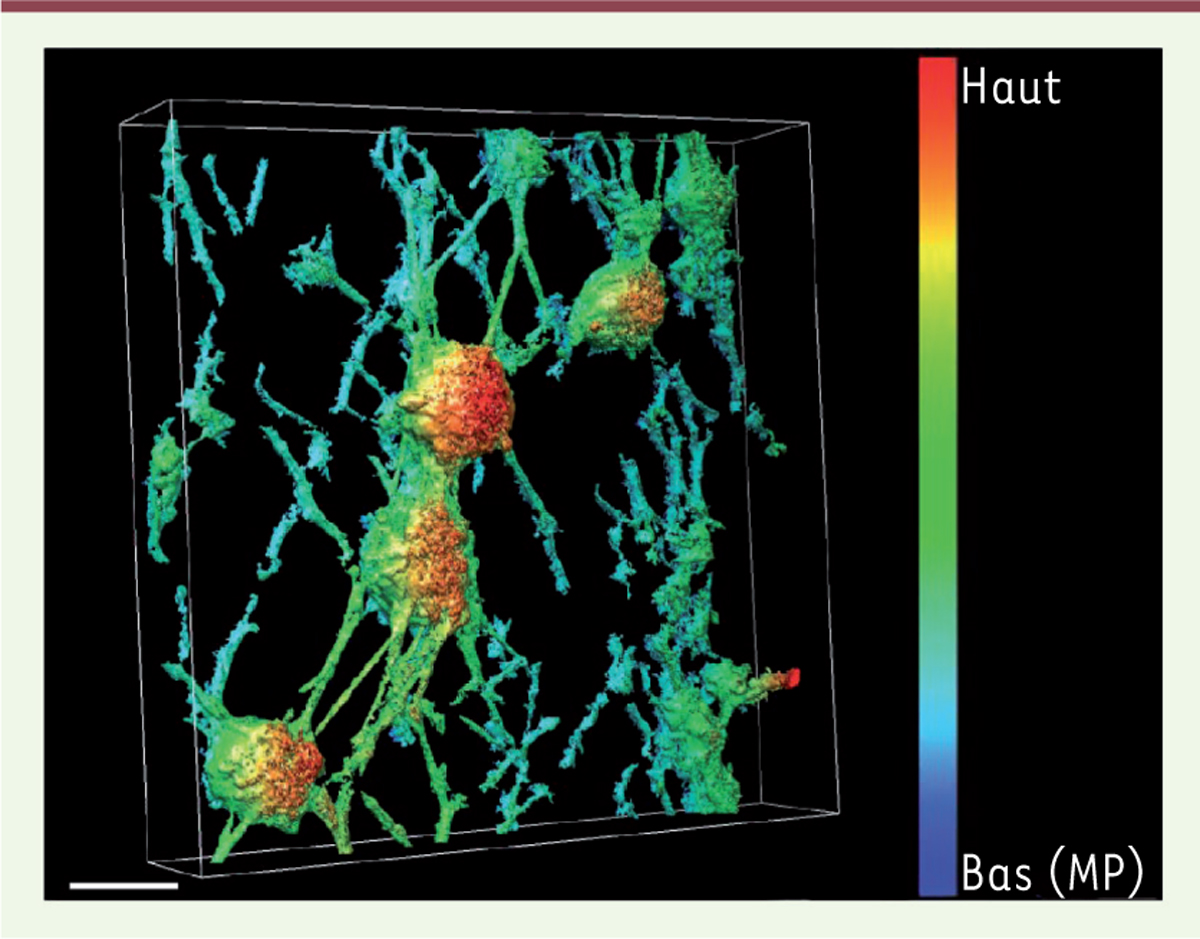
Un nouveau rôle pour le cytosquelette d’actine au cours de la sécrétion neuroendocrine Le cytosquelette d’actine est un acteur majeur de la sécrétion neuroendocrine. Dans les cellules au repos, l’actine forme un réseau dense de filaments, sous la membrane plasmique, qui constitue une barrière physique dont la fonction classique est d’empêcher le recrutement inopiné des granules à la membrane plasmique. Différentes études fonctionnelles, basées sur la détection de filaments d’actine au niveau des sites d’exocytose dans les cellules chromaffines, suggèrent que l’exocytose nécessite aussi une intervention active de l’actine [10]. Nous avons récemment mis au point une technique permettant d’observer au microscope électronique la face cytoplasmique de la membrane plasmique d’une cellule chromaffine en cours d’exocytose. Les images en trois dimensions de ces feuillets membranaires révèlent des granules de sécrétion arrimés à la membrane plasmique par des câbles d’actine au niveau de domaines lipidiques enrichis en ganglioside GM1 (Figure 1). Ces images inédites nous ont permis d’observer pour la première fois l’organisation de l’actine au voisinage des sites d’exocytose. Différentes structures apparaissent : des filaments d’actine parallèles à la membrane plasmique (Figure 1, en bleu) dont le rôle pourrait être de former et/ou de stabiliser la plateforme lipidique ; des filaments de type cordons, plus épais, semblant ancrer le granule à la membrane plasmique (Figure 1, en vert) ; et finalement un manteau d’actine recouvrant partiellement la surface du granule (Figure 1, en rouge). Ces structures d’actine semblent constituer un réseau dynamique autour du granule de sécrétion pour permettre le bon déroulement des différentes étapes de l’exocytose [11]. De fait, la possibilité de mesurer la sécrétion à l’échelle d’un granule par la technique d’ampérométrie3, nous a permis d’obtenir des données fonctionnelles indiquant la participation de l’actine, non seulement au recrutement et à la fusion des granules de sécrétion à la membrane plasmique, mais aussi directement à la libération du contenu granulaire, vraisemblablement en compressant, telle une éponge, les granules ancrés à la membrane.
 | Figure 1.
Organisation du cytosquelette d’actine au niveau des sites d’exocytose dans une cellule chromaffine. Représentation en trois dimensions obtenue par tomographie électronique de granules de sécrétion ancrés à la membrane plasmique dans une cellule chromaffine stimulée par un sécrétagogue. L’échelle de fausses couleurs correspond aux différents plans tomographiques, le plan le plus bas représente la membrane plasmique (MP en bleu). Barre : 100 nm. |
|
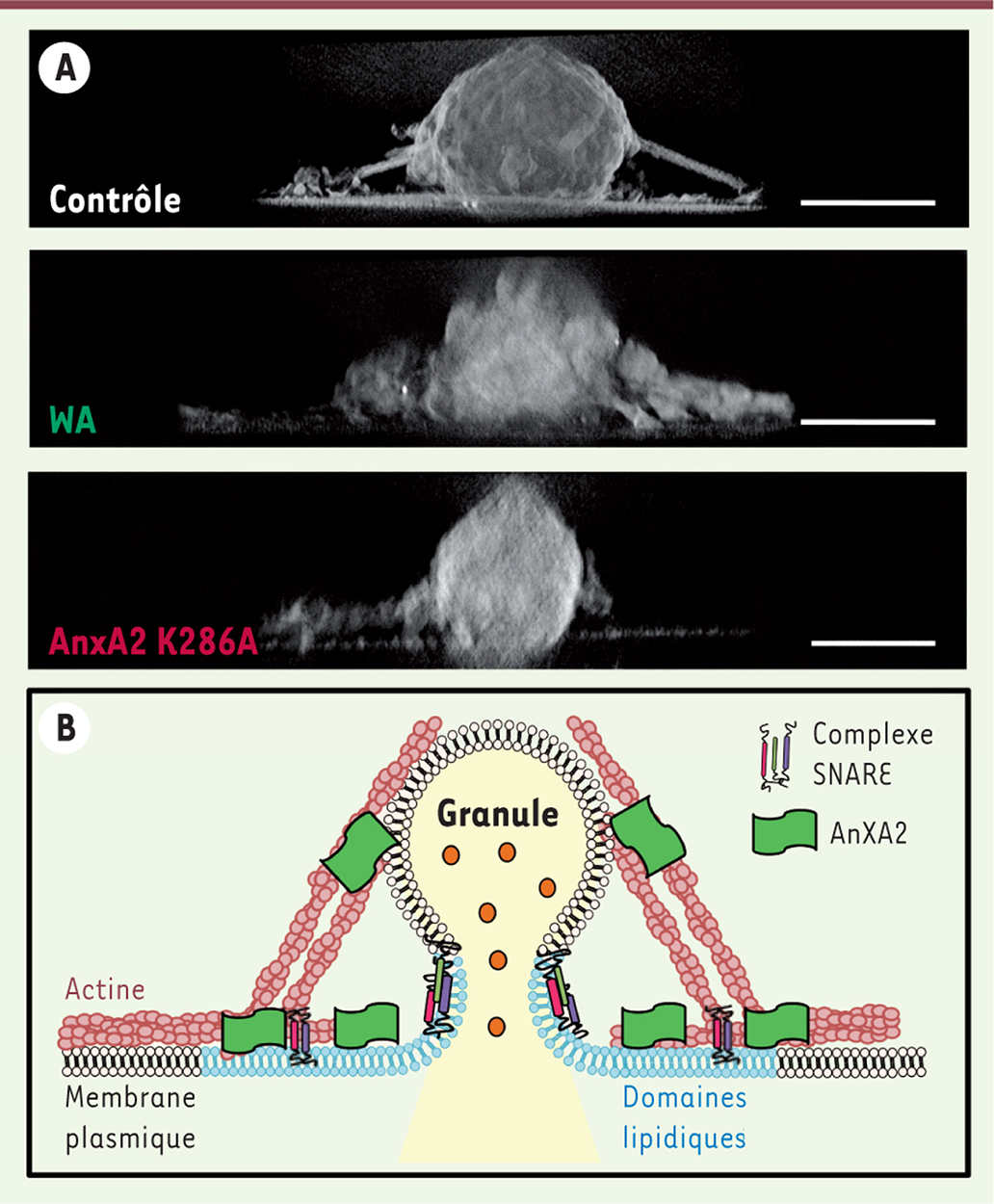
L’annexine A2, protéine-clé pour une mise en place des sites d’exocytose L’annexine A2 est capable, en présence de calcium, d’assembler plusieurs filaments d’actine pour en faire des câbles et des faisceaux. Nous avons donc étudié si cette propriété de fasciculation de l’actine pouvait être en lien avec la formation des plateformes lipidiques nécessaires à la sécrétion. Deux approches complémentaires ont été choisies pour tenter de répondre à cette question : d’une part, une approche pharmacologique utilisant la withaférine A, une lactone extraite de Withania somnifera, généralement utilisée dans le traitement de certains cancers et des troubles neurologiques, et qui stimule l’activité de fasciculation de l’actine de l’annexine A2 ; et d’autre part, une approche génétique basée sur l’expression d’un mutant de l’annexine A2 (AnxA2K286A) incapable de former des faisceaux d’actine. L’observation de feuillets membranaires de cellules chromaffines, exposées à la withaférine A ou exprimant le mutant AnxA2K286A de l’annexine A2, montre que le réseau d’actine au niveau des sites d’exocytose est altéré (Figure 2A). La stimulation de l’activité de fasciculation de l’annexine A2 par la withaférine A épaissit les faisceaux d’actine entourant les granules arrimés à la membrane plasmique. À l’inverse, l’expression du mutant d’annexine A2 dépourvu d’activité de fasciculation produit une désorganisation de l’actine et une disparition des filaments d’ancrage des granules de sécrétion à la membrane plasmique. En parallèle, la formation des domaines lipidiques et l’activité d’exocytose sont modifiées. Une stimulation de la fasciculation de l’actine par l’annexine A2 conduit à une augmentation du nombre de domaines lipidiques et de granules ancrés à la membrane plasmique, et à une accélération de l’étape de fusion. À l’inverse, l’incapacité de l’annexine A2 à former des faisceaux d’actine se traduit par une réduction de la formation de domaines lipidiques et du nombre d’événements d’exocytose. L’activité de fasciculation de l’actine par l’annexine A2 joue ainsi un rôle déterminant dans la mise en place des plateformes lipidiques et la cinétique des étapes de l’exocytose [11].
 | Figure 2.
Formation de faisceaux d’actine par l’annexine A2 au cours de l’exocytose. A. Granules de sécrétion arrimés à la membrane plasmique d’une cellule chromaffine stimulée (contrôle), traitée à la Withaférine A (WA) ou exprimant le mutant de l’annexine A2 (AnxA2 K286A). Vues de profil obtenues par tomographie électronique. Barre : 200 nm. B. Représentation schématique du mode d’action de l’annexine A2 au cours de l’exocytose. |
|
Conclusions et perspectives Cette première description tridimensionnelle des faisceaux d’actine formés par l’annexine A2 au niveau des sites d’exocytose représente une avancée majeure dans la compréhension des étapes ultimes de la sécrétion neuroendocrine. La formation de faisceaux d’actine par l’annexine A2, en limitant possiblement la mobilité et la diffusion latérale dans la membrane plasmique, joue ainsi un rôle essentiel dans la formation des domaines lipidiques, l’assemblage et/ou la maturation des sites d’exocytose (modèle présenté en
Figure 2B
). Cette fonction confère à l’annexine A2 un rôle pivot de régulateur de l’activité sécrétrice et de la libération hormonale. Élucider le rôle de l’annexine A2 dans les circuits de l’exocytose complète nos connaissances des mécanismes de la sécrétion neuroendocrine et de la neurotransmission, et, plus généralement, permet de comprendre les mécanismes de formation et de régulation des domaines lipidiques dans les membranes biologiques. Il est évident que ces mécanismes sont directement couplés au contrôle spatial et temporel de la transduction du signal. La compréhension de la genèse de ces domaines lipidiques au niveau moléculaire représente une avancée majeure en neurobiologie, particulièrement pour le développement de nouvelles stratégies thérapeutiques afin de traiter certaines neuropathologies [13]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Jahn R, Fasshauer D. Molecular machines governing exocytosis of synaptic vesicles . Nature. 2012; ; 490 : :201.–207. 2.
Chamberlain LH, Burgoyne RD, Gould GW. SNARE proteins are highly enriched in lipid rafts in PC12 cells: implications for the spatial control of exocytosis . Proc Natl Acad Sci USA. 2001; ; 98 : :5619.–5624. 3.
Galli T. Martinez-Arca1 S, Paumet F. Mécanisme de la fusion membranaire . Med Sci (Paris). 2002; ; 18 : :1113.–1119. 4.
El Far O, Seagar M. SNARE . V-ATPase et neurotransmission. Med Sci (Paris). 2011; ; 27 : :28.–31. 5.
Nakata T, Sobue K, Hirokawa N. Conformational change and localization of calpactin I complex involved in exocytosis as revealed by quick-freeze, deep-etch electron microscopy and immunocytochemistry . J Cell Biol. 1990; ; 110 : :13.–25. 6.
Bharadwaj A, Bydoun M, Holloway R, Waisman D. Annexin A2 heterotetramer: structure and function . Int J Mol Sci. 2013; ; 14 : :6259.–6305. 7.
Chasserot-Golaz S, Vitale N, Umbrecht-Jenck E, et al. Annexin 2 promotes the formation of lipid microdomains required for calcium-regulated exocytosis of dense-core vesicles . Mol Biol Cell. 2005; ; 16 : :1108.–1119. 8.
Umbrecht-Jenck E, Demais V, Calco V, et al. S100A10-mediated translocation of annexin-A2 to SNARE proteins in adrenergic chromaffin cells undergoing exocytosis . Traffic. 2010; ; 11 : :958.–971. 9.
Menke M, Gerke V, Steinem C. Phosphatidylserine membrane domain clustering induced by annexin A2/S100A10 heterotetramer . Biochemistry. 2005; ; 44 : :15296.–15303. 10.
Gutierrez LM. New insights into the role of the cortical cytoskeleton in exocytosis from neuroendocrine cells . Int Rev Cell Mol Biol. 2012; ; 295 : :109.–137. 11.
Gabel M, Delavoie F, Demais V, et al. Annexin A2-dependent actin bundling promotes secretory granule docking to the plasma membrane and exocytosis . J Cell Biol. 2015; ; 210 : :785.–800. 12.
Mosharov EV, Sulzer D. Analysis of exocytotic events recorded by amperometry . Nat Methods. 2005; ; 2 : :651.–658. 13.
Schengrund CL. Lipid rafts: keys to neurodegeneration . Brain Res Bull. 2010; ; 82 : :7.–17. |