| |
| Med Sci (Paris). 32(6-7): 557–560. doi: 10.1051/medsci/20163206010.Le rôle critique de la PI3-kinase dans la traversée des barrières de l’hôte par Listeria monocytogenes
Grégoire Gessain,1,2,3 Olivier Disson,1,2* and Marc Lecuit1,2,4,5** 1Institut Pasteur, unité biologie des infections, 28, rue du Docteur Roux, F-75015Paris, France 2Inserm, U1117, F-75015Paris, France 3Université Paris Diderot, Sorbonne Paris Cité, cellule Pasteur, F-75013Paris, France 4Institut Pasteur, centre national de référence et centre collaborateur de l’OMS Listeria, 28, rue du Docteur Roux, F-75015Paris, France 5Université Paris Descartes, Sorbonne Paris Cité, service de maladies infectieuses et tropicales, hôpital universitaire Necker-Enfants Malades, institut Imagine, F-75015Paris, France MeSH keywords: Animaux, Barrière hémato-encéphalique, Activation enzymatique, Femelle, Interactions hôte-pathogène, Humains, Transmission verticale de maladie infectieuse, Muqueuse intestinale, Listeria monocytogenes, Infections à Listeria, Souris, Perméabilité, Phosphatidylinositol 3-kinases, Placenta, Grossesse, Complications de la grossesse et maladies infectieuses, métabolisme, microbiologie, physiologie, transmission |
Listeria monocytogenes (Lm) est responsable de la listériose humaine, une infection systémique d’origine alimentaire dont le taux de mortalité atteint 30 %. Suite à l’ingestion d’aliments contaminés, Lm traverse l’épithélium intestinal, dissémine par voie sanguine, et atteint le système nerveux central et l’unité fœto-placentaire. Lm a donc la capacité de traverser les barrières intestinale, hémato-encéphalique et placentaire. Elle est à l’origine d’encéphalites et de méningites, ainsi que d’avortements et d’infections néonatales. |
Mécanismes d’invasion cellulaire : rôle d’InlA et d’InlB
Lm est une bactérie intracellulaire facultative1, qui est internalisée par les cellules non phagocytaires. Cette invasion est consécutive à l’interaction de deux protéines de surface bactérienne avec leurs récepteurs respectifs à la surface des cellules de l’hôte. Ces deux protéines bactériennes de surface sont l’internaline (InlA), qui interagit avec la E-cadhérine (Ecad), une protéine permettant la formation des jonctions adhérentes entre cellules épithéliales, et InlB, qui interagit avec c-Met, le récepteur du facteur de croissance des hépatocytes (HGF) [1–4] (→).
(→) Voir les Nouvelles de M. Lecuit et P. Cossart, m/s n° 12, décembre 2001, page 1333, et m/s n° 1, janvier 2005, page 17
L’interaction InlA-Ecad est associée à des réarrangements du cytosquelette d’actine nécessaires à l’entrée de la bactérie dans la cellule. Cette inter-action est spécifique d’espèce : la Ecad humaine est reconnue par InlA, alors que la Ecad de souris ne l’est pas [5]. Pour les espèces chez lesquelles l’interaction InlA-Ecad est possible, telles que le cobaye, la gerbille, l’homme et les souris humanisées (qui expriment la Ecad humaine ou une Ecad murine humanisée par la substitution E16P2), InlA permet la traversée de l’épithélium intestinal [6, 7]. L’interaction InlB-c-Met mime la voie de signalisation cellulaire de l’HGF : elle active la PI3-K (phospho-inositide 3-kinase), qui est nécessaire à l’internalisation de Lm [8]. |
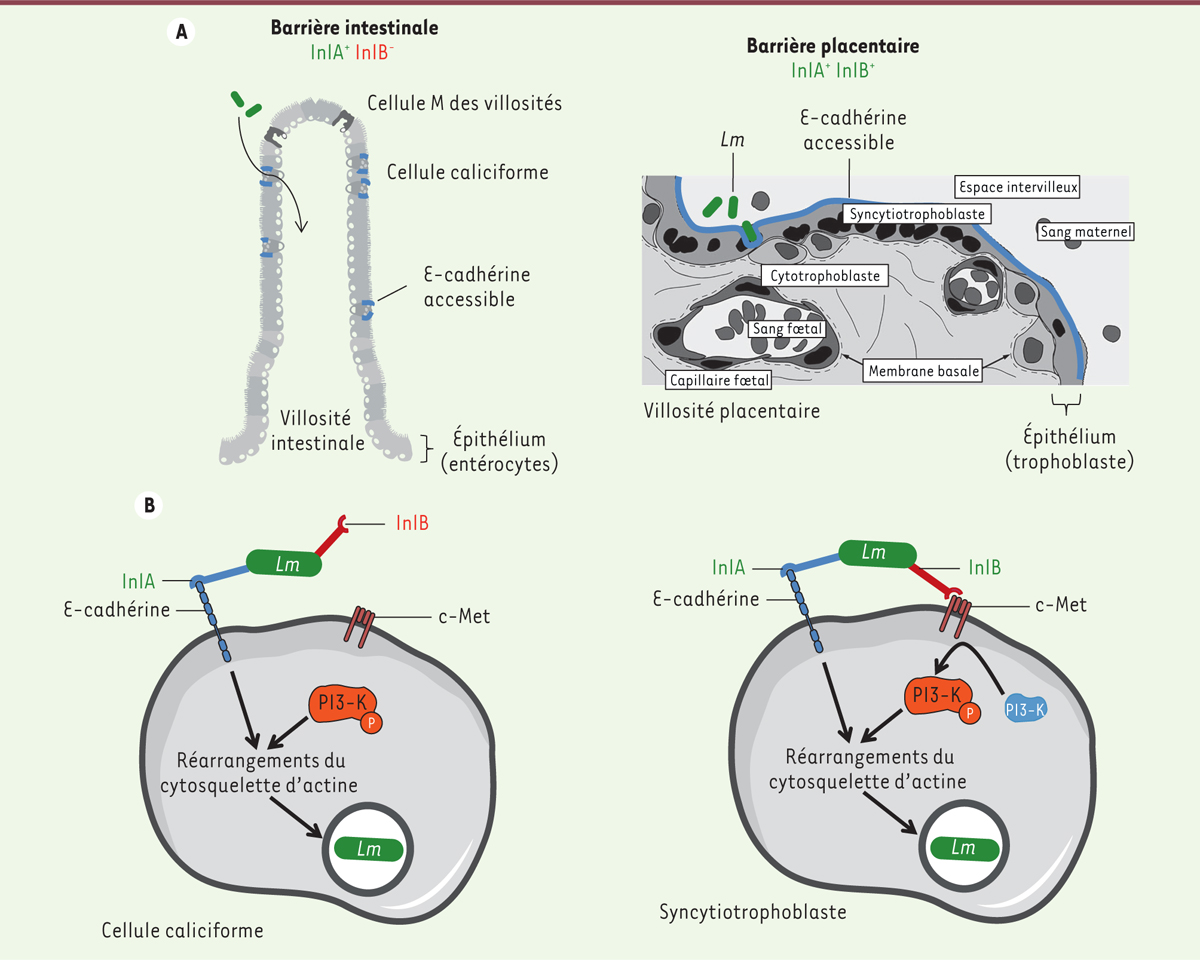
Lm traverse les barrières intestinale et placentaire InlA et InlB ont des contributions différentes lors du franchissement par Lm des barrières intestinale et placentaire. InlA est nécessaire et suffisante pour la traversée de l’épithélium intestinal. Elle interagit avec la Ecad située sur la face apicale des cellules caliciformes (CC) sécrétrices de mucus et accessible à leur face luminale (Figure 1A) [9]. InlB, elle, n’est pas impliquée dans la traversée de la barrière intestinale [10]. En revanche, la traversée de la barrière placentaire requiert l’action conjointe et interdépendante d’InlA et d’InlB (Figure 1A) [7, 11].
 | Figure 1.
Traversée dépendante d’InlA des cellules caliciformes intestinales et traversée dépendante d’InlA et d’InlB des cellules épithéliales placentaires. A. Schéma histologique simplifié d’une villosité intestinale (gauche) et d’une villosité placentaire (droite). L’épithélium de la villosité intestinale est constitué d’entérocytes, de cellules caliciformes sécrétrices de mucus et de cellules M. Les cellules caliciformes expriment de la E-cadhérine accessible à la lumière intestinale. La villosité placentaire est recouverte d’un épithélium appelé syncytiotrophoblaste, résultat de la fusion des cellules du cytotrophoblaste sous-jacentes. Le syncytiotrophoblaste exprime de la E-cadhérine accessible au sang maternel dans lequel se trouvent les bactéries. Listeria monocytogenes traverse les cellules caliciformes sécrétrices de mucus de l’intestin ainsi que le syncytiotrophoblaste du placenta. B. La PI3-kinase est constitutivement activée dans les cellules caliciformes intestinales, InlA seule est donc suffisante à l’invasion bactérienne. La PI3-kinase est faiblement activée dans le syncytiotrophoblaste, ce qui explique l’action conjointe d’InlA et d’InlB pour l’invasion cellulaire de Lm. Inl : internaline ; PI3-K : phospho-inositide 3-kinase ; Lm : Listeria monocytogenes.
|
Nous avons étudié les bases moléculaires et cellulaires des rôles respectifs d’InlA et d’InlB dans la traversée par Lm des barrières intestinale et placentaire [12]. Notre hypothèse de travail était la suivante : l’activité de la PI3-K étant nécessaire à l’internalisation de Lm, cette enzyme serait activée constitutivement dans les cellules intestinales ciblées par Lm, expliquant l’absence de rôle d’InlB dans la traversée de l’épithélium intestinal ; en revanche au niveau placentaire, elle ne serait pas activée constitutivement, et l’interaction InlB-c-Met serait nécessaire à son activation, permettant alors l’internalisation de Lm. |
Activité de la PI3-K et entrée dépendante d’InlB in vivo et in vitroNous avons tout d’abord étudié l’activité de la PI3-K dans les cellules caliciformes (CC) ciblées par Lm pour traverser l’épithélium intestinal et démontré que ces cellules expriment effectivement une activité PI3-K constitutive. À l’inverse, le syncytiotrophoblaste constituant la barrière épithéliale des villosités placentaires, en contact direct avec le sang maternel, n’exprime qu’un faible niveau basal d’activité PI3-K. Nous avons ensuite utilisé deux lignées cellulaires humaines pour étudier les entrées dépendantes d’InlA et d’InlB in vitro : des cellules intestinales sécrétrices de mucus, appelées LS174T, et des cellules trophoblastiques placentaires, appelées Jar. Nous avons montré que la PI3-K est activée constitutivement dans les cellules intestinales mais pas dans les cellules placentaires. Ces deux lignées reflètent donc bien l’activité de la PI3-K observée in vivo. Nous avons effectué des tests d’invasion in vitro pour étudier les entrées dépendantes d’InlA et d’InlB à l’aide de souches de Lm isogéniques3 invalidées pour InlA (Lm-∆inlA) ou InlB (Lm-∆inlB). Dans les cellules intestinales LS174T, l’entrée de Lm-∆inlA est réduite, tandis que l’entrée de Lm-∆inlB n’est pas affectée, comme observé in vivo. Ce résultat montre qu’InlA est impliquée dans l’invasion des cellules intestinales dont la PI3-K est activée, alors qu’InlB n’y joue donc aucun rôle. Dans les cellules placentaires Jar, les entrées de Lm-∆inlA et Lm-∆inlB sont toutes deux réduites, attestant de la nécessité de l’action conjointe d’InlA et InlB pour l’invasion des cellules placentaires, dépourvues d’activité PI3-K basale. Nous avons ensuite modulé l’activité de la PI3-K dans les deux lignées cellulaires et observé l’effet de cette modulation sur l’entrée dépendante d’InlB. Dans les cellules LS174T, l’inhibition de la pré-activation de la PI3-K entraîne une réduction de l’entrée de Lm-∆inlB : le rôle d’InlB est donc révélé en l’absence d’activité constitutive PI3-K. Réciproquement, dans les cellules Jar pour lesquelles la PI3-K est artificiellement activée avant l’infection, l’entrée de Lm-∆inlB augmente, témoignant de la réduction du rôle d’InlB à mesure que la PI3-K est pré-activée. |
InlB n’est pas impliquée dans la traversée de la barrière intestinale in vivoDes résultats publiés précédemment par une autre équipe suggéraient un rôle d’InlB dans la traversée de la barrière intestinale [13]. Nous avons démontré que ces résultats étaient consécutifs aux biais des modèles utilisés dans cette étude, et notamment l’utilisation de souris non humanisées inoculées avec une souche de Lm exprimant une version murinisée de InlA (Lm-InlAm) capable d’interagir avec la Ecad murine [14]. Nous avons montré que cette souche reconnait également la N-cadhérine de souris, située à la surface des cellules M des villosités (Mv) qui sont ainsi ciblées de façon non physiologique par Lm-InlAm [15]. Les Mv expriment une faible activité PI3-K, qui pourrait rendre compte de l’implication d’InlB dans ce modèle. Nos résultats indiquent en effet que Lm-InlAm envahit aussi bien les CC que les Mv, tandis que la souche Lm-InlAm invalidée pour InlB (Lm-InlAm
-∆inlB) n’envahit que les CC. Par conséquent, contrairement à un modèle murin humanisé permissif à InlA, dans lequel InlB ne joue aucun rôle dans la traversée de la barrière épithéliale intestinale, l’infection des souris sauvages par Lm-InlAm révèle un rôle artificiel d’InlB dans l’infection des Mv. |
InlB permet la traversée de l’épithélium placentaire humain ex vivoAfin d’étudier le rôle d’InlB dans la traversée de l’épithélium placentaire humain, nous avons utilisé des explants placentaires humains, obtenus lors d’accouchements au terme de grossesses sans complication [11]. Nous avons observé une faible activité PI3-K constitutive dans le syncytiotrophoblaste. Nous avons également démontré que l’adhésion et l’invasion de Lm-∆inlA est réduite, et que l’invasion de Lm-∆inlB est également affectée. La séquence d’entrée dans l’épithélium placentaire humain répond donc au modèle suivant : Lm adhère de façon dépendante d’InlA à la surface des villosités placentaires grâce à l’interaction InlA-Ecad, puis InlB active la PI3-K, ce qui permet l’internalisation des bactéries ayant adhéré. Ce modèle rend ainsi compte de la complémentarité des deux protéines bactériennes InlA et InlB dans l’invasion placentaire (Figure 1B). |
L’utilisation de Lm comme modèle d’étude des interactions hôte-pathogène nous a permis de comprendre les implications respectives d’InlA et d’InlB dans la traversée des barrières intestinale et placentaire et de mettre en lumière le rôle crucial de la PI3-K dans la permissivité des barrières traversées par Lm (Figure 1B) [12]. Ce travail a mis en évidence que la PI3-K est constitutivement activée dans les cellules caliciformes. Cette enzyme, qui phosphoryle les phospho-inositides, est impliquée dans l’internalisation de nombreux microorganismes pathogènes, bactéries, virus ou parasites, suggérant que le niveau d’activité de la PI3-K puisse être un facteur critique contrôlant la traversée des barrières de l’hôte par les pathogènes. Les cellules caliciformes pourraient ainsi constituer une porte d’entrée pour les autres entéro-pathogènes invasifs, et donc être une cible privilégiée de ces pathogènes. Par ailleurs, l’absence d’activité PI3-K dans l’épithélium placentaire illustre sa fonction de barrière face aux pathogènes, à l’exception de ceux qui ont évolué pour stimuler la PI3-K, tel que Lm. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Gaillard JL, Berche P, Frehel C, et al. Entry of L. monocytogenes into cells is mediated by internalin, a repeat protein reminiscent of surface antigens from gram-positive cocci . Cell. 1991; ; 65 : :1127.–1141. 2.
Shen Y, Naujokas M, Park M, Ireton K. InIB-dependent internalization of Listeria is mediated by the Met receptor tyrosine kinase . Cell. 2000; ; 103 : :501.–510. 3.
Lecuit M, Cossart P. Un modèle transgénique pour la listériose humaine : rôle de l’interaction entre l’internaline et la E-cadhérine dans la traversée de la barrière intestinale par L. monocytogenes . Med Sci (Paris). 2001; ; 17 : :1333.–1335. 4.
Lecuit M, Cossart P. Bases moléculaires du tropisme fœtoplacentaire de Listeria monocytogenes . Med Sci (Paris). 2005; ; 21 : :17.–19. 5.
Lecuit M, Dramsi S, Gottardi C, et al. A single amino acid in E-cadherin responsible for host specificity towards the human pathogen Listeria monocytogenes . EMBO J. 1999; ; 18 : :3956.–3963. 6.
Lecuit M, Vandormael-Pournin S, Lefort J, et al. A transgenic model for listeriosis: role of internalin in crossing the intestinal barrier . Science. 2001; ; 292 : :1722.–1725. 7.
Disson O, Grayo S, Huillet E, et al. Conjugated action of two species-specific invasion proteins for fetoplacental listeriosis . Nature. 2008; ; 455 : :1114.–1118. 8.
Ireton K, Payrastre B, Chap H, et al. A role for phosphoinositide 3-kinase in bacterial invasion . Science. 1996; ; 274 : :780.–782. 9.
Nikitas G, Deschamps C, Disson O, et al. Transcytosis of Listeria monocytogenes across the intestinal barrier upon specific targeting of goblet cell accessible E-cadherin . J Exp Med. 2011; ; 208 : :2263.–2277. 10.
Khelef N, Lecuit M, Bierne H, Cossart P. Species specificity of the Listeria monocytogenes InlB protein . Cell Microbiol. 2006; ; 8 : :457.–470. 11.
Lecuit M, Nelson DM, Smith SD, et al. Targeting and crossing of the human maternofetal barrier by Listeria monocytogenes: role of internalin interaction with trophoblast E-cadherin . Proc Natl Acad Sci USA. 2004; ; 101 : :6152.–6157. 12.
Gessain G, Tsai YH, Travier L, et al. PI3-kinase activation is critical for host barrier permissiveness to Listeria monocytogenes . J Exp Med. 2015; ; 212 : :165.–183. 13.
Pentecost M, Kumaran J, Ghosh P, Amieva MR. Listeria monocytogenes internalin B activates junctional endocytosis to accelerate intestinal invasion . PLoS Pathog. 2010; ; 6 : :e1000900.. 14.
Wollert T, Pasche B, Rochon M, et al. Extending the host range of Listeria monocytogenes by rational protein design . Cell. 2007; ; 129 : :891.–902. 15.
Tsai YH, Disson O, Bierne H, Lecuit M. Murinization of internalin extends its receptor repertoire, altering Listeria monocytogenes cell tropism and host responses . PLoS Pathog. 2013; ; 9 : :e1003381.. |