| |
| Med Sci (Paris). 32(6-7): 560–562. doi: 10.1051/medsci/20163206011.La mystérieuse cible de la protéine virale Nef identifiée : les protéines SERINC3 et SERINC5 Lise Chauveau1 and Olivier Schwartz1* 1Institut Pasteur, Unité Virus et Immunité, URA CNRS 3015, 28, rue du Docteur Roux, 75724Paris Cedex 15, France MeSH keywords: Animaux, Endocytose, Infections à VIH, VIH-1 (Virus de l'Immunodéficience Humaine de type 1), Humains, Protéines membranaires, Protéines tumorales, Liaison aux protéines, Récepteurs de surface cellulaire, Produits du gène nef du virus de l'immunodéficience humaine, métabolisme, virologie |
Le VIH (virus de l’immunodéficience humaine) contient des gènes codant pour des protéines appelées accessoires. Contrairement aux protéines structurales, ces protéines ne sont pas des constituants de la particule virale. Elles sont cependant nécessaires à l’infection in vivo, chez l’homme ou dans des modèles animaux. Ces protéines accessoires sont en particulier capables de contrer l’action de protéines cellulaires, appelées facteurs de restriction, qui bloquent la réplication du virus à différentes étapes. Ainsi, la protéine Vif (viral infectivity factor) dégrade le facteur de restriction APOBEC3G (apolipoprotein B mRNA editing enzyme, catalytic polypeptide-like 3G) qui provoque des hypermutations de l’ADN viral [1]. Le facteur de restriction Tetherin/BST-2 (bone marrow stromal antigen 2) est incorporé dans la membrane des particules virales et bloque le relargage de ces particules à partir de la surface de la cellule. La protéine accessoire Vpu délocalise Tetherin/BST-2 et l’exclut des zones de bourgeonnement du virus, empêchant ainsi son incorporation dans les particules virales [2]. Nef est une des protéines accessoires du VIH. Elle est associée à la face interne de la membrane plasmique. Nef ne possède pas d’activité enzymatique mais exerce de multiples fonctions (pour une revue détaillée voir [3]), dont les principales sont liées à ses capacités d’interaction avec les machineries de trafic et de signalisation intracellulaire [4] (→).
(→) Voir la Synthèse de S. Bénichou et A. Benmerah, m/s n° 1, janvier 2003, page 100
Un des premiers effets de Nef à avoir été décrit est la diminution de l’expression, à la surface cellulaire, de CD4, le récepteur du VIH, et des molécules du complexe majeur d’histocompatibilité de classe I (CMH-I). Il a ensuite été montré que Nef pouvait modifier l’expression membranaire de nombreuses protéines [3]. Une autre propriété importante de Nef, décrite il y a une vingtaine d’années, est sa capacité à augmenter l’infectivité des virions produits par la cellule infectée [3]. Le mécanisme d’action de Nef sur l’infectivité des particules virales est resté longtemps mal compris et de nombreuses équipes de recherche ont tenté d’identifier un potentiel facteur de restriction impliqué. Grâce aux avancées des techniques de protéomique et transcriptomique à haut débit, trois équipes indépendantes sont récemment parvenues à identifier les protéines cellulaires cibles de Nef et impliquées dans la modulation de l’infectivité des virions : il s’agit des protéines serine incorporator 3 et 5 (SERINC3 et SERINC5) [5–7]. |
Identification des nouveaux facteurs de restriction SERINC3 et SERINC5 La première équipe à l’origine de la découverte des facteurs de restriction cibles de Nef est partie de l’observation suivante : l’effet de Nef sur l’infectivité des virions produits varie en fonction de la cellule productrice. Les chercheurs ont donc établi le transcriptome de différentes lignées cellulaires présentant des sensibilités variables à l’effet de Nef sur l’infectivité [6] et ont mesuré les niveaux d’expression de nombreuses protéines cellulaires dans chacune de ces lignées. Cette méthode a permis d’identifier la protéine SERINC5, dont l’expression dans les différentes lignées corrèle le mieux avec l’effet de Nef [6]. La seconde équipe a utilisé une stratégie différente. Il avait été montré que l’activité de Nef sur l’infectivité des virions dépendait de la machinerie d’endocytose de la cellule productrice. Nef pourrait donc induire l’endocytose d’un facteur de restriction qui serait incorporé dans la particule virale et diminuerait l’infectivité. Une analyse protéomique des particules virales produites en présence ou en absence de Nef a donc permis d’identifier SERINC3 comme étant le facteur exclu de la particule virale par Nef pour augmenter l’infectivité (Figure 1) [5].
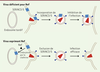 | Figure 1.
La protéine virale Nef restaure l’infectivité de la particule virale du VIH en excluant le facteur de restriction cellulaire SERINC3/5. Dans une cellule infectée par un virus déficient pour Nef, les protéines SERINC3 et SERINC5 sont à la membrane plasmique et sont incorporées dans les particules virales produites. Ces particules contenant SERINC3/5 sont moins infectieuses. Dans une cellules infectée par un virus exprimant Nef, la protéine virale utilise la machinerie d’endocytose médiée par la clathrine pour adresser les protéines SERINC3/5 dans les endosomes tardifs. SERINC3/5 sont alors exclues de la particule virale qui recouvre son infectivité. |
La troisième équipe a réalisé une analyse globale de l’expression des protéines à la surface des cellules infectées soit par un virus sauvage (WT pour wild type) soit par un virus n’exprimant pas Nef. Cette impressionnante analyse protéomique différentielle a permis, là encore, d’identifier, entre autres, les protéines SERINC3 et SERINC5 présentes à la surface des cellules infectées par un virus délété de Nef [7]. |
La famille des protéines SERINC SERINC3 et SERINC5 font partie d’une famille de 7 protéines contenant 11 domaines transmembranaires [8, 9]. Leur principale fonction connue est de permettre l’incorporation de la sérine dans les lipides membranaires pour former la phosphatidylsérine ou des sphingolipides [10], composants essentiels des radeaux lipidiques1,. Les protéines SERINC sont conservées au cours de l’évolution, y compris chez la levure, qui exprime une protéine partageant respectivement 30 % et 25 % d’homologie avec SERINC3 et SERINC5. Elles sont présentes de manière ubiquitaire mais leur expression peut également être induite, par exemple dans le cerveau par l’activation des neurones ou dans certaines tumeurs [10, 11]. Les protéines SERINC3 et SERINC5 sont présentes dans les lymphocytes T CD4 et dans les cellules dendritiques, des cellules cibles du VIH [5, 6]. Dans des lignées lymphocytaires, elles sont retrouvées à la membrane plasmique. Contrairement à la plupart des autres facteurs de restriction, leur expression dans ces cellules n’est pas augmentée par l’interféron ou par un traitement induisant la production d’interféron, tel que le lipopolysaccharide. |
Mécanisme d’action des protéines SERINC3 et SERINC5 contre le VIH Étant donné le peu d’études réalisées sur les protéines SERINC, le mécanisme de restriction de l’infectivité des particules virales par ces protéines reste à éclaircir. Deux équipes [5, 6] se sont déjà intéressées à l’étape du cycle de réplication inhibée par la présence de SERINC5 dans la particule virale. La restriction a lieu à une étape très précoce, avant la transcription inverse de l’ARN viral. La présence de Nef dans la cellule productrice pourrait agir sur l’étape de fusion des particules virales à la membrane de la cellule cible. Les deux études concluent que, lorsque la quantité de SERINC5 dans la particule virale augmente, la fusion de ces virions avec la cellule cible est inhibée. Les auteurs proposent que SERINC5 agisse après la formation d’un pore de fusion entre la particule virale et la cellule cible en empêchant l’agrandissement de ce pore. Ce pore de fusion ne serait alors pas suffisamment grand pour permettre à la capside virale de pénétrer le cytoplasme. L’étape d’agrandissement du pore au cours de la fusion est connue pour dépendre de la composition lipidique des membranes [12]. Le mécanisme d’action précis de SERINC5 dans cette étape reste cependant à préciser. |
Nef élimine SERINC3 et SERINC5 de la particule virale Comment Nef antagonise-t-elle l’effet antiviral des protéines SERINC ? Comme discuté précédemment, les niveaux des protéines SERINC3 et SERINC5 à la membrane plasmique sont diminués par Nef [5–7]. Nef agit en délocalisant les protéines SERINC5 vers les endosomes tardifs2,, l’excluant ainsi de la plateforme de bourgeonnement viral à la membrane plasmique. De façon intéressante, l’effet antiviral de SERINC5 dépend de la glycoprotéine d’enveloppe virale. Si l’on crée des particules de VIH porteur des glycoprotéines d’enveloppe du virus Ebola ou du VSV (vesicular stomatitis virus), celles-ci ne sont pas sensibles à la restriction par SERINC3 et SERINC5 [5, 6]. SERINC5 est bien incorporé dans ces particules virales mais ne diminue par leur infectivité. De plus, certaines glycoprotéines d’enveloppe du VIH permettent, elles aussi, d’échapper à l’effet antiviral de SERINC5. Il semble que la susceptibilité du VIH à la présence de Nef, et donc à l’effet négatif de SERINC5, puisse être liée à la stabilité de ses trimères d’enveloppe [13]. |
L’identification des protéines SERINC3 et SERINC5 permet de mieux comprendre les effets de la protéine Nef lors de l’infection par le VIH. Cependant, de nombreuses questions restent encore à résoudre. Le rôle physiologique de SERINC3 et SERINC5 est peu caractérisé. Si ces protéines facilitent l’apport de sérine dans les voies de biosynthèse de phosphatidylsérine et des sphingolipides, quel est l’intérêt pour le virus de manipuler cette voie ? La composition lipidique des membranes virales peut être différente de celles des membranes cellulaires [14, 15] et la modification de leur contenu lipidique modifie très certainement leur capacité fusogène. Nef semble pouvoir directement modifier cette composition lipidique [16]. Il reste à déterminer si cette modification dépend des protéines SERINC3 et SERINC5. Une autre question concerne la présence physique des protéines SERINC3 et SERINC5 dans les virions. Exercent-elles un effet antiviral local direct dans les virions en modifiant la qualité ou l’accessibilité des glycoprotéines d’enveloppe en plus de leur rôle sur les voies de biosynthèse des lipides ? Quel est le rôle physiologique des autres protéines de la famille SERINC ? Par ailleurs, l’expérience nous montre que les facteurs de restriction initialement identifiés contre le VIH agissent aussi contre d’autres espèces virales. L’identification des protéines SERINC3 et SERINC5 ouvre donc la voie à un nouveau champ d’investigations. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
|
Footnotes |
1.
Schwartz O. VIH-1: un virus très Vif! . Med Sci (Paris). 2004; ; 20 : :139.–141. 2.
Neil SJ, Zang T, Bieniasz PD. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu . Nature. 2008; ; 451 : :425.–430. 3.
Basmaciogullari S, Pizzato M. The activity of Nef on HIV-1 infectivity . Front Microbiol. 2014; ; 5 : :232.. 4.
Bénichou S, Benmerah A. Protéines Nef du VIH et K3/K5 du virus associé au sarcoma de Kaposi : des parasites de la voie d’endocytose . Med Sci (Paris). 2003; ; 19 : :100.–106. 5.
Usami Y, Wu Y, Gottlinger HG. SERINC3 and SERINC5 restrict HIV-1 infectivity and are counteracted by Nef . Nature. 2015; ; 526 : :218.–223. 6.
Rosa A, Chande A, Ziglio S, et al. HIV-1 Nef promotes infection by excluding SERINC5 from virion incorporation . Nature. 2015; ; 526 : :212.–217. 7.
Matheson NJ, Sumner J, Wals K, et al. Cell surface proteomic map of HIV infection reveals antagonism of amino acid metabolism by Vpu and Nef . Cell Host Microbe. 2015; ; 18 : :409.–423. 8.
Grossman TR, Luque JM, Nelson N. Identification of a ubiquitous family of membrane proteins and their expression in mouse brain . J Exp Biol. 2000; ; 203 : :447.–457. 9.
Xu J, Ji C, Wang L, et al. Cloning and expression of a novel human C5orf12 gene, a member of the TMS-TDE family . Mol Biol Rep. 2003; ; 30 : :47.–52. 10.
Inuzuka M, Hayakawa M, Ingi T. Serinc, an activity-regulated protein family, incorporates serine into membrane lipid synthesis . J Biol Chem. 2005; ; 280 : :35776.–35783. 11.
Bossolasco M, Lebel M, Lemieux N, Mes-Masson AM. The human TDE gene homologue: localization to 20q13.1-13.3 and variable expression in human tumor cell lines and tissue . Mol Carcinog. 1999; ; 26 : :189.–200. 12.
Waheed AA, Freed EO. The role of lipids in retrovirus replication . Viruses. 2010; ; 2 : :1146.–1180. 13.
Usami Y, Gottlinger H. HIV-1 Nef responsiveness is determined by Env variable regions involved in trimer association and correlates with neutralization sensitivity . Cell Rep. 2013; ; 5 : :802.–812. 14.
Cohen FS, Melikyan GB. The energetics of membrane fusion from binding, through hemifusion, pore formation, and pore enlargement . J Membr Biol. 2004; ; 199 : :1.–14. 15.
Brugger B, Glass B, Haberkant P, et al. The HIV lipidome: a raft with an unusual composition . Proc Natl Acad Sci USA. 2006; ; 103 : :2641.–2646. 16.
Brugger B, Krautkrämer E, Tibroni N, et al. Human immunodeficiency virus type 1 Nef protein modulates the lipid composition of virions and host cell membrane microdomains . Retrovirology. 2007; ; 4 : :70.. |