Le virus de l’hépatite C (VHC) est un virus enveloppé comprenant un génome à ARN inclus dans une capside protéique et entouré d’une bicouche lipidique contenant deux glycoprotéines. Chez les individus infectés, le virus persiste habituellement sous la forme d’une infection chronique du foie. Il est ainsi à l’origine d’un processus inflammatoire au long cours et, éventuellement, du développement d’un carcinome hépatocellulaire (CHC). Ceci survient la plupart du temps chez des patients atteints de cirrhose. Les traitements antiviraux à action directe ont beaucoup évolué récemment (avec entre autres molécules le sofosbuvir associé ou non au daclatasvir). Cependant, la manière dont le VHC influe sur le phénotype hépatocytaire pour permettre sa propre persistance reste le sujet de nombreuses questions qui ne sont toujours pas résolues.
Le virus de l’hépatite C se réplique principalement dans les hépatocytes dans lesquels il pénètre par des interactions complexes reposant sur plusieurs protéines de surface comme CD81 (ou tetraspanin-28), SRB1 (scavenger receptor class B type 1), certaines protéines de jonction serrée et le récepteur à l’EGF (EFGR, epidermal growth factor receptor). Dans la cellule, le virus se réplique au niveau de membranes intracellulaires, en particulier celles dérivées du réticulum endoplasmique (RE).
Nous avons montré que la nétrine-1, une molécule chimiotropique, est étroitement impliquée dans le cycle de vie du virus via l’EGFR [1]. Ce rôle de la nétrine-1 en virologie est nouveau. En effet, initialement décrite en embryogénèse comme un modulateur de la croissance axonale [2, 3] (→) la nétrine-1 a été impliquée, pour son rôle délétère, dans des processus inflammatoires gastrointestinaux [4], ainsi qu’en oncologie générale, tant dans des tissus épithéliaux que neuronaux [5–7].
(→) Voir la Synthèse de P. Mehlen et N. Rama, m/s n° 3, mars 2007, page 311
La nétrine-1 favorise l’entrée du virus dans les cellules hépatiques en bloquant l’internalisation de l’EGFR, augmentant ainsi la présence de ce récepteur nécessaire à son adsorption, à la surface de la cellule. L’expression de la nétrine-1, qui est augmentée par le virus, conduit à son tour à une augmentation à la fois de la quantité de génome de l’ARN viral mais aussi du pouvoir infectieux des particules virales produites.
Nous avons mesuré la quantité de nétrine-1 dans des échantillons de biopsie de foie de patients infectés par le virus comparés à des prélèvements histologiquement similaires réalisés chez des patients non infectés par le VHC, ni par le virus de l’hépatite B. Une augmentation substantielle (> 20 fois) de la quantité de transcrit de nétrine-1 a été observée dans les échantillons provenant des patients infectés. Le traitement de ces patients avec des médicaments antiviraux, le plus souvent une bithérapie basée sur l’interféron alpha et la ribavirine, permet de réverser cette augmentation. In vitro, l’infection par le VHC d’hépatocytes humains primaires et d’une lignée de cellules hépatocytaires (Huh7.5) conduit également à une augmentation importante de la quantité d’ARNm de la nétrine-1, ainsi qu’à une traduction accrue de ce transcrit.
Bien que son importance fonctionnelle soit peu claire, une interaction entre le transcrit de la nétrine-1 et la protéine liant l’ARN, LARP1 (La-related protein 1), a été décrite [8]. Nous avons constaté que LARP1 interagissait également spécifiquement avec l’une des protéines non structurales du VHC, NS5A (nonstructural protein 5A), au niveau des membranes du RE où elle favorise la traduction de la nétrine-1. Dans les cellules infectées, NS5A contribue à la relocalisation de LARP1 et du transcrit de nétrine-1 qui lui est associé dans des zones du RE traductionnellement actives. Dans des expériences de surexpression et de knock-down du transcrit nétrine-1, nous avons montré que la quantité de transcrit de la protéine était corrélée à celle d’ARN du VHC produit et au pouvoir infectieux des particules virales produites. L’infection par le VHC favorise donc la traduction de nétrine-1 qui, à son tour, favorise l’infectivité du virus. La nétrine-1 augmente également le niveau global d’EGFR à la surface des cellules et de sa forme activée (c’est-à-dire phosphorylée) en entravant son internalisation, cet évènement moléculaire concourant à l’entrée du virus dans les cellules.
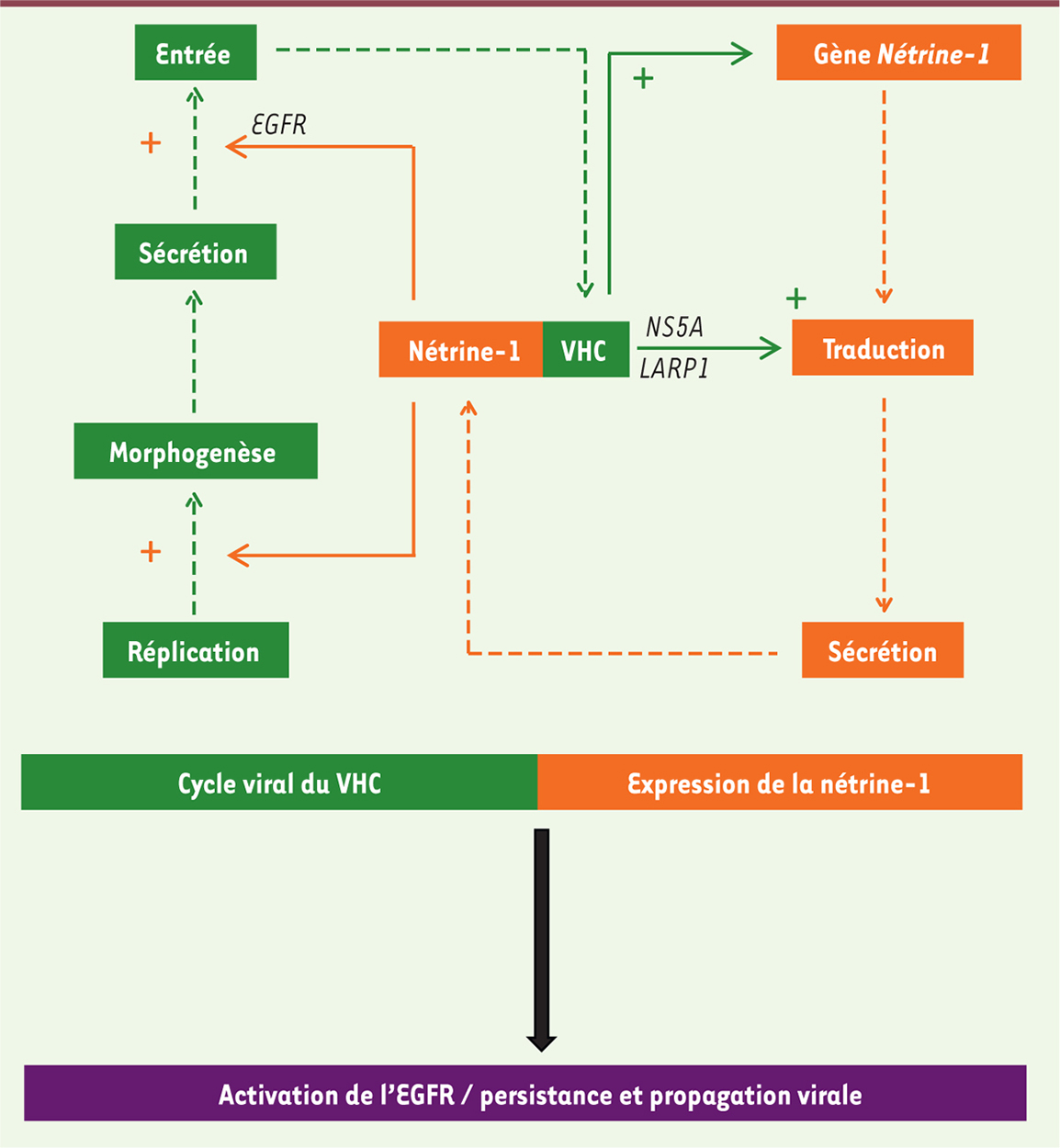
Une telle boucle de rétroaction positive (résumée dans la Figure 1 ) est rarement observée dans les systèmes biologiques. Elle pourrait expliquer comment l’infection par le virus peut favoriser une certaine résistance à la mort cellulaire des cellules du foie infectées par le VHC. Cette résistance potentielle, induite par la nétrine-1, pourrait ainsi participer au processus de cancérisation au stade cirrhotique, où les taux de nétrine sont les plus élevés, en s’ajoutant au caractère directement oncogène de certaines protéines virales comme la capside et NS5A [9]. L’effondrement des taux de nétrine-1 entre les stades cirrhose et CHC que nous avons observé, semble suggérer que la protéine exercerait son pouvoir oncogène éventuel à un stade initial de la maladie, la tumeur s’émancipant ensuite du système des récepteurs à dépendance pour son évolution ultérieure. Cette hypothèse reste cependant à démontrer et demande une confirmation expérimentale. En effet, l’expression de la nétrine-1 ne confère pas un avantage de survie aux cellules cultivées que nous avons utilisées dans cette étude. Cependant, dans une autre étude, nous avons montré qu’elle déterminait une survie hépatocytaire accrue lors de l’induction expérimentale de la réponse aux protéines mal repliées (appelée UPR en anglais, unfolded protein response), une caractéristique commune à de nombreuses maladies chroniques du foie [10]. De plus, compte tenu de la fréquence de dysrégulation de la voie de l’EGFR que l’on observe à un stade avancé de la maladie hépatique chronique [11], l’association fonctionnelle entre nétrine-1 et EGFR pourrait être potentiellement importante pour l’apparition du carcinome hépatocellulaire.
| Figure 1.
Amplification mutuelle du virus de l’hépatite C et de la nétrine-1. Le virus de l’hépatite C induit la relocalisation de la protéine LARP1 sur des sites actifs de traduction par expression de sa protéine NS5A, favorisant ainsi l’expression de la nétrine-1. La nétrine-1 facilite en retour l’entrée virale par activation quantitative et qualitative du récepteur de l’EGF à la membrane plasmique de la cellule hôte. Les modalités par lesquelles l’induction transcriptionnelle du transcrit nétrine-1 et l’activation de la morphogénèse virale ont lieu ne sont pas identifiés. EGF : epidermal growth factor ; EGFR : récepteur de l’EGF ; LARP1 : La-related protein 1 ; NS5A : nonstructural protein 5A ; VHC : virus de l’hépatite C. |
Nous avons donc montré que la nétrine-1 pouvait constituer une cible potentielle en hépatologie et, en premier lieu, contre le VHC chez les patients cirrhotiques. La nétrine-1 est actuellement évaluée dans des essais de phase 1 en oncologie générale au Centre de lutte contre le cancer Léon Bérard de Lyon. Son implication possible, mais qui reste à démontrer, dans le développement du VHC, renforce son intérêt thérapeutique potentiel chez les 5 à 15 % de patients cirrhotiques infectés par ce virus et en échec thérapeutique, malgré les dernières avancées antivirales. [12].