| |
| Med Sci (Paris). 32(6-7): 571–573. doi: 10.1051/medsci/20163206015.Les mutations du gène NONO sont responsables d’un nouveau syndrome de déficience intellectuelle lié au dysfonctionnement des synapses inhibitrices Maéva Langouët,1* Dennis Mircsof,2,3 Marlène Rio,1 Jeanne Amiel,1 Steven A. Brown,2 and Laurence Colleaux1** 1Inserm UMR 1163, laboratoire bases moléculaires et pathophysiologiques des désordres cognitifs, université Paris Descartes– Sorbonne Paris Cité, institut Imagine, hôpital Necker-Enfants Malades, 24, boulevard du Montparnasse, 75015Paris, France 2Chronobiology and Sleep Research Group, Neuromorphology Group, Institute of Pharmacology, Inserm UMR 1163, Hôpital Necker Enfants Malades, 149, rue de Sèvres, 75015Paris, France 3Neuromorphology Group, Institute of Pharmacology and Toxicology, University of Zurich, 190 Winterthurerstrasse, 8057Zurich, Suisse MeSH keywords: Animaux, Modèles animaux de maladie humaine, Prédisposition génétique à une maladie, Humains, Déficience intellectuelle, Souris, Souris transgéniques, Mutation, Inhibition nerveuse, Protéines associées à la matrice nucléaire, Facteurs de transcription Oct, Protéines de liaison à l'ARN, Synapses, Syndrome, génétique, anatomopathologie |
Le terme déficience intellectuelle (DI) ne désigne pas une maladie unique mais un ensemble de pathologies extrêmement hétérogène ayant en commun un fonctionnement intellectuel général inférieur à la moyenne et des limitations du fonctionnement adaptatif1 [13]. La prévalence de la DI est de 1 % si on ne considère que les DI sévères (quotient intellectuel [QI] inférieur à 50) et s’élève à 2-3 % si l’on inclut les DI légères (QI entre 50 et 70 [1]). De multiples causes, génétiques et environnementales, ont été recensées. Cependant, la grande majorité des DI légères et 40 % des DI sévères sont aujourd’hui encore inexpliquées. Ces maladies neuro-développementales fréquentes et gravement invalidantes sont responsables de 10 % des dépenses de santé dans les pays développés, loin devant le cancer ou les maladies cardiovasculaires. Il s’agit donc d’un enjeu scientifique et médical majeur [2] (→).
(→) Voir la Synthèse de S. Harel et S. Jenna, m/s n° 1, janvier 2011, page 70
Depuis 5 ans, la révolution génomique a conduit au développement de nouveaux outils de séquençage à très haut débit et de méthodes permettant de cibler des régions d’intérêt. De nombreuses applications médicales ont vu le jour depuis l’avènement de ces nouvelles techniques, qu’elles s’appuient sur l’analyse d’une sélection de gènes spécifiques ou le re-séquençage2, de l’ensemble des régions codantes du génome humain (whole exome sequencing ou WES). Ces outils ont décuplé nos capacités à détecter des variations génétiques dans les gènes déjà associés à une maladie ou dans des gènes dont le rôle n’était pas suspecté, offrant une méthode de diagnostic efficace, rapide et économique des maladies rares. Dans le cadre des DI syndromiques3, elle permet ainsi d’identifier une cause génétique chez 50 % des patients [3]. |
Identification d’un nouveau gène impliqué dans la déficience intellectuelle : NONO/P54NRBEn collaboration avec les médecins du département de génétique de l’hôpital Necker-Enfants malades, nous avons eu l’opportunité d’étudier deux patients non apparentés présentant un phénotype très semblable. Ce phénotype est caractérisé par l’association d’une mégalencéphalie4,, d’un corps calleux5, épais et d’une DI sévère et est désigné ci-après sous le nom de syndrome MCCDI (mégalencéphalie/corps calleux/DI). Ces patients souffrent également d’une hypoplasie malaire6 importante accompagnée de troubles sévères de l’élocution. Afin d’identifier le défaut génétique sous-jacent, nous avons utilisé une approche de WES et analysé les données à la recherche de mutations touchant le même gène chez les deux patients. Cette analyse nous a permis d’identifier 2 mutations nulles7, dans un gène lié au chromosome X : NONO (non-POU domain-containing octamer-binding protein coding gene)/P54NRB
8 [4]. Le rôle du gène NONO dans l’étiologie de la DI a ensuite été définitivement démontré par l’identification, au cours d’une étude britannique, d’un troisième patient porteur d’une nouvelle mutation de ce gène9 et présentant des signes morphologiques et comportementaux très similaires aux deux patients MCCDI décrits ci-dessus [5]. Avec PSPC1 (paraspeckle component 1) et SFPQ/PSF (splicing factor proline/glutamine-rich), NONO appartient à la famille des protéines DBHS (drosophila behaviour human splicing). Ces trois protéines nucléaires forment des homo- ou hétérodimères et sont impliquées dans de nombreux processus liés à la synthèse et la régulation de l’expression des ARN messagers [6]. Des travaux menés sur un modèle murin inactivé pour ce gène (Nonogt
) ont de plus suggéré un rôle de la protéine NONO dans la régulation du rythme circadien [7]. L’étude de fibroblastes primaires issus des patients MCCDI a révélé que les deux mutations identifiées conduisaient à l’absence totale de protéine NONO. En accord avec son implication dans la régulation de l’expression génique, nous avons mis en évidence une dérégulation globale de l’expression des gènes dans ces fibroblastes. |
Le modèle murin : fidèle reproduction des anomalies observées chez les patients En collaboration avec l’équipe de Steven Brown (université de Zurich), nous avons repris l’analyse du modèle murin (Nonogt
) pour évaluer sa pertinence au regard du phénotype observé chez les patients. Nous avons tout d’abord montré que le modèle murin mimait parfaitement plusieurs des signes cliniques observés chez les patients. En particulier, nous avons observé chez ces mutants des anomalies crânio-faciales et cérébrales similaires à celles présentes chez les patients. De même, la réalisation de divers tests comportementaux a confirmé l’existence d’anomalies cognitives et d’un comportement anxieux. Enfin, l’analyse transcriptomique de fibroblastes embryonnaires (MEF, mouse embryonnic fibroblasts) de souris mutantes et sauvages, suivie d’une méta-analyse des données obtenues chez les souris et chez l’homme, ont montré que des cellules issues de patients et de souris mutées présentaient la même dérégulation transcriptionnelle globale. Une analyse de clustering (regroupement) hiérarchique a révélé une séparation des échantillons en deux groupes, dépendants non pas de l’espèce mais du statut muté (patient) ou sauvage (sujet sain). Ce résultat suggère donc l’existence d’une signature transcriptomique NONO-dépendante. L’ensemble de ces observations confirme l’intérêt de ce modèle murin Nonogt pour mieux comprendre les mécanismes physiopathologiques responsables du syndrome MCCDI, en particulier en étudiant le rôle de NONO au niveau du cerveau. |
NONO régule l’abondance des ARNm synaptiques L’exploration du modèle murin a permis de mettre en évidence une expression importante de la protéine NONO dans les cerveaux des souris sauvages, en particulier au niveau des neurones. Les souris déficientes pour ce gène montrent une dérégulation majeure de l’expression des ARNm localisés au niveau de la synapse, 30 % des transcrits étant altérés en l’absence de protéine NONO. Parmi les ARNm présentant, d’un point de vue quantitatif, l’anomalie la plus importante, figure le transcrit Gabra2 codant la sous-unité α2 du récepteur au GABAA (acide gamma-aminobutyrique). L’anomalie d’expression du gène Gabra2 combinée au phénotype anxieux observé chez les souris Nonogt nous ont conduit à émettre l’hypothèse que l’absence de protéine NONO pourrait être responsable d’une anomalie structurelle ou fonctionnelle des synapses inhibitrices GABAergiques. |
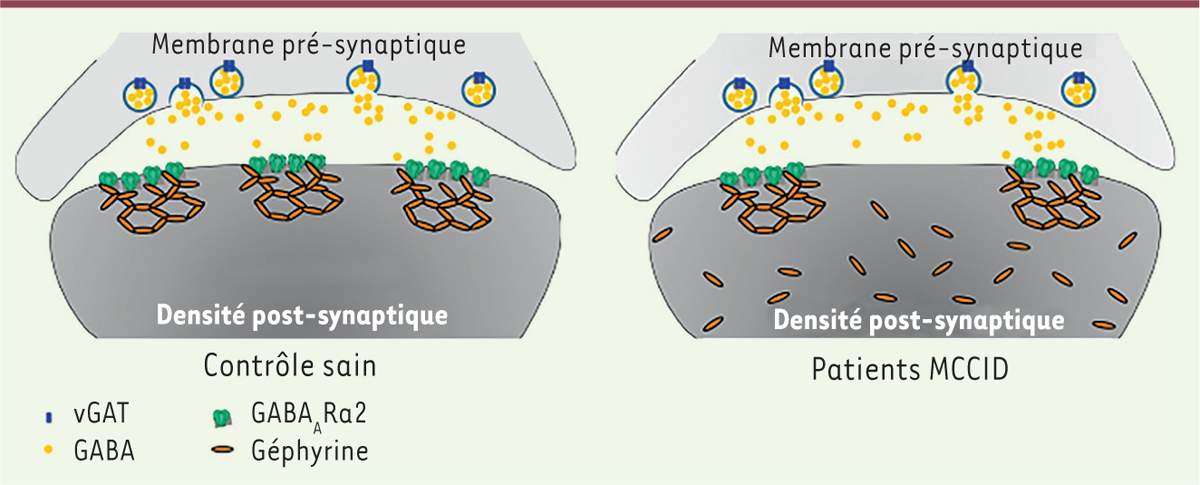
Anomalie structurelle des synapses inhibitrices chez les souris Nonogt : un phénotype réversible in vitroPour tester cette hypothèse nous avons analysé par immunohistochimie l’intégrité de la structure des synapses inhibitrices chez des souris mutantes et sauvages. Alors que des marquages utilisant des anticorps dirigés contre un marqueur pré-synaptique, le transporteur vésiculaire du GABA (VGAT), ne montrent pas d’anomalie chez les souris mutantes, la diminution de l’expression de la sous-unité α2 entraîne un nombre réduit de récepteurs au GABAA à la synapse, ainsi qu’un défaut de l’intégrité du réseau de géphyrine, la principale protéine de l’échafaudage post-synaptique inhibiteur (Figure 1) [8–11].
 | Figure 1.
Modélisation de l’anomalie structurelle des synapses chez les patients MCCDI. Chez les patients MCCDI, la diminution du nombre de clusters de récepteurs au GABAA au niveau post-synaptique conduit au démantèlement partiel du réseau de géphyrine tapissant la paroi de la membrane, sans affecter la membrane pré-synaptique, entraînant vraisemblablement un déséquilibre entre neurotransmission excitatrice et inhibitrice. MCCDI : mégalencéphalie/corps calleux/déficience intellectuelle ; GABA : acide gamma-aminobutyrique ; vGAT : transporteur vésiculaire du GABA ; GABAARα2 : sous-unité α2 du récepteur du GABAA. |
Enfin, en combinant des expériences de transfection de cultures primaires de neurones et des expériences d’injection stéréotaxique10 d’adénovirus au niveau de l’hippocampe, nous avons démontré que cette anomalie structurelle des synapses inhibitrices pouvait être corrigée par la sur-expression du gène Gabra2. Ce résultat particulièrement intéressant et prometteur laisse donc entrevoir de nouvelles pistes thérapeutiques pour ces patients. |
Anomalie des synapses GABAergiques et pathologies neurodéveloppementales : des pistes thérapeutiques Le GABA est le principal neurotransmetteur inhibiteur du système nerveux central chez les mammifères. L’équilibre dynamique entre excitation et inhibition des signaux synaptiques est crucial pour le bon fonctionnement des circuits neuronaux. Nous proposons donc que le phénotype cognitif observé chez nos patients soit en partie la conséquence d’un déséquilibre entre excitation et inhibition. Depuis plusieurs années, de nombreux laboratoires ont testé diverses molécules modulant la transmission GABAergique sur des modèles cellulaires et animaux de nombreuses maladies neurodéveloppementales liées à une dérégulation de la transmission GABAergique, telles que les syndromes de l’X fragile11,, de Rett12,, de Down13,, de Tourette14,, les troubles du spectre autistique, la schizophrénie ou la neurofibromatose15. Certaines de ces molécules font déjà l’objet d’essais cliniques. C’est le cas du traitement à la bumétanide, testé chez les patients atteints d’un syndrome de l’X fragile ou de troubles du spectre autistique, qui permet une amélioration des scores autistiques et intellectuels. Le ganaxolone, un neurostéroïde capable de stimuler les récepteurs GABA, est actuellement testé en phase 2 d’un essai clinique regroupant des enfants atteints du syndrome de l’X fragile, faisant suite aux résultats encourageants obtenus chez la souris [12]. Compte tenu des observations faites sur le modèle murin Nonogt, il serait intéressant de tester de telles molécules stimulatrices des récepteurs GABA chez ces souris. |
Notre travail a permis d’identifier un nouveau syndrome, MCCDI, cliniquement reconnaissable et lié à des mutations du gène NONO. Il s’agit de la première démonstration du rôle des protéines de la famille DBHS dans le développement du système nerveux central. Les travaux menés dans les cellules de patients et les souris Nonogt
ont permis une avancée majeure dans la compréhension de la physiopathologie de cette maladie. Enfin, nos résultats suggèrent que le syndrome MCCDI est une nouvelle maladie neurodéveloppementale liée au dysfonctionnement du système GABAergique, ouvrant ainsi la voie à de nouvelles approches thérapeutiques visant à corriger les anomalies de neurotransmission inhibitrice observées chez ces malades. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
American Psychiatric Association . Diagnostic and statistical manual of mental disorders. (5th ed) (5th ed. ). Washington, DC: : American Psychiatric Publishing; , 2013. 2.
Harel S, Jenna S. Soigner la déficience intellectuelle : la recherche d’équilibre . Med Sci (Paris). 2011; ; 27 : :70.–76. 3.
De Ligt J, Willemsen MH, van Bon BW, et al. Diagnostic exome sequencing in persons with severe intellectual disability . N Engl J Med. 2012; ; 367 : :1921.–1929. 4.
Mircsof D, Langouet M, Rio M, et al. Mutations in NONO lead to syndromic intellectual disability and inhibitory synaptic defects . Nat Neurosci. 2015; ; 18 : :1731.–1736. 5.
Deciphering Developmental Disorders Study . Large-scale discovery of novel genetic causes of developmental disorders . Nature. 2015; ; 519 : :223.–228. 6.
Shav-Tal Y, Zipori D. PSF and p54(nrb)/NonO: multi-functional nuclear proteins . FEBS Lett. 2002; ; 531 : :109.–114. 7.
Kowalska E, Ripperger JA, Muheim C, et al. Distinct roles of DBHS family members in the circadian transcriptional feedback loop . Mol Cell Biol. 2012; ; 32 : :4585.–4594. 8.
Jacob TC, Bogdanov YD, Magnus C, et al. Gephyrin regulates the cell surface dynamics of synaptic GABAA receptors . J Neurosci. 2005; ; 25 : :10469.–10478. 9.
Panzanelli P, Gunn BG, Schlatter MC, et al. Distinct mechanisms regulate GABAA receptor and gephyrin clustering at perisomatic and axo-axonic synapses on CA1 pyramidal cells . J Physiol. 2011; ; 589 : :4959.–4980. 10.
Tyagarajan SK, Fritschy JM. Gephyrin: a master regulator of neuronal function? Nat Rev Neurosci. 2014; ; 15 : :141.–156. 11.
Tyagarajan SK, Ghosh H, Yevenes GE, et al. Regulation of GABAergic synapse formation and plasticity by GSK3beta-dependent phosphorylation of gephyrin . Proc Natl Acad Sci USA. 2011; ; 108 : :379.–384. 12.
Deidda G, Bozarth IF, Cancedda L. Modulation of GABAergic transmission in development and neurodevelopmental disorders: investigating physiology and pathology to gain therapeutic perspectives . Front Cell Neurosci. 2014; ; 8 : :119.. 13.
Inserm . Déficiences intellectuelles. Expertise collective . Paris: : Éditions Inserm-EDPsciences, mai; 2016 : :1176. p. |