| |
| Med Sci (Paris). 32(6): 587–589. doi: 10.1051/medsci/20163206021.Mission phagocytose : comment adapter ses armes à la taille de la cible Angéline Charbonnier,1a Gérémy Sannier,1b and Sophie Dupré2c 1M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 2Laboratoire de chimie physique, UMR8000, CNRS, université Paris-Saclay, 91405Orsay, France MeSH keywords: Chimiotaxie, Homéostasie, Humains, Phagocytose, Phosphatidylinositol 3-kinases, Liaison aux protéines, Transduction du signal, physiologie, métabolisme |
La phagocytose : se débarrasser des « éléments gênants » La phagocytose est un processus mis en œuvre par des cellules immunitaires spécialisées (polynucléaires neutrophiles, macrophages, cellules dendritiques) pour internaliser des micro-organismes et des cellules apoptotiques. La cellule émet des expansions cytoplasmiques mobiles, les pseudopodes, autour de la cible afin de l’enfermer dans un compartiment, le phagosome. Dans ce phagosome, la cible est dégradée grâce à des armes telles que les formes réactives de l’oxygène et des enzymes déversées dans le phagosome. Deux catégories de ligands sont reconnues par les cellules phagocytaires : des molécules présentes à la surface du pathogène ou de la cellule apoptotique, et des opsonines, c’est-à-dire des molécules de l’organisme qui se fixent sur la cible à phagocyter. Les immunoglobulines produites par le système immunitaire adaptatif sont des opsonines. Des récepteurs pour la partie Fc des immunoglobulines (FcR), présents à la surface des phagocytes, peuvent lier la cible recouverte d’immunoglobulines et déclencher la phagocytose [1]. Les cibles phagocytaires sont de tailles, formes et natures différentes. Quelques études suggèrent que la phagocytose des cibles pourrait différer selon la taille de ces cibles. |
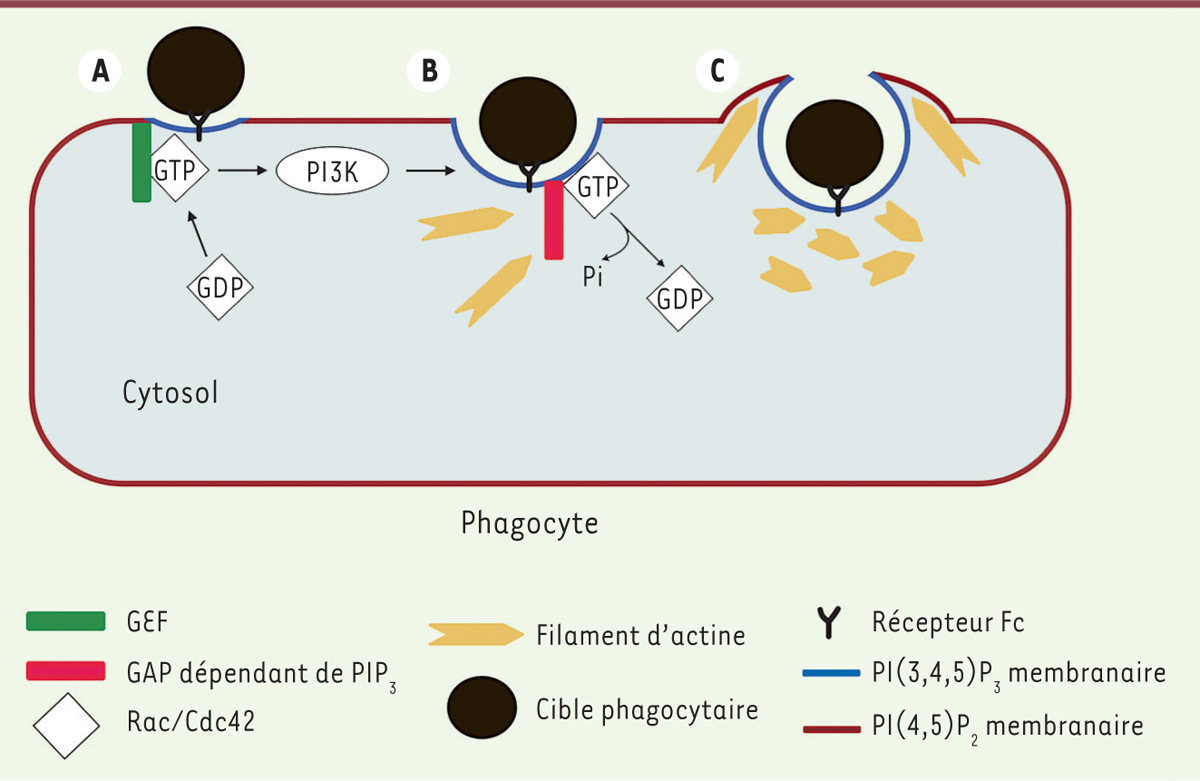
Encercler la cible : un piège dépendant de l’actine L’article de Schlam et al. [2] démontre ainsi de façon élégante que les mécanismes d’internalisation de la cible par la cellule varient selon la taille de la cible, et met en évidence de nouveaux acteurs impliqués dans la phagocytose de cibles de grande taille (≥ 5 µm). L’internalisation de la cible nécessite une distorsion de la membrane plasmique pour former les pseudopodes. Ce phénomène implique une modification transitoire du cytosquelette, notamment de l’actine dont la polymérisation met en jeu le complexe Arp2/3 (actin related protein 2/3) activé par des cofacteurs protéiques recrutés par des petites GTPases de la famille Rho:Rac (Ras-related C3 botulinum toxin substrate 1) et Cdc42 (cell division cycle 42 homolog). Ces GTPases sont activées par les FcR lors de la phagocytose [3]. Rac et Cdc42 sont de petites protéines G qui alternent entre une forme active (liée au GTP) et une forme inactive (liée au GDP). Elles sont présentes dans le cytosol sous forme inactive associées à une protéine RhoGDI (GDP dissociation inhibitor). La dissociation de la protéine G du RhoGDI et son activation par une protéine GEF (guanine nucleotide exchange factor), qui catalyse l’échange du GDP contre un GTP, permet à la protéine G de s’ancrer à la membrane où elle active alors des effecteurs. La protéine G est ensuite inactivée par une protéine GAP (GTPase activating protein) qui accélère l’hydrolyse du GTP en GDP [4–6] (→).
(→) Voir à ce propos le numéro thématique Récepteurs couplés aux protéines G, m/s n° 10, octobre 2012
La polymérisation d’actine débute au niveau d’une structure en coupelle, la coupe phagocytaire, formée lors du déclenchement de la phagocytose ; elle se poursuit au niveau des pseudopodes. La polymérisation d’actine au niveau des pseudopodes et la fermeture du phagosome s’accompagnent, dans le cas de la phagocytose de grosses particules, d’une dépolymérisation de l’actine au niveau de la coupe phagocytaire (Figure 1). Ce n’est pas le cas pour les petites particules (de la taille d’une bactérie) pour lesquelles la dépolymérisation d’actine s’effectue après la fermeture du phagosome. Les raisons de cette dépolymérisation très spécifique de la phagocytose des grosses particules ne sont pas claires : traduit-elle la nécessité d’un recyclage des composants requis pour la polymérisation de l’actine dans les pseudopodes ? Est-ce pour permettre l’exocytose focalisée de vésicules nécessaires à l’apport de membrane afin de permettre l’extension des pseudopodes [2] ?
 | Figure 1.
La PI3K, agent indispensable pour l’encerclement de la cible phagocytaire. A. Les récepteurs Fc activent la phosphoinositide 3-kinase (PI3K) et des GEF (guanine exchange factor). La PI3K phosphoryle le PI(4,5)P2 en PI(3,4,5)P3. Les GEF activent les petites protéines G Rac et Cdc42, en échangeant le GDP contre du GTP. Rac et Cdc42 liées au GTP sont recrutées à la membrane. B. L’activation de Rac/Cdc42 entraîne la polymérisation de l’actine à la coupe phagocytaire. Des GAP (GTPases activating protein) sont ensuite recrutées via le PIP3 en premier lieu à la coupe phagocytaire. Celles-ci, en accélérant l’hydrolyse du GTP par Rac et Cdc42, induisent l’inactivation de ces protéines à la coupe phagocytaire. C. L’inactivation de Rac/Cdc42 entraîne l’arrêt de la polymérisation de l’actine, celle-ci est alors dépolymérisée au niveau de la coupe phagocytaire. Ce mécanisme permettrait le recyclage de constituants nécessaires à la polymérisation de l’actine dans les pseudopodes. Les pseudopodes vont ensuite encercler la cible. |
L’ingestion de grosses particules par les cellules phagocytaires nécessite de plus la présence de phosphatidylinositol-3,4,5-trisphosphate (PIP3), ce qui n’est pas le cas pour les petites particules. Ce PIP3 est généré à partir du phosphatidylinositol-4,5-bisphosphate (PIP2) présent dans la membrane plasmique des cellules, par la phosphoinositide 3-kinase (PI3K) de classe I activée par les FcR lors de la phagocytose. Or, c’est un nouveau rôle de cette PI3K dans la polymérisation de l’actine lors de la phagocytose de grosses particules que démontre l’article de Schlam et al [2]. |
Un nouveau rôle de la PI3K démasqué Afin de visualiser l’actine et les différents acteurs participant à l’englobement de la cible, les auteurs utilisent une lignée de macrophage et des monocytes humains exprimant des protéines couplées à des variants de la GFP (green fluorescent protein), ainsi qu’un marqueur spécifique des filaments d’actine. Les cibles sont des billes de tailles variables et des érythrocytes recouverts d’immunoglobulines. Les expériences d’immunofluorescence, réalisées à différents temps du processus de phagocytose, sont suivies d’observations en microscopie confocale dans différentes conditions. Ainsi, l’utilisation d’un inhibiteur de la PI3K bloque la phagocytose de grandes cibles (8,3 µm) au stade de coupe phagocytaire (Figure 1) et les filaments d’actine s’accumulent au niveau de cette coupe phagocytaire et ne se dépolymérisent pas. La phagocytose de petites particules (1,6 µm) n’est, quant à elle, pas affectée par cet inhibiteur de la PI3K. L’utilisation d’un biosenseur qui lie Rac et Cdc42 sous forme active montre une colocalisation de ce biosenseur et des filaments d’actine de la coupe phagocytaire lors des phases initiales de la phagocytose de grosses particules, colocalisation qui se restreint ensuite uniquement aux pseudopodes. Si on inhibe la PI3K, les RhoGTPases restent sous forme active au niveau de la coupe phagocytaire et l’émission de pseudopodes ne s’effectue pas. La PI3K agirait donc en inhibant l’activité de Rac et Cdc42. Elle peut le faire de deux manières : en inhibant les GEF ou en activant les GAP. La première hypothèse est réfutée par les auteurs car la surexpression d’une GEF au phagosome n’empêche pas la phagocytose [2]. L’activation de protéines GAP est donc sans doute la clé de l’inactivation des petites GTPases. Cette inactivation terminerait la polymérisation d’actine au niveau de la coupe phagocytaire. |
À la recherche des nouvelles recrues de la PI3K Pour identifier les recrues de la PI3K, les auteurs réalisent un criblage des 62 RhoGAP potentiellement impliquées. Celles-ci sont étiquetées avec une protéine fluorescente et exprimées indépendamment dans une lignée de macrophages. Leur distribution subcellulaire est alors suivie par microscopie confocale pendant la phagocytose, ce qui permet d’identifier l’accumulation de 10 représentants de la famille RhoGAP au niveau de la coupe phagocytaire. La seconde étape du criblage consiste à vérifier l’expression endogène des 10 candidats : les ARNm de 6 d’entre eux sont détectés par RT-PCR (reverse transcriptase-polymerase chain reaction). L’étau se resserre finalement autour de 3 candidats : ARHGAP12, ARHGAP25 et SH3BP1, dont la localisation au phagosome s’avère dépendante de l’activité de la PI3K. Ces 3 protéines sont connues pour être des GAP agissant sur Rac et/ou Cdc42 [7–9]. Les auteurs effectuent ensuite des étapes de validation supplémentaires en surexprimant ou en inhibant ces RhoGAP. Celles-ci sont nécessaires à la phagocytose de grosses particules mais pas à celles de petites particules dont la phagocytose s’avère indépendante de la PI3K [2]. |
La PI3K : un agent du recyclage ? Schlam et al. démontrent ainsi que l’activation de la PI3K permet le recrutement de RhoGAP à la coupe phagocytaire afin d’inactiver les RhoGTPases lors de la phagocytose de grosses particules (par exemple une cellule apoptotique). Cette inactivation induit l’arrêt de la formation des filaments d’actine, qui sont ensuite dépolymérisés par l’activation de protéines comme la gelsoline (Figure 1) [1]. Comment s’effectue le recrutement des RhoGAP ? ARHGAP12 et ARHGAP25 possèdent un domaine PH (pleckstrin homology) qui leur permettrait de lier le PIP3 produit par la PI3K [7, 8]. Ce n’est pas le cas de SH3BP1 qui ne possède pas de domaine de liaison au PIP3 connu. Son recrutement à la membrane implique son domaine BAR (bin amphiphysin Rvs), mais aucun lien avec le PIP3 n’a été établi [9]. Il reste, de plus, à découvrir si le PIP3 fonctionne uniquement comme recruteur, l’activation nécessitant alors d’autres facteurs, ou s’il joue le double rôle d’activateur et de recruteur. Schlam et al. proposent que la dépolymérisation d’actine à la base du phagosome (coupe phagocytaire) permet un recyclage de composants utiles à la polymérisation à l’avant du phagosome (au niveau des pseudopodes) [2]. Ces composants seraient en quantité limitante pour l’encerclement de cibles phagocytaires de grande taille. Cette dépolymérisation d’actine n’est pas nécessaire pour la phagocytose de petites particules. Cet article contribue à montrer l’hétérogénéité et la complexité du processus de phagocytose et suggère que la cellule module son arsenal d’attaque selon la taille de la cible à phagocyter. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Freeman SA, Grinstein S. Phagocytosis: receptors, signal integration, and the cytoskeleton . Immunol Rev. 2014; ; 262 : :193.–215. 2.
Schlam D, Bagshaw R, Freeman S, et al. Phosphoinositide 3-kinase enables phagocytosis of large particles by terminating actin assembly through Rac/Cdc42 GTPase-activating proteins . Nat Commun. 2015; ; 6 : :8623.. 3.
Deschamps C, Echard A, Niedergang F. Phagocytosis and cytokinesis: do cells use common tools to cut and to eat? Highlights on common themes and differences . Traffic. 2013; ; 14 : :355.–364. 4.
Colomba A. Rôle des GTPases de la famille Rho et de leurs régulateurs dans les propriétés transformantes des lymphomes anaplasiques NPM-ALK positifs . Thèse de sciences (cancérologie). Toulouse 3 : Université des Sciences Paul Sabatier; , 2007. 5.
Primeau M, Lamarche-Vane N. Coup d’œil sur les petites GTPases Rho . Med Sci (Paris). 2008; ; 24 : :157.–162. 6.
Bustelo X, Seauzau V, Berenjeno I. GTP-binding proteins of the Rho/Rac family: regulation, effectors and functions in vivo . BioEssays. 2007; ; 29 : :356.–370. 7.
Gentile A, D’Alessandro L, Lazzari L, et al. Met-driven invasive growth involves transcriptional regulation of Arhgap12 . Oncogene. 2008; ; 27 : :5590.–5598. 8.
Csépányi-Kömi R, Sirokmány G, Geiszt M, Ligeti E. ARHGAP25, a novel Rac GTPase-activating protein, regulates phagocytosis in human neutrophilic granulocytes . Blood. 2012; ; 119 : :573.–582. 9.
Parrini MC, Sadou-Dubourgnoux A. SH3BP1, an exocyst-associated RhoGAP, inactivates Rac1 at the front to drive cell motility . Mol Cell. 2011; ; 42 : :650.–661. |