| |
| Med Sci (Paris). 32(6-7): 598–605. doi: 10.1051/medsci/20163206023.Les modèles animaux de l’anémie de Fanconi Ou comment les différences peuvent être aussi précieuses que les similitudes… Émilie L. Dubois,1,2 Mariline Béliveau,1,2 and Jean-Yves Masson1,2* 1Département de biologie moléculaire, biochimie médicale, et pathologie et Centre de Recherche sur le Cancer, Université Laval, Canada 2CRCHU de Québec, axe oncologie, 9 McMahon, Québec, QC, G1R 3S3, Canada |

Pour mieux comprendre l’étiologie d’une maladie, l’étude des propriétés ex vivo des protéines mutées est importante, mais ne peut suffire. De plus, certains mécanismes physiologiques sont, à l’heure actuelle, difficiles à reproduire en laboratoire (comme la méiose, l’hématopoïèse). Les modèles animaux représentent alors un outil précieux pour prendre en compte toute la complexité d’un organisme et compléter les études cellulaires [1] (→).
(→) Voir le Forum de Y. Bobinec, m/s n° 2, février 2003, page 248
L’anémie de Fanconi (AF) a été découverte en 1927 par le pédiatre suisse Guido Fanconi (voir Encadré). Dès les années 1990, des mutations bialléliques dans 19 gènes - codant les protéines FANC (Fanconi anemia proteins) - ont été identifiées (Figure 1). Dans l’ensemble, plus de 85 % des patients présentent des mutations dans FANCA, -C, -G et -D2. Le modèle actuel statue que ces protéines FANC sont impliquées dans une même voie moléculaire nommée FA-BRCA (Fanconi anemia/breast cancer). Elle a pour fonction de réparer un type particulier de dommages à l’ADN, à savoir les pontages interbrins de l’ADN (ou ICL pour interstrand crosslink). En parallèle, les protéines FANC participent aussi individuellement à d’autres mécanismes tels que l’apoptose, la progression du cycle cellulaire, la maintenance des télomères et la cytocinèse.
|
Étiologie de l’anémie de Fanconi L’anémie de Fanconi (AF) est une maladie héréditaire rare qui touche environ une personne sur 130 000 aux États-Unis et une sur 300 000 en France [58]. Près de 2 000 patients ont été diagnostiqués dans le monde. La complexité de l’AF se retrouve dans la grande hétérogénéité de ses symptômes (aplasie médullaire, malformations congénitales et prédisposition à certains cancers). Les cellules de patients ont l’unique particularité d’être hypersensibles aux agents pontants, tels que la mitomycine C (MMC) et le diépoxybutane (DEB), molécules actuellement employées pour confirmer le diagnostic qui peut s’avérer difficile [58]. Chaque mutation causant la maladie définit un groupe de complémentation qui est basé sur le principe que la sensibilité aux drogues des cellules des patients appartenant à un groupe peut être abolie lorsque ces cellules sont fusionnées à celles d’un patient d’un autre groupe. Chaque cellule complémente l’autre cellule en apportant la protéine inactivée ou absente chez l’autre cellule pour réobtenir une voie FA-BRCA (Fanconi anemia/breast cancer) fonctionnelle.
|
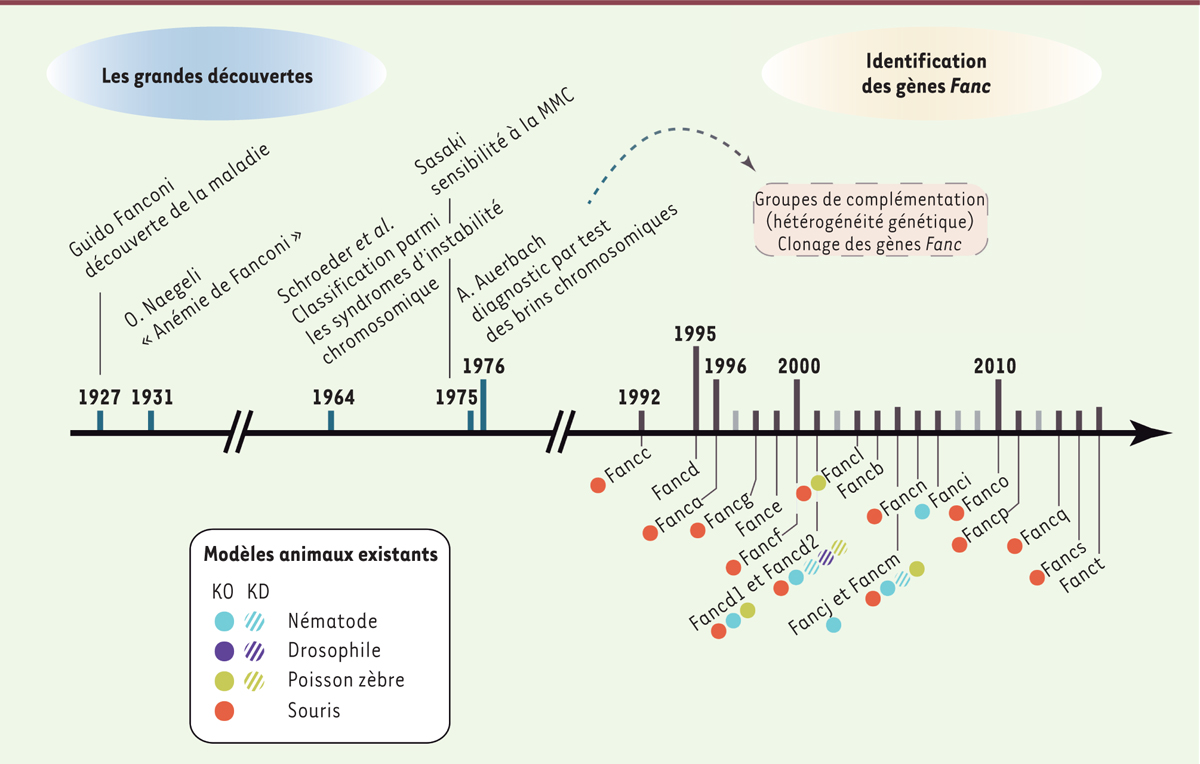
 | Figure 1.
Frise chronologique des grandes étapes de la recherche sur l’anémie de Fanconi (AF). Les étapes majeures de la recherche sur l’AF (zone bleue) ont débuté par la découverte de la maladie par Guido Fanconi et Otto Naegeli. Par la suite, les cellules de patients AF ont montré une forte instabilité génomique, accrue par un traitement à la MMC (mitomycine C), ce qui a permis d’établir une méthode diagnostique spécifique de l’AF [ 59]. Plus tard, la sensibilité unique de ces cellules aux agents pontant l’ADN a permis de définir les groupes de complémentation. L’identification progressive de ces groupes associés à un gène (zone rose) continue encore de nos jours. Les symboles pleins ronds indiquent l’existence d’un modèle animal totalement déplété en la protéine correspondante ( knock-out, KO), alors que les symboles hachurés réfèrent à des déplétions partielles ( knock-down, KD). |
Les ICL s’avèrent très délétères pour la cellule en compromettant la réplication et la transcription. Leur réparation fait intervenir la réparation par excision de nucléotide (NER), la synthèse translésionnelle (TLS) et la recombinaison homologue (RH). En premier lieu, un ICL stimule la formation dans le noyau d’un complexe dit cœur de huit protéines (FANCA, -B, -C, -E, -F, -G, -L et -M) (Figure 2). Grâce à son activité E3 ubiquitine ligase, FANCL mono-ubiquitine un deuxième complexe, formé des paralogues1 FANCI-FANCD2 (ou ID2), qui se relocalise sur l’ADN endommagé. Ces modifications sont interdépendantes, c’est-à-dire que chaque partenaire est requis pour l’ubiquitination de l’autre. Puis, ID2 coordonne diverses nucléases telles que FANCP/SLX4 et FANCQ/XPF ce qui permet de décrocher (en anglais unhook) l’ICL. Les polymérases translésionnelles réparent ensuite un duplex d’ADN, qui peut être utilisé comme matrice d’ADN par les protéines de la recombinaison homologue telles que FANCD1/BRCA2, FANCN/PALB2, FANCO/RAD51C, FANCR/RAD51 et FANCS/BRCA1, ce qui complète la réparation de l’ICL.
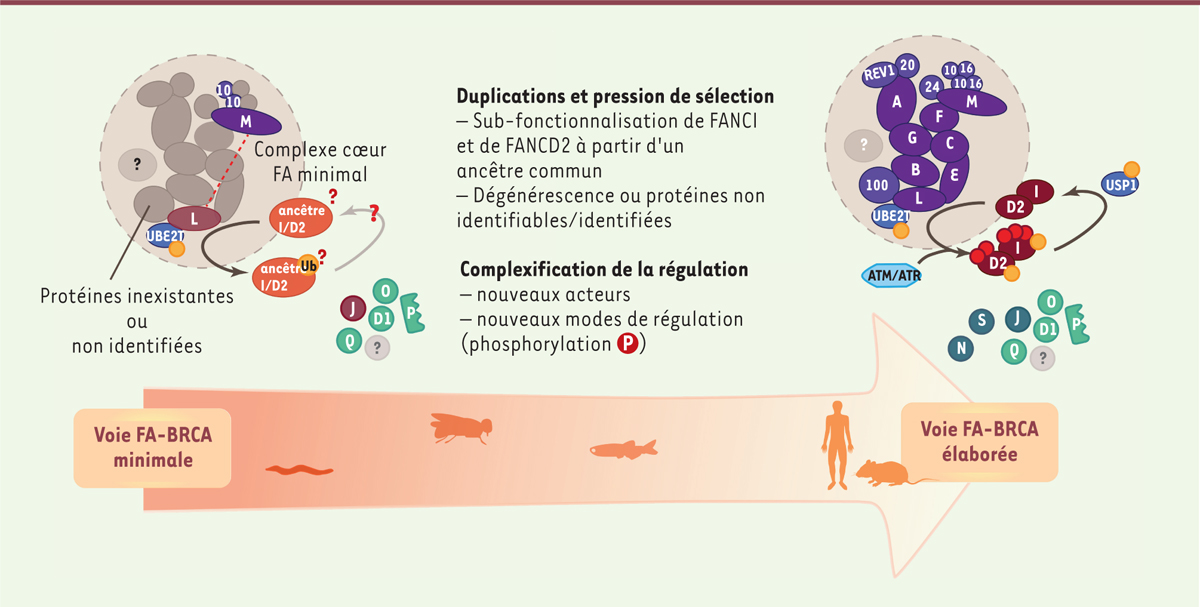
 | Figure 2.
La voie FA-BRCA (Fanconi anemia/breast cancer) au cours de l’évolution. Sur la base de recherches d’orthologues aux protéines FANC chez différentes espèces, une voie FA minimale semble exister chez certains organismes et se complexifier au moins à partir des Téléostéens (les Téléostéens comprennent la plus grande partie des poissons connus et forment un ordre de la classe des Ostéichtyens - poissons osseux). L’hypothèse d’une subfonctionalisation des gènes Fanc a été avancée pour dresser un modèle d’évolution de la voie FA-BRCA [ 5, 60]. Cette sub-fonctionnalisation correspond à une force au cours de l’évolution préservant l’intégrité des protéines dupliquées, de manière d’autant plus efficace que ces protéines jouent un grand nombre de fonctions [ 60]. Par la suite, les duplicats des protéines FANC auraient été perdus au cours de l’évolution du fait de la faible diversité de leurs fonctions propres [ 5] ou du risque de compromettre la stabilité du complexe à cause d’une stœchiométrie déséquilibrée. Cet enchaînement de duplication-dégénération de toutes les protéines FANC s’inscrit dans une tendance plus générale qui aurait touché près de 75 % des gènes et ne peut dès lors être dû seulement au hasard [ 5, 60]. La seule exception à cette règle concernerait les paralogues FANCI et FANCD2, dont les séquences nucléiques et protéiques sont des plus proches parmi les protéines FANC. Enfin, de nouveaux acteurs seraient venus réguler plus finement l’activation de la voie FA-BRCA et constituent les protéines du complexe cœur. Les phosphorylations de FANCI et FANCD2 par les kinases ATM ( ataxia telangiectasia mutated) et ATR ( ATM and RAD3-related) pourraient également être apparues à ce moment, mais aucune preuve n’appuie encore cette hypothèse. USP1 : ubiquitin specific peptidase 1 ; UBE2T : ubiquitin-conjugating enzyme E2T. |
En retraçant l’historique de la recherche sur l’anémie de Fanconi, il apparaît que l’utilisation du nématode, de la drosophile et du poisson zèbre a généré des données génétiques et biochimiques que les chercheurs n’auraient pas pu recueillir chez la souris. Cette revue a pour but de raisonner sur la transformation, au cours de l’évolution, de la voie FA-BRCA, via l’étude de divers modèles animaux. Les principales limites et certaines controverses auxquelles les chercheurs ont dû faire face sont également discutées. |
La voie FA-BRCA au cours du temps La conservation, à travers l’évolution, de la protéine étudiée est une condition déterminante pour permettre l’utilisation de modèles animaux. Les orthologues2 des protéines FANC ont été recherchés dans de très nombreuses espèces. Il en ressort que la voie FA-BRCA ne serait présente que chez les vertébrés, du fait de l’absence du complexe cœur chez la levure, le nématode et la mouche du vinaigre [2–4] (Figure 2). Cependant, une voie FA minimale est présente chez les invertébrés, sauf la levure. Elle comprend les protéines FANCM, FANCI, FANCD2, ainsi que FANCD1, FANCO et FANCP ; FANCL et FANCJ ne sont pas systématiquement présentes [2–6] (→).
(→) Voir la Synthèse de D. Papadopoulo et E. Moustacchi, m/s n° 8-9, août-septembre 2005, page 730
La démonstration de la fonctionnalité de la voie FA-BRCA minimale a été une étape majeure dans l’étude de l’anémie de Fanconi et cela malgré l’absence d’un grand nombre des constituants du complexe cœur présents chez les invertébrés. La conservation de ces protéines à travers les espèces, mais aussi un haut niveau de conservation de leurs domaines et de leurs régulations, sont des indices présageant l’importance de leurs fonctions au cours du temps. Par exemple, les protéines FANCI et FANCD2, conservées du nématode à l’homme, restent au cœur de la voie FA minimale. De plus, leur mono-ubiquitination est conservée et fonctionnelle au cours de l’évolution [2, 7]. Pour cause, les mono-ubiquitinations de FANCI et de FANCD2 sont l’événement clé associé à l’activation de la voie FA-BRCA. La détection de cette modification post-traductionnelle, dans les modèles animaux, argumente en faveur de fonctions biochimiques opérationnelles et conservées pour ces protéines. L’absence de mono-ubiquitination de FANCD2 et la sensibilité à la mitomycine C (MMC) ou au diépoxybutane (DEB) (Encadré 1) sont retrouvées dans les organismes mutants qui ont été générés en laboratoire tels que le ver à soie ou C. elegans. D’autres points communs avec les cellules humaines peuvent être relevés : des mutations inactivant FANCD2, FANCI ou FANCL induisent (1) un blocage des cellules en phase G2/M [2, 4, 8], (2) le maintien des foyers de RAD513, au cours de la méiose, traduisant l’absence de réparation des lésions [4]. Enfin, l’inactivation coordonnée de FANCD2 et du NHEJ (non homologous end joining – ou jonction des extrémités non homologues, JENH) supprime la sensibilité aux pontages de l’ADN [8], car le NHEJ prend en charge la réparation des ICL lorsque les voies FA-BRCA et RH (recombinaison homologue) sont inactives [8] Au final, ces études ne montrent pas seulement que certaines protéines FANC sont conservées au cours de l’évolution, mais elles démontrent également que la voie FA-BRCA minimale est parfaitement opérationnelle et prend en charge la réparation des ICL, au même titre que la voie plus élaborée. La question suivante émane alors : pourquoi les cellules de vertébrés ont-elles besoin d’autant de protéines dans le complexe cœur ? Difficile d’y répondre car malgré un mécanisme similaire, la plupart des protéines FANC ne présentent pas de domaine fonctionnel (sauf FANCL et FANCM) et la trop faible conservation de la séquence (nucléique et/ou protéique) pourrait empêcher les stratégies bio-informatiques de les détecter. Le plus grand nombre de protéines du complexe cœur élaboré pourrait réguler plus finement la voie FA-BRCA, dont la sur-activation et le maintien de l’ubiquitination sur FANCD2 serait néfaste [9]. De plus, l’absence de certains orthologues chez les procaryotes et les eucaryotes unicellulaires peut présager soit de partenaires perdus au cours du temps, soit d’un mécanisme alternatif prenant en charge la réparation des ICL, comme déjà proposé mais non identifié [10]. Les différentes étapes de l’évolution de la voie FA-BRCA au cours de l’évolution sont proposées dans la
Figure 2
. |
Les découvertes majeures apportées par les modèles animaux pour l’AF Le nématode
Caenorhabditis elegans est le modèle animal le plus éloigné phylogénétiquement de l’homme pour étudier l’anémie de Fanconi. Il représente cependant un outil très intéressant avec une manipulation facile, un génome entièrement décrypté et des banques de mutants préétablies. Certaines protéines du complexe cœur sont absentes dans cet organisme et d’autres distinctions avec les vertébrés ont été observées : (1) les mutants pour FANCD2 ne semblent pas développer de défauts méiotiques et (2) les foyers de ce dernier ne se localisent qu’aux ICL mais ni au niveau des cassures dues aux radiations ionisantes (IR) ni sur les chromosomes méiotiques [ 11, 12]. La seule nuance pouvant être apportée est le caractère facultatif de la formation de cassures double-brin pour initier la méiose chez C. elegans [ 13]. Il faut noter néanmoins que les études sur le ver ont initié la découverte de l’activité de déroulement des quadruplexes d’ADN par l’hélicase FANCJ [ 14], par la suite confirmée dans les cellules humaines [ 15]. La drosophile La drosophile est un organisme moins proche de l’homme que la souris, mais elle représente un modèle plus facile d’utilisation pour effectuer des études génétiques. Même si sa physiologie d’invertébré peut causer des symptômes distincts de ceux retrouvés chez les patients atteints d’anémie de Fanconi, elle a l’avantage d’avoir une voie FA-BRCA minimale. De manière intéressante, l’inactivation tissus-spécifique de FANCD2 n’a pas de conséquence phénotypique dans ce modèle. En revanche, la diminution de son expression à l’échelle de l’organisme entier est létale au stade de pupe 4 [ 16]. Dans un autre registre, les mutants FANCD2 ne développent de tumeurs qu’après un traitement à la moutarde à l’azote [ 16]. L’obtention de phénotypes similaires pour les drosophiles déplétées en FANCD2 et/ou en FANCL indique une relation épistatique 5, [ 16]. D’autres arguments laissent présager de fonctions additionnelles à la voie FA-BRCA pour FANCM : (1) une plus forte mortalité liée à sa déplétion ubiquitaire, (2) des sensibilités aux agents alkylants et aux radiations ionisantes variables (IR) et, (3) des réponses cellulaires en phase S inverses de celles des autres drosophiles mutantes [ 16, 17]. De plus, FANCM serait impliqué dans la régulation des crossing-over
6, mitotiques et méiotiques [ 17]. Enfin, bien que FANCL et FANCM soient les seuls constituants du complexe cœur chez la mouche, ils restent théoriquement suffisants pour détecter un ICL, et mono-ubiquitiner FANCD2. La détection d’une interaction directe entre FANCI ou FANCD2 avec FANCL conforte l’hypothèse d’un complexe cœur épuré [2] et sa fonctionnalité n’est conceptuellement pas impossible. En revanche, l’absence de protéines essentielles, assistant RAD51 comme FANCN et FANCS, reste incomprise. Des interactions putatives entre FANCD2, RAD51, et BLM (Bloom syndrome protein) pourraient compenser. D’autres partenaires protéiques non identifiés pourraient également remplacer les orthologues humains [16], mais ces hypothèses restent à vérifier. Le poisson zèbre Le poisson zèbre, Danio rerio, est un outil de choix pour étudier les maladies humaines : petite taille, animaux transparents pour étudier le développement embryonnaire, le cancer et le processus métastatique [ 5, 18]. Les recherches d’orthologie ont confirmé une grande conservation tant de l’organisation intragénique que du voisinage chromosomique des gènes Fanc [ 18]. L’existence de la mono-ubiquitination de FANCD2 confirme la fonctionnalité de la voie FA-BRCA chez cet organisme [ 19]. Cependant, les différences d’expression des protéines FANC chez le poisson zèbre [ 18] suggèrent une éventuelle implication dans d’autres processus biologiques. Une localisation dans les mêmes tissus et aux mêmes stades du développement indiquerait une seule fonction commune, ce qui n’est pas observé. De manière intéressante, une contribution maternelle, lors de la fécondation de l’oocyte, a été montrée pour la première fois : le gamète femelle produirait la quantité suffisante de protéines FANC jusqu’à ce que le zygote soit capable de les synthétiser par lui-même, assez rapidement après la fécondation [ 18]. Cette implication dans l’embryogenèse limiterait vraisemblablement l’instabilité génomique qui émane des multiples et rapides divisions cellulaires formant le nouvel organisme [ 5, 18], ce qui renforce le caractère essentiel de la voie FA-BRCA. Il a aussi été reporté que la perte de FANCL, ou de FANCD1/BRCA2 ( breast cancer 2), induit un déséquilibre sexuel en faveur des mâles. En effet, la plupart des oocytes déplétés en ces protéines meurent par apoptose – qui dépend de la protéine p53 – et les oocytes restants ne produisent pas suffisamment d’hormones féminisantes pour générer des femelles [ 20, 21]. En parallèle, les cellules somatiques des gonades de ces animaux mutants sont également sujettes à une prolifération néoplasique, habituellement retrouvée dans des organismes plus âgés. La voie apoptotique, activée par p53, semble limiter cette tumorigenèse accélérée, même si sa réactivation ne permet pas d’obtenir des gonades fonctionnelles [ 21]. La souris La plupart des protéines FANC ont été inactivées individuellement ou en combinaison chez la souris. Les revues de la littérature de Parmar et al. [ 22] et de Bakker et al. [ 23] en dressent une synthèse complète. Nous nous attarderons ici, à ne traiter que de la rationalisation des controverses actuelles. Tout d’abord, bien que la souche C57BL/6J présente des phénotypes plus marqués que les autres souches (129, FVB, BALBc) [23, 24], un rôle plus important pendant le développement embryonnaire et/ou des fonctions additionnelles de certaines protéines FANC pourraient causer une mortalité embryonnaire (modèles murins invalidés Fancd2-/-, Palb2-/-, Brca1-/- et Brca2-/-) et une faible proportion des groupes de complémentation humains correspondants. La mortalité embryonnaire chez les animaux Fancd2-/-Fancg-/- traduit que ces deux protéines ne sont pas épistatiques, c’est-à-dire que l’une de ces deux protéines (ou les deux) pourraient avoir des fonctions dans une autre voie métabolique distincte de la voie FA-BRCA [25]. D’autres doubles mutants (Fanca-/-Fancc-/- [26], Fancc-/-Fancg-/- [27] et Fanca-/-Fancg-/- [28]) mènent quant à eux à des conclusions contradictoires. Aussi, le phénotype des souris Usp1-/- (délétées pour le gène ubiquitin specific peptidase 1) est similaire à celui des souris AF déficientes. La plus grande sévérité de l’atrophie ovarienne chez les souris femelles Usp1-/-Fancd2-/- par rapport aux simples mutants [24], met en lumière l’importance de la régulation de la voie FA-BRCA, via la dé-ubiquitination du complexe FANCI-FANCD2. Dans un second temps, suite à l’absence de certains phénotypes observables chez les souris FA, d’éventuels facteurs endogènes à l’origine d’une instabilité génomique ont été recherchés. Ainsi, l’équipe de K. Patel s’est largement investie en ce sens. Elle a montré que le métabolisme de l’éthanol joue un rôle décisif [29–31]. Les métabolites réactifs qui en découlent, comme certains aldéhydes, peuvent en effet induire des ICL lorsqu’ils ne sont pas assez rapidement détoxifiés par les aldéhyde déhydrogénases (ALDH) qui les oxydent en acétate [32]. La capacité de ces réactifs à stimuler la mono-ubiquitination de FANCD2 avait établi un premier lien avec l’anémie de Fanconi [33]. Les souris Aldh2-/-Fancd2-/- meurent à mi-gestation lorsque la mère est mutée Aldh2-/- mais pas lorsqu’elle est de type sauvage pour l’ALDH2 (Aldh2+/-), soulignant un autre type de contribution maternelle essentielle [29]. Des études ont montré un lien direct entre alcoolisme et malformations développementales dans une population sans pathologie. Chez les patients atteints de l’anémie de Fanconi, ces malformations pourraient être plus fréquentes encore à la suite d’une consommation d’éthanol durant la grossesse [29, 30 , 31]. Dans la même famille d’enzymes, ADH5 (alcohol dehydrogenase) [34] semble également impliquée dans l’apparition des traits de l’anémie de Fanconi : sa déplétion dans les cellules de poulet DT40 (lignée de cellules lymphocytaires B de poulet), préalablement déplétées en FANCD2, induit une létalité synthétique, ce qui signifie que les deux protéines ne seraient pas impliquées dans la même voie métabolique [35]. Enfin, dernier lien entre anémie de Fanconi et aldéhydes, la superoxyde dismutase (SOD1). Cette enzyme est connue pour diminuer la quantité de dommages oxydatifs, pouvant expliquer l’insuffisance médullaire chez les souris Fancc-/-Sod1-/-, contrairement aux simples mutants qui ne présentent pas ce phénotype [36]. Cependant, l’impact direct de la toxicité des aldéhydes réactifs peine à expliquer les problèmes développementaux ainsi que l’apparition d’anémie et de cancers, soit tardive soit absente des modèles murins. En premier lieu, le système hématopoïétique murin est plus robuste que celui de l’homme et les souris sont élevées dans des environnements bien plus protecteurs que les patients atteints d’anémie de Fanconi (absence de stress et de prédateur(s) ; luminosité, humidité et température maîtrisées et constantes ; alimentation régulière et adaptée ; absence de contact avec des pathogènes, des bactéries ou des virus ni même avec des substances toxiques, alcool, tabac, pollution, etc.). Le temps nécessaire à la tumeur pour se développer pourrait aussi être plus long que l’espérance de vie des souris [37], et tant que les cellules AF ne sont pas dans un contexte stressant (forcées à se mobiliser pour repeupler la moelle osseuse ou à se répliquer), elles parviennent à compenser leur faible nombre. Enfin, il a été avancé que la défaillance de la moelle osseuse chez les patients présentant l’anémie de Fanconi serait due à une entrée accélérée des cellules souches hématopoïétiques dans le cycle cellulaire afin de compenser leur moins grand nombre. Ce processus protègerait la moelle osseuse à court terme, mais épuiserait la réserve de cellules souches en les précipitant vers leur recyclage [23]. Un autre point à nuancer est l’absence de prédisposition au cancer. Il est connu que les souris développent plus spontanément des tumeurs d’origine mésenchymateuse (exceptées les souris Fancd2-/- [38]), contrairement à l’homme où elles sont davantage d’origine épithéliale. D’autre part, les cancers ovariens des souris Fancf-/- auraient pour origine une dérégulation des hormones sexuelles liées à l’hypogonadisme [39]. Le modèle actuellement admis est le suivant : les protéines FANC limitent les dommages à l’ADN – qui activent p53. Elles ont alors pour effet de prévenir, ou limiter, la transformation tumorale [40, 41]. Mais il se pourrait également que les processus de tumorigenèse soient différents chez la souris et chez l’homme. Il est aussi connu qu’un raccourcissement des télomères contribue à la tumorigenèse et à l’apparition de l’anémie. Or, les souris possèdent des télomères 40 à 60 fois plus longs que ceux de l’homme. Ceci pourrait ralentir la vitesse d’apparition de ces phénotypes [23]. Les souris Fancc-/-Tert+/- (telomerase reverse transcriptase) ont ainsi permis de montrer que la voie FA-BRCA serait impliquée dans le maintien de la longueur des télomères lorsque les cellules hématopoïétiques sont stressées [42]. Enfin, une diminution du nombre de cellules souches primordiales embryonnaires expliquerait les problèmes de fertilité et le retard staturo-pondéral (un retard de croissance lié à la taille et au poids) chez la souris [23, 43, 44]. Il a été confirmé chez le poisson zèbre [20, 43, 44] que les protéines FANC influencent la survie et la prolifération des cellules souches germinales [45]. Lors de la reprogrammation de ces dernières, des dommages à l’ADN sont induits spontanément, pouvant mener à l’apoptose médiée par p53 [46]. Ainsi, la voie FA-BRCA pourrait permettre de maintenir la stabilité du génome dans les cellules souches en prolifération et en reprogrammation. Concernant la fertilité, le fait que les souris Fancp-/- ne présentent aucun défaut méiotique reste à expliquer [47], car FANCP participe à la résolution des mésappariements des chromosomes méiotiques. Mitose et méiose confondues, la voie FA-BRCA maintiendrait l’intégrité chromosomique des cellules souches. |
L’ensemble de ces modèles animaux a permis de mettre en évidence l’implication de la voie FA-BRCA dans des processus biologiques aussi variés que la survie des cellules souches (du moins gamétiques et hématopoïétiques), l’apoptose, la prévention de la tumorigenèse, la réparation des dommages endogènes causés par le métabolisme alcoolique et le stress oxydatif. De nombreuses questions restent encore à élucider pour déterminer les fondements biologiques et biochimiques de l’anémie, la prédisposition au cancer, la mortalité périnatale – absente de certains modèles murins –, les différents cas d’inversion de genre chez la souris et le poisson zèbre, les défauts développementaux, et les fonctions uniques et différentielles des protéines FANC. Pour expliquer les défauts développementaux, le poisson zèbre pourrait permettre d’examiner de nouvelles pistes, car certaines protéines (FANCI et FANCN) semblent fortement exprimées dans les cellules mésenchymales des centres germinatifs formant la nageoire pectorale [18]. Ce modèle pourrait aussi être très utile pour explorer les défauts squelettiques, absents des modèles murins, au même titre que la tumorigenèse et l’hématopoïèse, très semblables entre l’homme et le poisson zèbre. Les premiers liens entre anémie de Fanconi et aldéhydes émergent. Mais il reste à déterminer si la sensibilité des cellules FA aux acétaldéhydes est due aux dommages à l’ADN qu’ils génèrent. Les recherches sont à poursuivre pour déterminer la quantité basale d’acétaldéhydes produits par les différents organismes ainsi que la manière et l’efficacité avec lesquelles ils sont détoxifiés. Le formaldéhyde s’avère plus cancérigène pour les rats que pour les souris, présageant des différences inter-espèces. Pour l’instant, seules les souris sont utilisées, mais les études pourraient être étendues aux autres modèles in vivo existants. Les fonctions uniques et différentielles des protéines FANC sont un sujet d’un grand intérêt. Actuellement, les données mèneraient à une controverse à propos du complexe FANCI-FANCD2 [48], d’autant plus que de nombreuses fonctions ont été rapportées pour FANCD2, indépendamment de son partenaire [3, 49–52]. Chez le ver à soie, l’interaction entre FANCI et FANCD2 reste difficile à visualiser. Plusieurs hypothèses ont été avancées pour expliquer ce résultat : (1) les deux protéines n’interagissent pas in vivo, (2) leur interaction est très rapide, labile et transitoire, (3) des problèmes techniques empêchent sa détection [2]. Ces deux paralogues semblent avoir des patrons d’expression distincts au cours du développement embryonnaire du poisson zèbre, appuyant l’hypothèse de rôles distincts. Des modèles déplétés en FANCD2 ont été générés chez les quatre organismes [16, 38, 53, 54]. Il serait alors intéressant d’étudier des modèles animaux similaires dépourvus seulement de FANCI ou de FANCI et FANCD2, et ainsi déterminer s’ils portent des fonctions additionnelles, comme le suggère l’évolution de la voie FA-BRCA. Cet aspect est étudié dans notre laboratoire. À plus long terme, les souris (du moins Fancd2-/-) et le poisson zèbre apportent de grandes opportunités pour tester des régimes chimiopréventifs. Danio rerio développe en effet des cancers comparables à ceux retrouvés chez l’homme [55] et les modèles chez les mammifères sont bien trop complexes pour réaliser ces études [21]. Des premiers essais concluants ont déjà été menés avec le tempol, une drogue chimiopréventive qui retarderait de manière significative les cancers épithéliaux chez les femelles Fancd2-/-p53+/- [56]. Enfin, le poisson zèbre permet la réalisation de diverses études de mutagenèse pour identifier et cloner de nouveaux gènes Fanc non identifiés encore (Figure 2). Il pourrait également aider à concevoir et caractériser un large panel de nouvelles molécules thérapeutiques pour l’anémie de Fanconi [5, 57]. Pour conclure, la recherche sur l’anémie de Fanconi a grandement progressé dans sa connaissance de la voie FA-BRCA grâce à l’étude de la conservation des protéines FANC et la compréhension des différences de phénotypes entre l’homme et d’autres systèmes in vivo. La diversité dans l’utilisation de différents modèles est proprement la source de nouvelles découvertes. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient le laboratoire Masson pour les discussions sur le sujet. Ce projet est soutenu par les Instituts de Recherche en Santé du Canada. Jean-Yves Masson est chercheur National et chaire du Fonds de Recherche en Santé du Québec.
|
Footnotes |
1.
Bobinnec Y. L’apport des modèles animaux en biologie cellulaire . Med Sci (Paris). 2003; ; 19 : :248.–251. 2.
Sugahara R, Mon H, Lee JM, Kusakabe T. Monoubiquitination-dependent chromatin loading of FancD2 in silkworms, a species lacking the FA core complex . Gene. 2012; ; 501 : :180.–187. 3.
De Winter JP, Joenje H. The genetic and molecular basis of Fanconi anemia . Mutat Res. 2009; ; 668 : :11.–19. 4.
Youds JL, Barber LJ, Boulton SJ C. elegans: A model of Fanconi anemia and ICL repair . Mutat Res. 2009; ; 668 : :103.–116. 5.
Titus TA, Selvig DR, Qin B, et al. The Fanconi anemia gene network is conserved from zebrafish to human . Gene. 2006; ; 371 : :211.–223. 6.
Papadopoulo D, Moustacchi E. L’anémie de Fanconi : gènes et fonction(s) revisités . Med Sci (Paris). 2005; ; 21 : :730.–736. 7.
Smogorzewska A, Matsuoka S, Vinciguerra P, et al. Identification of the FANCI protein, a monoubiquitinated FANCD2 paralog required for DNA repair . Cell. 2007; ; 129 : :289.–301. 8.
Adamo A, Collis SJ, Adelman CA, et al. Preventing nonhomologous end joining suppresses DNA repair defects of Fanconi anemia . Mol Cell. 2010; ; 39 : :25.–35. 9.
Nijman SM, Huang TT, Dirac AM, et al. The deubiquitinating enzyme USP1 regulates the Fanconi anemia pathway . Mol Cell. 2005; ; 17 : :331.–339. 10.
Fan Q, Zhang F, Barrett B, et al. A role for monoubiquitinated FANCD2 at telomeres in ALT cells . Nucleic Acids Res. 2009; ; 37 : :1740.–1754. 11.
Collis SJ, Barber LJ, Ward JD, et al. C. elegans FANCD2 responds to replication stress and functions in interstrand cross-link repair . DNA Repair. 2006; ; 5 : :1398.–1406. 12.
Garcia-Higuera I, Taniguchi T, Ganesan S, et al. Interaction of the Fanconi anemia proteins and BRCA1 in a common pathway . Mol Cell. 2001; ; 7 : :249.–262. 13.
Dernburg AF, McDonald K, Moulder G, et al. Meiotic recombination in C. elegans initiates by a conserved mechanism and is dispensable for homologous chromosome synapsis . Cell. 1998; ; 94 : :387.–398. 14.
Cheung I, Schertzer M, Rose A, Lansdorp PM. Disruption of dog-1 in Caenorhabditis elegans triggers deletions upstream of guanine-rich DNA . Nat Genet. 2002; ; 31 : :405.–409. 15.
Wu Y, Shin-ya K, Brosh RM. FANCJ helicase defective in Fanconia anemia and breast cancer unwinds G-quadruplex DNA to defend genomic stability . Mol Cell Biol. 2008; ; 28 : :4116.–4128. 16.
Marek LR, Bale AE. Drosophila homologs of FANCD2 and FANCL function in DNA repair . DNA Repair. 2006; ; 5 : :1317.–1326. 17.
Kuo HK, McMahan S, Rota CM, Kohl KP. Drosophila FANCM helicase prevents spontaneous mitotic crossovers generated by the MUS81 and SLX1 nucleases . Genetics. 2014; ; 198 : :935.–945. 18.
Titus TA, Yan Y-LL, Wilson C, et al. The Fanconi anemia/BRCA gene network in zebrafish: embryonic expression and comparative genomics . Mutat Res. 2009; ; 668 : :117.–132. 19.
Scata KA, El-Deiry WS. Zebrafish: swimming towards a role for fanconi genes in DNA repair . Cancer Biol Ther. 2004; ; 3 : :501.–502. 20.
Rodríguez-Marí A, Cañestro C, BreMiller RA, et al. Sex Reversal in zebrafish fancl mutants is caused by Tp53-mediated germ cell apoptosis . PLoS Genet. 2010; ; 6 : :e1001034.. 21.
Rodríguez-Marí A, Wilson C, Titus TA, et al. Roles of brca2 (fancd1) in oocyte nuclear architecture, gametogenesis, gonad tumors, and genome stability in zebrafish . PLoS Genet. 2011; ; 7 : :e1001357.. 22.
Parmar K, D’Andrea A, Niedernhofer L. Mouse models of Fanconi anemia . Mutat Res. 2009; ; 668 : :133.–140. 23.
Bakker S, de Winter J, te Riele H. Learning from a paradox: recent insights into Fanconi anaemia through studying mouse models . Dis Model Mech. 2013; ; 6 : :40.–47. 24.
Kim J, Parmar K, Huang M, et al. Inactivation of murine Usp1 results in genomic instability and a Fanconi anemia phenotype . Dev Cell. 2009; ; 16 : :314.–320. 25.
Reliene R, Yamamoto ML, Rao PN, Schiestl RH. Genomic instability in mice is greater in Fanconi anemia caused by deficiency of Fancd2 than Fancg . Cancer Res. 2010; ; 70 : :9703.–9710. 26.
Noll M, Battaile K, Bateman R, et al. Fanconi anemia group A and C double-mutant mice: functional evidence for a multi-protein Fanconi anemia complex . Exp Hematol. 2002; ; 30 : :679.–688. 27.
Pulliam-Leath AC, Ciccone SL, Nalepa G, et al. Genetic disruption of both Fancc and Fancg in mice recapitulates the hematopoietic manifestations of Fanconi anemia . Blood. 2010; ; 116 : :2915.–2920. 28.
van de Vrugt HJ, Koomen M, Bakker S, et al. Evidence for complete epistasis of null mutations in murine Fanconi anemia genes Fanca and Fancg . DNA Repair. 2011; ; 10 : :1252.–1261. 29.
Langevin F, Crossan GP, Rosado IV, et al. Fancd2 counteracts the toxic effects of naturally produced aldehydes in mice . Nature. 2011; ; 475 : :53.–58. 30.
Garaycoechea JI, Crossan GP, Langevin F, et al. Genotoxic consequences of endogenous aldehydes on mouse haematopoietic stem cell function . Nature. 2012; ; 489 : :571.–575. 31.
Oberbeck N, Langevin F, King G, de Wind N. Maternal aldehyde elimination during pregnancy preserves the fetal genome . Mol Cell. 2014; ; 55 : :807.–817. 32.
Crabb DW, Matsumoto M, Chang D, You M. Overview of the role of alcohol dehydrogenase and aldehyde dehydrogenase and their variants in the genesis of alcohol-related pathology . Proc Nutr Soc. 2004; ; 63 : :49.–63. 33.
Marietta C, Thompson LH, Lamerdin JE, Brooks PJ. Acetaldehyde stimulates FANCD2 monoubiquitination, H2AX phosphorylation, and BRCA1 phosphorylation in human cells in vitro: Implications for alcohol-related carcinogenesis . Mutat Res. 2009; ; 664 : :77.–83. 34.
Pontel LB, Rosado IV, Burgos-Barragan G, et al. Endogenous formaldehyde is a hematopoietic stem cell genotoxin and metabolic carcinogen . Mol Cell. 2015; ; 60 : :177.–188. 35.
Rosado IV, Langevin F, Crossan GP, et al. Formaldehyde catabolism is essential in cells deficient for the Fanconi anemia DNA-repair pathway . Nat Struct Mol Biol. 2011; ; 18 : :1432.–1434. 36.
Hadjur S, Ung K, Wadsworth L, et al. Defective hematopoiesis and hepatic steatosis in mice with combined deficiencies of the genes encoding Fancc and Cu/Zn superoxide dismutase . Blood. 2001; ; 98 : :1003.–1011. 37.
Garaycoechea JI, Patel KJ. Why does the bone marrow fail in Fanconi anemia? Blood. 2014; ; 123 : :26.–34. 38.
Houghtaling S, Timmers C, Noll M, et al. Epithelial cancer in Fanconi anemia complementation group D2 (Fancd2) knockout mice . Genes Dev. 2003; ; 17 : :2021.–2035. 39.
Bakker ST, van de Vrugt HJ, Visser JA, et al. Fancf-deficient mice are prone to develop ovarian tumours . J Pathol. 2012; ; 226 : :28.–39. 40.
Freie B, Li X, Ciccone SL, et al. Fanconi anemia type C and p53 cooperate in apoptosis and tumorigenesis . Blood. 2003; ; 102 : :4146.–4152. 41.
Houghtaling S, Granville L, Akkari Y, et al. Heterozygosity for p53 (Trp53+/-) accelerates epithelial tumor formation in Fanconi anemia complementation group D2 (Fancd2) knockout mice . Cancer Res. 2005; ; 65 : :85.–91. 42.
Rhee DB, Wang Y, Mizesko M, et al. FANCC suppresses short telomere-initiated telomere sister chromatid exchange . Hum Mol Genet. 2010; ; 19 : :879.–887. 43.
Agoulnik AI, Lu B, Zhu Q, et al. A novel gene, Pog, is necessary for primordial germ cell proliferation in the mouse and underlies the germ cell deficient mutation, gcd . Hum Mol Genet. 2002; ; 11 : :3047.–3053. 44.
Nadler JJ, Braun RE. Fanconi anemia complementation group C is required for proliferation of murine primordial germ cells . Genesis. 2000; ; 27 : :117.–123. 45.
Raya A, Rodríguez-Pizà I, Guenechea G, et al. Disease-corrected haematopoietic progenitors from Fanconi anaemia induced pluripotent stem cells . Nature. 2009; ; 460 : :53.–59. 46.
Marión RM, Strati K, Li H, et al. A p53-mediated DNA damage response limits reprogramming to ensure iPS cell genomic integrity . Nature. 2009; ; 460 : :1149.–1153. 47.
Crossan G, van der Weyden L, Rosado I, et al. Disruption of mouse Slx4, a regulator of structure-specific nucleases, phenocopies Fanconi anemia . Nature Genet. 2011; ; 43 : :147.–152. 48.
Sareen A, Chaudhury I, Adams N, Sobeck A. Fanconi anemia proteins FANCD2 and FANCI exhibit different DNA damage responses during S-phase . Nucleic Acids Res. 2012; ; 40 : :8425.–8439. 49.
Sato K, Ishiai M, Toda K, et al. Histone chaperone activity of Fanconi anemia proteins, FANCD2 and FANCI, is required for DNA crosslink repair . EMBO J. 2012; ; 31 : :3524.–3536. 50.
Kohlhase S, Bogdanova NV, Schürmann P, et al. Mutation analysis of the ERCC4/FANCQ gene in hereditary breast cancer . PloS One. 2014; ; 9 : :e85334.. 51.
Lossaint G, Larroque M, Ribeyre C, et al. FANCD2 binds MCM proteins and controls replisome function upon activation of s phase checkpoint signaling . Mol Cell. 2013; ; 51 : :678.–690. 52.
Chaudhury I, Sareen A, Raghunandan M, Sobeck A. FANCD2 regulates BLM complex functions independently of FANCI to promote replication fork recovery . Nucleic Acids Res. 2013; ; 41 : :6444.–6459. 53.
Liu TX, Howlett NG, Deng M, et al. Knockdown of zebrafish Fancd2 causes developmental abnormalities via p53-dependent apoptosis . Dev Cell. 2003; ; 5 : :903.–914. 54.
Lee KY, Yang I, Park JE, et al. Developmental stage- and DNA damage-specific functions of C. elegans FANCD2 . Biochem Biophys Res Commun. 2007; ; 352 : :479.–485. 55.
Langheinrich U. Zebrafish: a new model on the pharmaceutical catwalk . Bioessays. 2003; ; 25 : :904.–912. 56.
Zhang QSS, Eaton L, Snyder ER, et al. Tempol protects against oxidative damage and delays epithelial tumor onset in Fanconi anemia mice . Cancer Res. 2008; ; 68 : :1601.–1608. 57.
Varshney GK, Lu J, Gildea DE, et al. A large-scale zebrafish gene knockout resource for the genome-wide study of gene function . Genome Res. 2013; ; 23 : :727.–735. 58.
Lanneaux J, Poidvin A, Soole F, et al. L’anémie de Fanconi en 2012: diagnostic, suivi pédiatrique, traitement . Arch Pediatr. 2012; ; 19 : :1100.–1109. 59.
Auerbach AD, Wolman SR. Susceptibility of Fanconi’s anaemia fibroblasts to chromosome damage by carcinogens . Nature. 1976; ; 261 : :494.–496. 60.
Force A, Lynch M, Pickett FB, et al. Preservation of duplicate genes by complementary, degenerative mutations . Genetics. 1999; ; 151 : :1531.–1545. |