| |
| Med Sci (Paris). 32(8-9): 674–677. doi: 10.1051/medsci/20163208005.Au-delà du cerveau La huntingtine dans les cancers du sein Morgane S. Thion1 and Sandrine Humbert2,3* 1École Normale Supérieure, Institut de Biologie de l’École Normale Supérieure (IBENS), Inserm U1024, CNRS UMR 8797, 46, rue d’Ulm, 75230Paris Cedex 05, France 2Université Grenoble Alpes, Grenoble Institut des Neurosciences GIN, chemin Fortuné Ferrini, 38000Grenoble, France 3Inserm U1216, chemin Fortuné Ferrini, 38000 Grenoble, France MeSH keywords: Animaux, Marqueurs biologiques tumoraux, Encéphale, Tumeurs du sein, Transformation cellulaire néoplasique, Femelle, Humains, Protéine huntingtine, Tumeurs mammaires de l'animal, Souris, Phosphorylation, Pronostic, génétique, métabolisme, physiologie, diagnostic, anatomopathologie |
La huntingtine (HTT) est une protéine d’échafaudage ubiquitaire au centre de multiples voies de signalisation [1]. Elle participe à des fonctions indispensables au bon fonctionnement cellulaire telles que la division cellulaire, la transcription et le transport intracellulaire. Cette protéine est surtout connue, sous sa forme mutée, pour être responsable de la maladie de Huntington (MH), une maladie neurodégénérative héréditaire sans traitement curatif [1]. À l’origine de cette maladie, on trouve en effet une expansion anormale de poly-glutamines (polyQ) dans la protéine HTT. Ceci explique que, bien que d’expression ubiquitaire, la HTT est principalement étudiée dans le système nerveux. Cependant, les individus atteints de la MH présentent des symptômes périphériques qui ne seraient pas uniquement des conséquences secondaires du dysfonctionnement cérébral mais seraient liés à l’expression de la HTT mutante dans les organes périphériques atteints. Nous avons montré que la HTT est exprimée dans le tissu mammaire sain dont elle régule le développement [2, 3]. Nos travaux ont également décrit que la HTT, qu’elle soit sauvage ou mutante, participe à la progression tumorale dans les cancers du sein [4, 5]. |
Maladie de Huntington et cancers du sein La relation entre MH et cancer est paradoxale. Deux études soulignent que la prévalence des cancers est significativement moindre chez les individus atteints de la MH par rapport à la population générale ou à leurs proches non atteints de la maladie, et ce, pour tous les cancers sauf ceux de la cavité buccale et du pharynx [6, 7]. Les auteurs n’ont cependant pas eu accès à la longueur de la répétition de glutamines, ni aux caractéristiques clinico-pathologiques (grade, métastase, survie) des cancers développés par les individus participant à ces études. La répétition de glutamines pourrait être à l’origine de la faible prévalence des cancers. Cette faible prévalence est en effet commune à plusieurs maladies causées par des expansions anormales de glutamines dans certaines protéines, suggérant l’existence de mécanismes communs [7]. La HTT mutante conduisant à la mort dans un contexte neuronal, il est envisageable qu’en modulant des voies de signalisations équivalentes, elle puisse protéger de l’apparition des cancers en favorisant la mort des cellules pré-néoplasiques. Cependant, bien que l’incidence du cancer du sein soit plus faible chez les patientes atteintes de la MH, lorsqu’un cancer du sein se déclare, il pourrait être, dans certains cas, plus agressif. Nous avons en effet montré que les carcinomes mammaires murins sont plus agressifs dans un contexte de MH que dans une situation contrôle [4]. La HTT polyQ accélère l’apparition et la progression tumorale des carcinomes mammaires in vivo et augmente leur potentiel métastatique. Quels sont les mécanismes impliqués ? L’expression de HTT mutante entraîne des dérégulations transcriptionnelles caractéristiques d’une activation et d’une surexpression des gènes impliqués dans l’invasion et le processus métastatique [4]. Au niveau cellulaire, la HTT polyQ interagit de façon anormale avec la dynamine, une protéine essentielle au recyclage du récepteur HER2 (human epidermal growth factor receptor 2)1, favorisant ainsi l’accumulation de ce dernier à la membrane plasmique des cellules, ce qui active les voies de signalisation pro-métastatiques. |
La HTT sauvage : un marqueur pronostic de différenciation tumorale ? Les cancers du sein sont très hétérogènes, tant d’un point de vue biologique que clinique. En utilisant un grand nombre d’échantillons de tumeurs humaines, nous avons montré que l’expression de la HTT corrèle avec le stade de différenciation tumorale mammaire [5]. Une forte expression transcriptionnelle et protéique de HTT est associée aux cancers de bas grade (de bon pronostic) et aux sous-types moléculaires humains les plus différenciés. À l’opposé, une faible expression est prépondérante dans les cancers de haut grade peu différenciés. Les carcinomes mammaires de type luminal2 expriment ainsi fortement la HTT en comparaison au type HER22 qui, lui-même, exprime des niveaux plus importants de HTT que le type basal2 (pour une revue sur les différents types de cancer du sein voir [8]) (→).
(→) Voir la Synthèse de E. Charafe-Jauffret et al., m/s n° 6-7 juin-juillet 2007, page 626
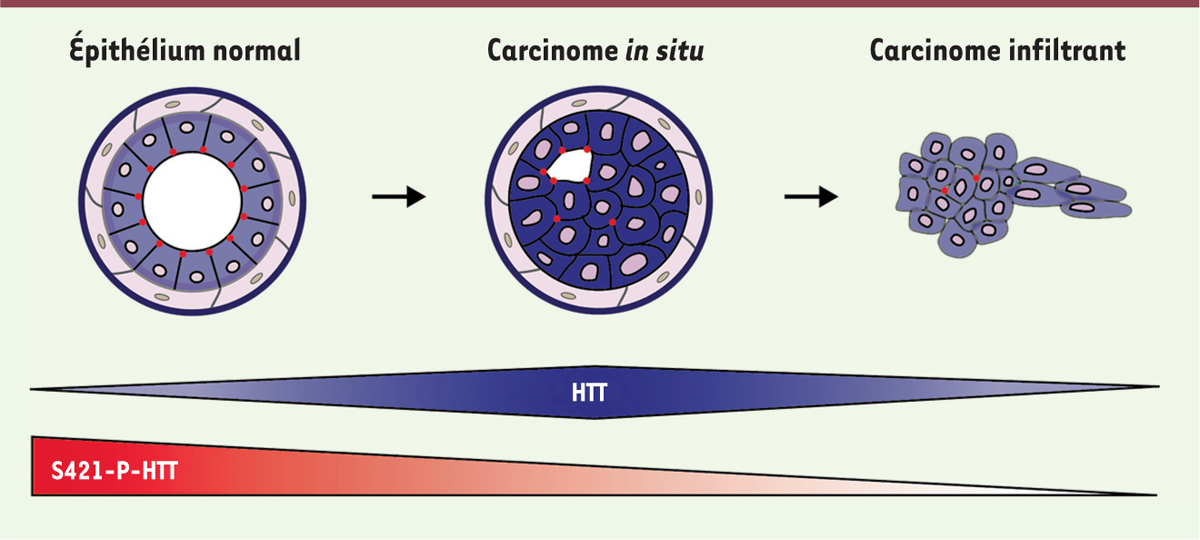
Enfin, l’expression transcriptionnelle de la HTT est diminuée dans les cancers métastatiques humains. Au niveau histologique, l’expression de la HTT est accrue dans les carcinomes in situ en comparaison du tissu sain et des carcinomes infiltrants (Figure 1) [5]. La HTT est principalement présente au niveau cytoplasmique, cependant, dans certains carcinomes in situ fortement différenciés, elle présente une localisation membranaire marquée. Nous avons également étudié l’effet d’une phosphorylation sur les propriétés de la HTT, et en particulier au niveau de la sérine en position 421 (S421-P-HTT). La phosphorylation de la S421 est connue pour moduler les fonctions de la HTT sauvage et la toxicité neuronale induite par la HTT mutante dans un contexte neuronal. La S421-P-HTT se localise spécifiquement au niveau apical des cellules épithéliales ; elle s’accumule aux jonctions intercellulaires au niveau des lumières dans les tissus tumoraux (Figure 1). L’expression de la S421-P-HTT est moindre dans les carcinomes alors que la protéine est phosphorylée dans quasiment l’intégralité des tissus sains. Cette diminution est d’autant plus importante dans les carcinomes infiltrants par comparaison avec des carcinomes in situ.
 | Figure 1.
La huntingtine et sa phosphorylation à la sérine 421 au cours de la progression tumorale. Représentation schématique de l’expression et de la localisation cellulaire de la HTT (en bleu) et de la S421-P-HTT (en rouge) au cours de la progression tumorale mammaire. HTT : huntingtine ; S421-P-HTT : huntingtine phosphorylée à la sérine 421. |
En bon accord avec ces profils d’expression, la diminution des niveaux de HTT ou la perte de la phosphorylation de la S421 accélère la progression tumorale dans des modèles murins de cancer du sein. |
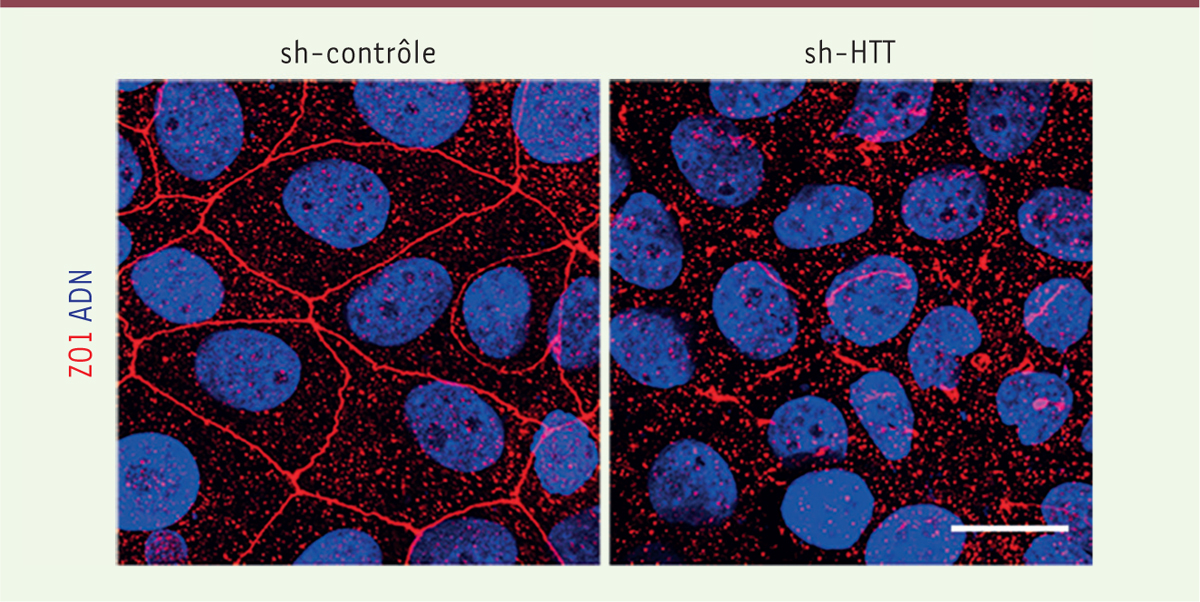
La HTT régule l’adhésion cellulaire Quels sont les mécanismes sous-jacents aux phénotypes associés à la perte de la HTT ou de sa phosphorylation ? La HTT agit sur l’expression et la localisation de la protéine ZO1 (zonula occludens 1), une composante des jonctions serrées qui sont nécessaires à la cohésion cellulaire (Figure 2). Dans des lignées mammaires et des biopsies de carcinomes murins et humains in situ, la forme phosphorylée de la HTT colocalise avec ZO1 au niveau des jonctions serrées. À l’instar de la S421-P-HTT, l’expression de ZO1 est diminuée dans les tissus tumoraux en comparaison des tissus mammaires sains [5, 9]. La perte d’expression de ZO1, comme celle de la HTT, est corrélée à une faible différenciation tumorale et est observée dans les tumeurs primaires métastatiques [5, 10, 11].
 | Figure 2.
La huntingtine régule la localisation de la protéine ZO1. Lorsque la huntingtine (HTT) est diminuée par des approches d’interférence ARN (sh-HTT), les jonctions cellulaires sont altérées dans des cellules cancéreuses mammaires en culture. Le noyau est marqué en bleu (ADN) et la protéine de jonction ZO1 (zonula occludens 1) en rouge. Barre d’échelle : 20 µM. sh-contrôle : situation contrôle. |
La HTT et ZO1 pourraient faire partie d’un même complexe moléculaire impliqué dans l’adhésion intercellulaire. Un faible taux de HTT, en diminuant non seulement l’expression de ZO1 mais aussi sa présence au niveau des jonctions, faciliterait la dispersion des cellules tumorales et leur migration métastatique. Dans un contexte neuronal, l’inactivation de la HTT dans des cellules souches embryonnaires et chez le poisson-zèbre entraîne une désorganisation de l’adhésion cellulaire médiée par la N-cadhérine, indispensable à la formation des complexes de jonction, accompagnée d’une distribution aberrante de ZO1 [12]. |
Ces études apportent un nouvel éclairage sur les mécanismes impliqués dans la progression tumorale et métastatique des cancers du sein. On retiendra notamment que, bien que d’incidence plus faible chez les patients atteints de la MH, certains cancers pourraient être plus sévères. D’autre part, une faible expression de HTT sauvage apparaît comme un marqueur de mauvais pronostic pour les cancers du sein. Étant donné que la HTT est exprimée dans de nombreux tissus, ceci pourrait potentiellement s’appliquer à d’autres cancers. Enfin, un rôle de la HTT dans l’adhésion cellulaire pourrait avoir des conséquences pour la mise en place et le maintien de différentes structures cérébrales. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a été cofinancé par l’Agence Nationale pour la Recherche – Maladies Rares (ANR-12-SVSE4, S.H.), la Fondation pour la Recherche Médicale (FRM DEQ20120323715, équipe labellisée, S.H.), le Cancéropôle Île-de-France (INCA-6517-2013, S.H.), le CNRS, l’INSERM, l’Institut Curie, une allocation doctorale du ministère responsable de la recherche (MENRT, M.S.T.) et une bourse de la Fondation ARC pour la Recherche sur le Cancer (M.S.T.). Ce travail est dédié aux patients ainsi qu’à leurs familles.
|
Footnotes |
1.
Marques Sousa C, Humbert S. Huntingtin: here, there, everywhere! J Huntingtons Dis. 2013; ; 2 : :395.–403. 2.
Elias S, McGuire JR, Yu H, et al. Huntingtin is required for epithelial polarity through RAB11A-mediated apical trafficking of PAR3-aPKC . PLoS Biol. 2015; ; 13 : :e1002142.. 3.
Elias S, Thion MS, Yu H, et al. Huntingtin regulates mammary stem cell division and differentiation . Stem Cell Rep. 2014; ; 2 : :491.–506. 4.
Moreira Sousa C, McGuire JR, Thion MS, et al. The Huntington disease protein accelerates breast tumour development and metastasis through ErbB2/HER2 signalling . EMBO Mol Med. 2013; ; 5 : :309.–325. 5.
Thion MS, McGuire JR, Sousa CM, et al. Unraveling the role of huntingtin in breast cancer metastasis . J Natl Cancer Inst. 2015; ; 107 : :djv208.. 6.
Sorensen SA, Fenger K, Olsen JH. Significantly lower incidence of cancer among patients with Huntington disease: An apoptotic effect of an expanded polyglutamine tract? Cancer. 1999; ; 86 : :1342.–1346. 7.
Ji J, Sundquist K, Sundquist J. Cancer incidence in patients with polyglutamine diseases: a population-based study in Sweden . Lancet Oncol. 2012; ; 13 : :642.–648. 8.
Charafe-Jauffret E, Chaffanet M, Bertucci F, et al. Les cancers du sein : vers un modèle cellulaire et moléculaire intégré . Med Sci (Paris). 2007; ; 23 : :626.–632. 9.
Tokes AM, Szasz AM, Juhasz E, et al. Expression of tight junction molecules in breast carcinomas analysed by array PCR and immunohistochemistry . Pathol Oncol Res. 2012; ; 18 : :593.–606. 10.
Hoover KB, Liao SY, Bryant PJ. Loss of the tight junction MAGUK ZO-1 in breast cancer: relationship to glandular differentiation and loss of heterozygosity . Am J Pathol. 1998; ; 153 : :1767.–1773. 11.
Martin TA, Watkins G, Mansel RE, et al. Loss of tight junction plaque molecules in breast cancer tissues is associated with a poor prognosis in patients with breast cancer . Eur J Cancer. 2004; ; 40 : :2717.–2725. 12.
Lo Sardo V, Zuccato C, Gaudenzi G, et al. An evolutionary recent neuroepithelial cell adhesion function of huntingtin implicates ADAM10-Ncadherin . Nat Neurosci. 2012; ; 15 : :713.–721. |