| |
| Med Sci (Paris). 32(8-9): 687–689. doi: 10.1051/medsci/20163208009.Modulation astrogliale de la stimulation cérébrale profonde dans la dépression Adeline Etiévant,1,2 Guillaume Lucas,3 and Nasser Haddjeri4* 1Neurosciences intégrative et clinique EA481, Université de Bourgogne Franche-Comté, 2, place du Maréchal Leclerc, F-25030, Besançon, France 2CHRU de Besançon, F-25000Besançon, France 3Neurocentre Magendie, Inserm U1215, Université de Bordeaux, 146, rue Léo Saignat, 33077Bordeaux, France 4Université de Lyon, Université Claude Bernard Lyon 1, Inserm, institut cellule souche et cerveau U1208, 18, avenue Doyen Lépine, 69500Bron, France MeSH keywords: Animaux, Astrocytes, Numération cellulaire, Stimulation cérébrale profonde, Trouble dépressif majeur, Modèles animaux de maladie humaine, Humains, Souris, anatomopathologie, physiologie, physiopathologie, psychologie, thérapie |
La dépression majeure (DM) est un des troubles neuropsychiatriques les plus fréquents. Bien que la physiopathologie de la DM soit loin d’être pleinement identifiée, comme l’atteste d’ailleurs le fait que les premiers antidépresseurs aient été découverts de manière fortuite, le développement de différentes classes d’antidépresseurs ciblant les systèmes monoaminergiques1 centraux a donné lieu à l’émergence de théories basées sur une déficience de ces systèmes. Cependant, malgré le grand nombre d’antidépresseurs disponibles, le traitement de la DM reste insatisfaisant, suggérant l’importance de considérer d’autres facteurs. Plusieurs données révèlent qu’un fonctionnement anormal des cellules gliales, particulièrement des astrocytes, peut contribuer à la physiopathologie de la DM [1]. En effet, des anormalités structurelles et fonctionnelles des cellules gliales ont été identifiées post-mortem dans le cerveau de patients déprimés et chez des modèles murins de la dépression. Il a également été montré qu’une perte d’astrocytes, après infusion locale d’une toxine spécifique dans le cortex préfrontal, est suffisante pour induire des comportements de type dépressif [2]. Étant donné les relations étroites entre astrocytes et neurones, une hypothèse suggérant que les effets des antidépresseurs peuvent être, au moins partiellement, sous-tendus par une modulation directe des réseaux neuronaux par les astrocytes éveille la curiosité des chercheurs. Tout d’abord, un nombre croissant de données expérimentales montre que les antidépresseurs induisent des changements fonctionnels au niveau des astrocytes [3]. Ensuite, il est désormais bien admis que le réseau astrocytaire est capable de réguler la signalisation neuronale et la transmission synaptique grâce à la libération de gliotransmetteurs au niveau de la synapse tripartite2 [4–6] (→).
(→) Voir les Nouvelles de A. Panatier et R. Robitaille, m/s n° 6-7, juin-juillet 2012, page 582, et de FW. Pfrieger et M. Reber, m/s n° 2, février 2013, page 142
Les astrocytes peuvent être directement modulés par les traitements antidépresseurs ou indirectement activés par l’augmentation de la concentration de neurotransmetteurs dans la fente synaptique induite par de tels traitements. Cela aboutit alors à l’activation des récepteurs exprimés à la surface de la membrane plasmique des astrocytes (tels que les récepteurs sérotoninergiques), provoquant ainsi une augmentation locale des concentrations intracellulaires de Ca2+ ainsi que de la transmission intra-gliale d’un signal d’activation sous forme de vagues calciques passant d’astrocyte en astrocyte. Une fois activés, les astrocytes influencent en retour l’excitabilité neuronale et la transmission synaptique en libérant des gliotransmetteurs. Le concept de gliotransmission correspond au processus par lequel les astrocytes libèrent des transmetteurs au cœur de la synapse afin de moduler l’activité des cellules avoisinantes [7]. Les astrocytes ont la capacité de libérer un grand nombre de molécules telles que des acides aminés inhibiteurs ou excitateurs, de l’ATP, des neurotrophines et des facteurs de croissances. Ici, nous nous focaliserons sur l’adénosine puisque ce nucléoside agit directement sur la communication neuronale et a été impliqué dans l’expression de comportements de type pro- et antidépresseurs. L’ATP, considérée comme un transmetteur excitateur, est rapidement hydrolysée (après environ 200 ms) en adénosine grâce aux ectonucléotidases3, présentes dans la fente synaptique. L’adénosine agit principalement comme un puissant inhibiteur de la transmission synaptique en activant les récepteurs adénosine4 A1 et A2A. De manière intéressante, il a été montré que l’administration d’adénosine et d’agonistes A1 induit des comportements de type dépressifs alors que les antagonistes A1 et A2A présentent des propriétés antidépressives. |
Les astrocytes sont impliqués dans l’action antidépressive de la stimulation cérébrale profonde Des données récentes montrent que les astrocytes peuvent être activés par la stimulation cérébrale profonde (DBS, deep brain stimulation) et qu’ils peuvent ainsi moduler les effets neurobiologiques de cette stimulation. La DBS est une technique de stimulation cérébrale invasive qui montre des résultats très prometteurs dans la prise en charge des patients souffrant de différents troubles psychiatriques résistants aux traitements. Malgré des effets cliniques remarquables, les mécanismes d’action de la DBS sont encore mal compris. Si les recherches se focalisent principalement sur les effets de la DBS sur les neurones (cherchant à déterminer comment les axones myélinisés, non-myélinisés, les dendrites et les corps cellulaires répondent à la DBS), le rôle des astrocytes est, à ce jour, très peu étudié. Plusieurs arguments sont toutefois en faveur de leur implication dans les effets cliniques de la DBS, par l’intermédiaire d’une puissante modulation de l’activité du réseau neuronal impliqué dans la réponse à la stimulation [8]. Les récentes recherches précliniques de notre équipe ont, pour la première fois, permis de confirmer cette hypothèse. La réponse de type antidépressive induite par la DBS chez l’homme peut ainsi être modélisée par la stimulation, chez le rat, de la partie infralimbique du cortex préfrontal (CPF-IL). Utilisée de façon aiguë, une stimulation de courte durée dans le CPF-IL produit un effet antidépresseur dans le test de nage forcée5 [9]. Utilisée de façon chronique, la DBS est capable de renverser l’état d’anhédonie6 induit par des stress chroniques, un modèle de dépression bien validé [10]. Nous avons mis en évidence que les effets comportementaux de la DBS sont associés à l’apparition d’autres marqueurs précliniques de la réponse antidépressive : la DBS dans le CPF-IL induit une rapide augmentation de la neurogenèse hippocampique7,, renverse les effets du stress sur la métaplasticité synaptique8, de l’hippocampe, augmente les oscillations basses fréquences spontanées dans le CPF-IL ainsi que la fréquence de décharge des neurones sérotoninergiques et la synaptogénèse dans le raphé dorsal9,. Or, nous avons également démontré que toutes ces modifications neuronales induites par la DBS dépendent de l’intégrité du système astrocytaire à l’endroit de la stimulation. En effet, une lésion gliale, réalisée à l’aide d’acide L-alpha amino-adipique, capable d’induire une perte totale des astrocytes dans le CPF-IL, contrecarre tous les effets neurobiologiques et comportementaux de la DBS précédemment cités [9]. Sur le plan mécanistique, nos résultats électrophysiologiques révèlent que la modulation de la DBS par les astrocytes implique des changements fonctionnels des récepteurs A1 de l’adénosine, ainsi que l’élévation des concentrations extracellulaires de potassium [9]. Nos données montrent tout d’abord que l’augmentation de l’activité neuronale sérotoninergique induite par la DBS est potentialisée par un agoniste sélectif des récepteurs A1 infusé au sein du cortex préfrontal pendant la stimulation. De plus, le blocage des récepteurs A1 consécutif à l’administration d’un antagoniste prévient, par lui-même, l’effet antidépresseur de la DBS dans le test de nage forcée, indiquant que l’efficacité de la DBS est également dépendante de l’activation tonique de ces récepteurs. Une étude remarquable suggère que les astrocytes, via la libération d’adénosine et l’activation des récepteurs A1 qui en résulte, sont capables de moduler la durée totale des potentiels d’action (PA) [11]. Cet effet est dû à une modulation des canaux K+ voltage-dépendants responsables de l’hyperpolarisation neuronale. Un tel « raccourcissement temporel » des PA serait nécessaire lorsque le neurone est sollicité par des stimulations à haute fréquence, afin de soutenir/maintenir l’activité tonique du neurone (en bouffées, en anglais bursting) et requérant des intervalles entre les PA très courts. Nous avons proposé que la perte d’astrocytes au sein du site de stimulation induit une chute des concentrations extracellulaires d’adénosine et, par conséquent, une altération du raccourcissement temporel des PA, ce qui bloquerait les effets neurobiologiques de la DBS (Figure 1).
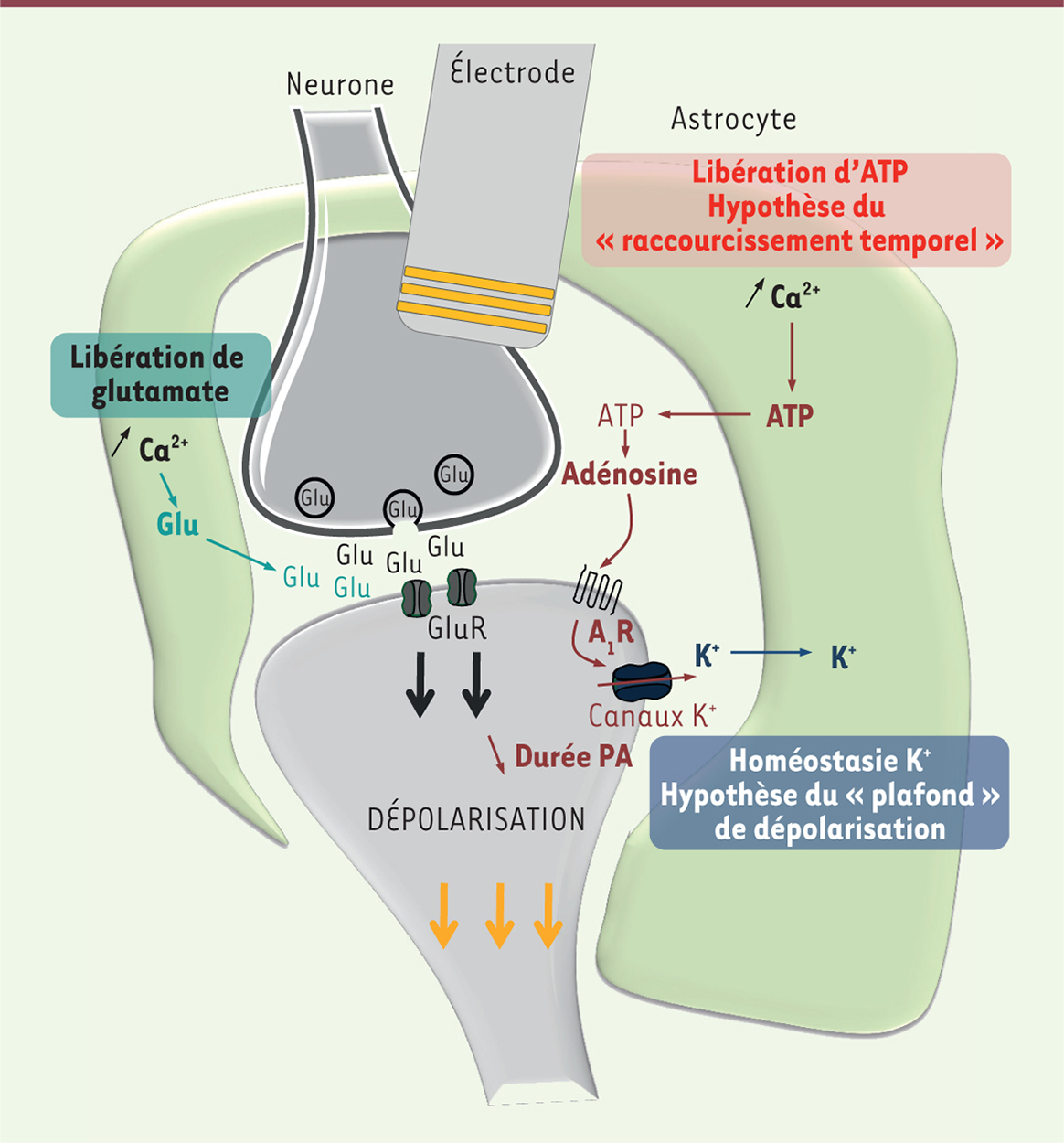
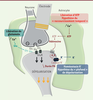 | Figure 1.
Hypothèses concernant l’implication des astrocytes dans les effets de la DBS. Une fois activés, les astrocytes communiquent avec les neurones au niveau de la synapse et peuvent réguler les effets de la DBS. Les astrocytes, en libérant du glutamate (Glu), stimulent la libération de neurotransmetteurs par le neurone et contribuent à l’activation des récepteurs post-synaptiques (GluR) (voie en vert). L’ATP également libérée par les astrocytes est rapidement hydrolysée en adénosine qui active les récepteurs A1 de l’adénosine (A1R) qui, en retour, induisent la diminution de la phase d’hyperpolarisation tardive des potentiels d’action (PA) en jouant sur les canaux K+ (voie en rouge). Le raccourcissement temporel des PA qui en résulte semble aider le neurone à soutenir le rythme de décharge à haute fréquence induit par la DBS. Les astrocytes maintiennent également l’homéostasie K+ en pompant activement les ions K+ présents au niveau extracellulaire prévenant ainsi l’accumulation due à l’activité neuronale (voie en bleu). DBS : deep brain stimulation. |
Par ailleurs, une des plus importantes fonctions des astrocytes reste leur habilité à maintenir l’homéostasie potassique en pompant activement les ions K+ présents dans la fente synaptique. Nous avons mis en évidence, en perfusant du liquide cérébro-spinal enrichi en K+ au niveau du site de stimulation, que l’action dépolarisante d’une forte concentration extracellulaire en K+ semble altérer la capacité des cellules pyramidales10, à répondre à une sollicitation à haute fréquence provoquée par une stimulation électrique à 130 Hz [9]. Ainsi, une altération de la fonction astrocytaire au niveau du site de lésion favorise l’accumulation du K+ extracellulaire qui, en retour, induirait la dépolarisation de la membrane du neurone et le blocage des effets de la DBS (Figure 1). Cet effet est fréquence-dépendant puisque l’efficacité antidépressive de la DBS à 30 Hz, dans le test de nage forcée, reste intacte dans ces conditions de lésion astrocytaire. Ce résultat suggère qu’en absence d’astrocytes, la dépolarisation membranaire des neurones associée à l’accumulation de K+ n’atteint pas le seuil de « depol-block
11 » et que les neurones pyramidaux sont toujours capables de suivre une fréquence modérée de 30 Hz. |
Nous proposons deux hypothèses concernant le rôle des astrocytes dans la réponse de type antidépressive induite par la DBS (the shrinking and ceiling hypotheses). Tout d’abord, l’hypothèse du « raccourcissement temporel » (shrinking) suggère que les astrocytes, en libérant de l’adénosine suite à la stimulation par DBS, activent les récepteurs neuronaux A1 qui raccourcissent la durée des potentiels d’action. Ensuite, les astrocytes, en pompant activement les ions K+ du milieu extracellulaire, semblent prévenir l’atteinte du seuil de « depol-block » (ceiling) de la membrane neuronale (Figure 1). Ces deux actions semblent indispensables pour le fonctionnement optimal des neurones pyramidaux qui seront ainsi capables de suivre la stimulation haute fréquence induite par la DBS. D’un point de vue translationnel, notre étude propose que : (1) un système neurone-glie intact est un pré-requis majeur pour optimiser l’efficacité antidépressive de la DBS ; (2) la caféine, un puissant antagoniste des récepteurs A1, devrait être contre-indiquée lors du traitement de la dépression majeure avec la DBS ; et (3) la diminution de la fréquence de stimulation pourrait améliorer la réponse antidépressive chez des patients ayant une rémission partielle. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Rajkowska G, Miguel-Hidalgo JJ. Gliogenesis and glial pathology in depression . CNS Neurol Disord Drug Targets. 2007; ; 6 : :219.–233. 2.
Banasr M, Duman RS. Glial loss in the prefrontal cortex is sufficient to induce depressive-like behaviors . Biol Psychiatry. 2008; ; 64 : :863.–870. 3.
Czeh B, Di Benedetto B. Antidepressants act directly on astrocytes: evidences and functional consequences . Eur Neuropsychopharmacol. 2012; ; 23 : :171.–185. 4.
Panatier A, Valee J, Haber M, et al. Astrocytes are endogenous regulators of basal transmission at central synapses . Cell. 2011; ; 146 : :785.–798. 5.
Panatier A, Robitaille R. L’astrocyte, un partenaire clé des neurones au cours de la transmission synaptique de base . Med Sci (Paris). 2012; ; 28 : :582.–584. 6.
Pfrieger FW, Reber M. Un nouvel aperçu des mécanismes de la communication neurone-glie . Med Sci (Paris). 2013; ; 29 : :142.–144. 7.
Volterra A, Meldolesi J. Astrocytes, from brain glue to communication elements: the revolution continues . Nat Rev Neurosci. 2005; ; 6 : :626.–640. 8.
Vedam-Mai V, Van Battum EY, Kamphuis W, et al. Deep brain stimulation and the role of astrocytes . Mol Psychiatry. 2012; ; 17 : :124.–131. 9.
Etiévant A, Ooosterhof C, Bétry C, et al. Astroglial control of the antidepressant-like effects of prefrontal cortex deep brain stimulation . EBiomedicine. 2015; ; 2 : :896.–906. 10.
Hamani C, Machado DC, Hipolide DC, et al. Deep brain stimulation reverses anhedonic-like behavior in a chronic model of depression: Role of serotonin and brain derived neurotrophic factor . Biol Psychiatry. 2011; ; 71 : :30.–35. 11.
Sasaki T, Matsuki N, Ikegaya Y. Action-potential modulation during axonal conduction . Science. 2011; ; 331 : :599.–601. |