| |
| Med Sci (Paris). 32(8-9): 692–696. doi: 10.1051/medsci/20163208011.Addiction par stimulation des neurones dopaminergiques mésolimbiques Vincent Pascoli,1* Jean Terrier,2 and Christian Lüscher1,2 1Department of basic neurosciences, medical faculty, university of Geneva, CMU, 1 rue Michel Servet, CH-1211Geneva, Suisse 2Clinic of neurology, department of clinical neurosciences, Geneva university hospital, CH-1211Geneva, Suisse MeSH keywords: Animaux, Addiction, Évolution de la maladie, Neurones dopaminergiques, Humains, Système limbique, Souris, Souris transgéniques, Plasticité neuronale, Transmission synaptique, étiologie, physiopathologie, psychologie, physiologie, cytologie |
Dopamine : nécessaire ou suffisante pour induire l’addiction ? Les substances addictives ont en commun la propriété d’augmenter la concentration extracellulaire en dopamine (DA) dans le noyau accumbens (NAc), une structure cérébrale faisant partie du système de la récompense et jouant un rôle important pour la motivation et le renforcement de comportements bénéfiques à la survie. Les cibles moléculaires des substances addictives sont diverses : transporteurs des monoamines1,, récepteurs aux opiacés ou aux cannabinoïdes, canaux nicotiniques2 [15] (→).
(→) Voir la Synthèse de J. Kaufling et al., m/s n° 6-7, juin-juillet 2016, page 619
Ces substances ont donc des modes d’action différents permettant d’augmenter la concentration en dopamine : soit par inhibition de sa recapture, soit par activation directe des neurones dopaminergiques, soit par inhibition d’interneurones inhibiteurs des neurones à DA. L’augmentation de DA est-elle suffisante pour induire les effets moléculaires, cellulaires et comportementaux caractérisant l’addiction ? Cette question a fait l’objet d’intenses débats depuis plusieurs décennies. L’utilisation de souris transgéniques dépourvues du transporteur soit de la dopamine, soit de la sérotonine, soit de la noradrénaline, n’a que partiellement permis de répondre à cette question en raison de phénomènes complexes de compensation. De façon remarquable, l’auto-administration3 de cocaïne par la souris est bloquée par la mutation du site de liaison de la drogue sur le transporteur de la DA (DAT) [1]. Néanmoins, la question de la suffisance de la dopamine pour induire l’addiction, notamment pour toutes les autres drogues ne se liant pas au transporteur DAT, reste d’actualité. En agissant spécifiquement sur l’activité des neurones dopaminergiques de l’aire tegmentale ventrale (ATV) grâce à l’utilisation combinée de vecteurs viraux, de souris transgéniques et d’outils optogénétiques, il semble enfin possible de réévaluer cette question de façon contrôlée. Pour contrôler l’activité des neurones dopaminergiques, un virus codant une opsine (channelrhodopsin
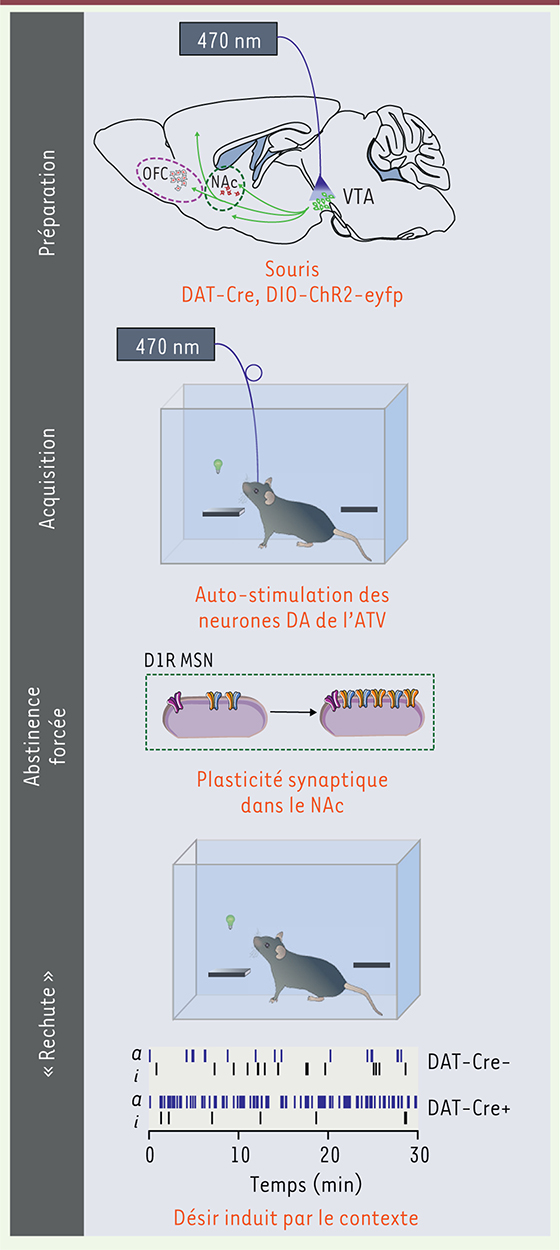
4,, ChR2) de façon Cre5, dépendante est injecté dans l’ATV de souris exprimant la Cre recombinase uniquement dans les neurones dopaminergiques (souris DAT-Cre). Ce système assure l’expression spécifique de la ChR2 dans les neurones dopaminergiques. Une fibre optique dirigée vers l’ATV permet de stimuler l’opsine et ainsi de contrôler l’activité des neurones de l’ATV avec une forte résolution temporelle. Ces souris sont ensuite placées dans une enceinte de conditionnement opérant6 et appuient sur un levier pour déclencher la stimulation optogénétique au niveau de leurs neurones dopaminergiques de la même façon qu’elles le feraient pour recevoir une injection intraveineuse de cocaïne (Figure 1). Chaque stimulation consiste en une série d’impulsions à 20 Hz pendant 15 secondes, mimant l’activité phasique des neurones dopaminergiques. Après quelques sessions journalières, les souris se stimulent de façon régulière, presque deux fois par minute, discriminent parfaitement un levier actif d’un levier inactif et s’accommodent facilement d’une augmentation (jusqu’à 250) du nombre d’appuis nécessaires pour déclencher la stimulation optogénétique. Ce comportement d’auto-stimulation est atténué de façon dose-dépendante par une administration systémique de cocaïne, suggérant que les mêmes circuits sont impliqués. Il apparaît ainsi clairement que la stimulation des neurones à DA permet un renforcement comportemental. Mais est-ce suffisant pour induire l’addiction ?
 | Figure 1.
Auto-stimulation des neurones dopaminergiques, plasticité synaptique et rechute. Les neurones dopaminergiques de l’aire tegmentale ventrale (ATV) sont infectés spécifiquement (virus adéno-associé [AAV] possédant un cadre de lecture ouvert inversé doublement floxé, flanqué de sites loxP5, [DIO] contenant la ChR2 [channelrhodopsin] fusionnée avec la protéine fluorescente [eyfp, enhanced yellow fluorescent protein] est injecté dans des souris DAT-Cre) et expriment l’effecteur optogénétique permettant leur activation via une fibre optique. Après une phase d’acquisition (une session quotidienne pendant 12 jours), les souris sont maintenues en abstinence pendant 1 mois. Après cette période, une potentialisation des synapses excitatrices au niveau des neurones du noyau accumbens (NAc) associée à un comportement de recherche intense de la stimulation dopaminergique est observée. Le comportement se manifeste par un nombre d’appuis sur le levier actif (ampoule verte) important chez les souris DAT-Cre+. D1-MSN : neurone épineux de taille moyenne exprimant de récepteur D1 de la dopamine ; OFC : cortex orbitofrontal. |
|
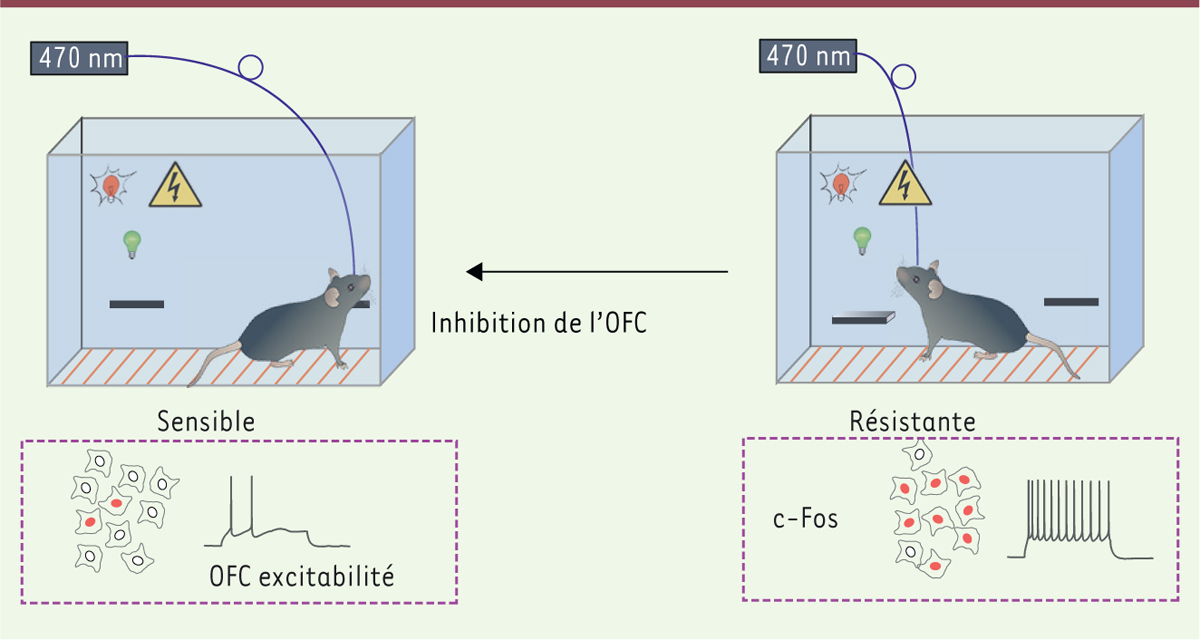
Modèle comportemental de transition vers l’addiction L’addiction est une maladie qui évolue en suivant plusieurs étapes. Le diagnostic d’addiction est posé chez un patient lorsque sa consommation récréative devient compulsive et persiste en dépit de conséquences négatives. Ces stades avancés de la maladie ne sont observés que chez une fraction des consommateurs de drogues, y compris pour les drogues les plus addictives. Chez les patients « addicts », la consommation, malgré des conséquences négatives, réfère typiquement à des échecs psychologiques ou sociaux, différés par rapport à la prise de drogue en elle-même. Cette prise de drogue associée à des conséquences négatives peut être modélisée chez la souris par un test de persévération de l’auto-administration de cocaïne malgré un stimulus aversif, généralement un choc électrique (Figure 2). Comme chez l’humain, ce comportement de persévération n’est observé que chez un rongeur sur cinq [2], démontrant la pertinence de ce modèle pour l’étude de la transition vers l’addiction. De façon similaire à ce qui est observé avec la cocaïne, seule une fraction des souris résistent au choc électrique et continuent l’auto-stimulation des neurones à DA. Ceci constitue une preuve expérimentale qu’une manipulation spécifique visant à augmenter la concentration extracellulaire de DA est suffisante pour induire un comportement compulsif caractéristique des stades avancés de l’addiction. Ce modèle peut être désormais utilisé pour étudier les raisons pour lesquelles seuls certains individus parmi une population de consommateurs abusifs de drogues deviennent réellement addicts.
 | Figure 2.
Auto-stimulation en dépit des conséquences négatives. Après 15 sessions quotidiennes d’auto-stimulation, un choc électrique de faible intensité, annoncé par un signal lumineux, est délivré immédiatement après le second appui sur le levier actif (ampoule verte). Le troisième appui déclenche la stimulation optogénétique des neurones à DA. Environ 70 % des souris choisissent de poursuivre le comportement d’auto-stimulation malgré le désagrément. Dans le cortex orbitofrontal (OFC) de ces souris «résistantes », le marqueur d’activité neuronale (c-Fos) est détecté dans un plus grand nombre de neurones et le nombre de potentiels d’action évoqués par une faible dépolarisation est supérieur. L’inhibition pharmacogénétique de l’OFC favorise la résignation lorsque l’auto-stimulation requiert d’endurer un choc électrique. |
|
Vulnérabilité individuelle à l’addiction Les facteurs génétiques de vulnérabilité à l’addiction ont été étudiés mais le gène de l’addiction n’existe pas. Des polymorphismes des gènes codant NF-κB (nuclear factor-kappa B) ou du gène codant le récepteur de la neurotensine7 ont été détectés chez des patients addicts et représentent des facteurs de risque [3, 4] (→).
(→) Voir la Synthèse de N. Ramoz et P. Gorwood, m/s n° 4 avril 2015, page 432
Une diminution de l’expression du récepteur de la dopamine de type D2/38 dans le striatum est aussi observée chez les consommateurs de drogue [5]. Ceci pourrait expliquer des traits de caractère tels que l’impulsivité ou la susceptibilité au stress qui sont également associés à une augmentation de vulnérabilité à l’addiction [6, 7]. Les rongeurs utilisés en laboratoire ont une faible variabilité génétique mais ils ne présentent cependant pas la même vulnérabilité à l’addiction, suggérant l’influence de paramètres autres que génétiques dans cette vulnérabilité. Chez l’homme, de nombreux facteurs environnementaux liés aux conditions socio-économiques, aux conditions psychologiques/psychiatriques ou aux facteurs de stress influencent l’initiation et la transition vers des stades avancés de consommation de drogues [8] (→).
(2192) Voir la série Addictions, m/s n° 4, avril 2015 à m/s n° 10, octobre 2015
La fréquence de consommation pourrait également jouer un rôle déclencheur dans cette transition. Dans notre étude, les souris résistantes à la punition pour obtenir la stimulation dopaminergique avaient développé, au cours de leur exposition initiale, une façon de se stimuler légèrement plus rapide et plus impulsive. Ces observations suggèrent que la transition vers l’addiction pourrait être influencée directement par le développement d’habitudes de consommation. |
Plasticité neuronale associée à l’addiction Il a été démontré que la plasticité des synapses induite par la cocaïne, en particulier au niveau du noyau accumbens (NAc), participait à l’expression d’altérations comportementales chez la souris telles que la sensibilisation locomotrice9, les phénomènes de désirs irrépressibles de consommer ou encore de rechute associée au contexte après une période d’abstinence forcée [9, 10]. Comme pour la cocaïne, l’auto-stimulation des neurones à DA provoque une potentialisation des synapses excitatrices des neurones épineux du NAc, exprimant le récepteur de la dopamine de type D1. Ceci constitue une preuve cellulaire que l’excès de dopamine est suffisant pour induire la plasticité synaptique associée à la recherche compulsive de drogue. Il a ainsi été proposé que la plasticité synaptique observée dans le NAc, induite par les drogues ou par la stimulation optogénétique des neurones à DA, participe au détournement du fonctionnement physiologique du système de récompense pour conduire à l’addiction. Certaines formes de plasticité synaptique, comme une altération de la capacité d’induction de dépression synaptique10, ont été observées dans le NAc de souris classifiées comme addict [11]. Cependant, dans une vaste majorité des études, des altérations synaptiques dans le NAc sont enregistrées dans toutes les souris exposées à la cocaïne, y compris lors d’administrations aiguës faites par l’expérimentateur [12]. Il n’est pas clairement établi que le substrat cellulaire de la transition vers les stades avancés de l’addiction réside dans le NAc. |
Consommation compulsive : rôle du cortex orbitofrontal De nouvelles pistes pour identifier le substrat cellulaire et les circuits impliqués dans la transition vers l’addiction ont été dévoilées en utilisant le modèle murin précédemment décrit (c’est-à-dire le modèle d’auto-stimulation optogénétique des neurones à DA jusqu’à l’observation de la persévération ou de la renonciation à s’auto-stimuler en présence d’un stimulus aversif). En effet, des différences d’activité neuronale ont été détectées entre les souris résistantes et les souris sensibles à la punition. Des mesures électrophysiologiques et des marquages immunohistochimiques réalisés dans une quinzaine de structures cérébrales d’intérêt, ont indiqué une corrélation entre l’activité neuronale du cortex orbitofrontal (OFC) et le comportement compulsif. Des contrôles appropriés ont prouvé que ces changements n’étaient pas directement liés à la punition mais plutôt au choix réalisé par l’individu. Confirmant ces observations, l’inhibition optogénétique de l’OFC lors des sessions d’auto-stimulation avec punition réduit significativement la proportion d’individus compulsifs par rapport à des sessions sans inhibition de l’OFC11
(Figure 2). Ces résultats confirment que l’activité neuronale dans l’OFC contribue à la transition vers une consommation compulsive en dépit des conséquences négatives, donc dans le développement de l’addiction [13, 14]. Toutefois, de futures recherches devront déterminer si ces différences individuelles d’activité neuronale corticale sont innées ou acquises, et le cas échéant, comment les drogues induisent cette forme de plasticité uniquement chez certains consommateurs. |
Conclusions et perspectives En démontrant que la dopamine est suffisante pour induire les effets cellulaires et comportementaux caractéristiques de l’addiction chez la souris, un modèle d’étude simplifié a été proposé. Il a permis d’identifier le rôle de l’OFC dans la transition vers l’addiction. Cependant les mécanismes moléculaires et cellulaires d’induction et d’expression du changement d’activité neuronale dans l’OFC restent à découvrir. Cette ligne de recherche est cruciale dans l’optique de proposer des cibles thérapeutiques de façon rationnelle. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Thomsen M, Han DD, Gu HH, Caine SB. Lack of cocaine self-administration in mice expressing a cocaine-insensitive dopamine transporter . J Pharmacol Exp Ther. 2009; ; 331 : :204.–211. 2.
Deroche-Gamonet V. Evidence for addiction-like behavior in the rat . Science. 2004; ; 305 : :1014.–1017. 3.
Levran O, Peles E, Randesi M, et al. Synaptic plasticity and signal transduction gene polymorphisms and vulnerability to drug addictions in populations of European or African ancestry . CNS Neurosci Ther. 2015; ; 21 : :898.–904. 4.
Ramoz N, Gorwood P. Les addictions sous l’angle de la génétique . Med Sci (Paris). 2015; ; 31 : :432.–438. 5.
Volkow ND, Wang GJ, Telang F, et al. Low dopamine striatal D2 receptors are associated with prefrontal metabolism in obese subjects: possible contributing factors . Neuroimage. 2008; ; 42 : :1537.–1543. 6.
Economidou D, Pelloux Y, Robbins TW, et al. High impulsivity predicts relapse to cocaine-seeking after punishment-induced abstinence . BPS. 2009; ; 65 : :851.–856. 7.
Belin D, Belin-Rauscent A, Everitt BJ, Dalley JW. In search of predictive endophenotypes in addiction: insights from preclinical research . Genes Brain Behav. 2016; ; 15 : :74.–88. 8.
Swendsen J, Le Moal M. Individual vulnerability to addiction . Ann NY Acad Sci. 2011; ; 1216 : :73.–85. 9.
Pascoli V, Turiault M, Lüscher C. Reversal of cocaine-evoked synaptic potentiation resets drug-induced adaptive behaviour . Nature. 2011; ; 481 : :71.–75. 10.
Pascoli V, Terrier J, Espallergues J, et al. Contrasting forms of cocaine-evokedplasticity control components of relapse . Nature. 2014; ; 509 : :459.–464. 11.
Kasanetz F, Deroche-Gamonet V, Berson N, et al. Transition to addiction is associated with a persistent impairment in synaptic plasticity . Science. 2010; ; 328 : :1709.–1712. 12.
Terrier J, Lüscher C, Pascoli V. Cell-type specific insertion of GluA2-lacking AMPARs with cocaine exposure leading to sensitization, cue-induced seeking, and incubation of craving . Neuropsychopharmacology. 2016; ; 41 : :1779.–1789. 13.
Pascoli V, Terrier J, Hiver A, Lüscher C. Sufficiency of mesolimbic dopamine neuron stimulation for the progression to addiction . Neuron. 2015; ; 88 : :1054.–1066. 14.
Lucantonio F, Stalnaker TA, Shaham Y, et al. The impact of orbitofrontal dysfunction on cocaine addiction . Nat Neurosci. 2012; ; 15 : :358.–366. 15.
Kaufling J, Freund-Mercier MJ, Barrot M. Impact des opiacés sur les neurones dopaminergiques . Med Sci (Paris). 2016; ; 32 : :619.–624. |