| |
| Med Sci (Paris). 32(8-9): 739–745. doi: 10.1051/medsci/20163208022.Vaccination contre l’hépatite B
Succès et perspectives Marie-Louise Michel1* 1Laboratoire PVHB, Bâtiment Lwoff, Inserm U994, Institut Pasteur, 28, rue du Docteur Roux, 75015Paris, France |
Le virus de l’hépatite B (VHB) est un pathogène particulièrement efficace puisque plus de deux milliards d’individus dans le monde présentent des marqueurs sérologiques témoignant d’une infection passée ou présente. L’infection par le VHB peut être complètement asymptomatique mais le virus est également responsable d’hépatites aiguës, fulminantes ou chroniques (Figure 1). On compte environ 200 à 300 millions de porteurs chroniques (PC) de ce virus avec une maladie du foie plus ou moins grave [1, 2]. Environ un tiers de ces patients risque de développer une cirrhose hépatique ou un carcinome hépatocellulaire (CHC). Le VHB est responsable d’environ 780 000 décès et de 4,5 millions de nouvelles infections par an dans le monde1. Les stratégies pour lutter contre ce virus incluent le traitement des patients infectés de manière chronique, l’interruption de la transmission et l’immunisation des individus susceptibles. La vaccination est certainement la mesure la plus efficace pour prévenir les maladies dues au VHB [44] (→).
(→) Voir le Forum de O. Launay et D. Floret, m/s n° 5, mai 2015, page 551
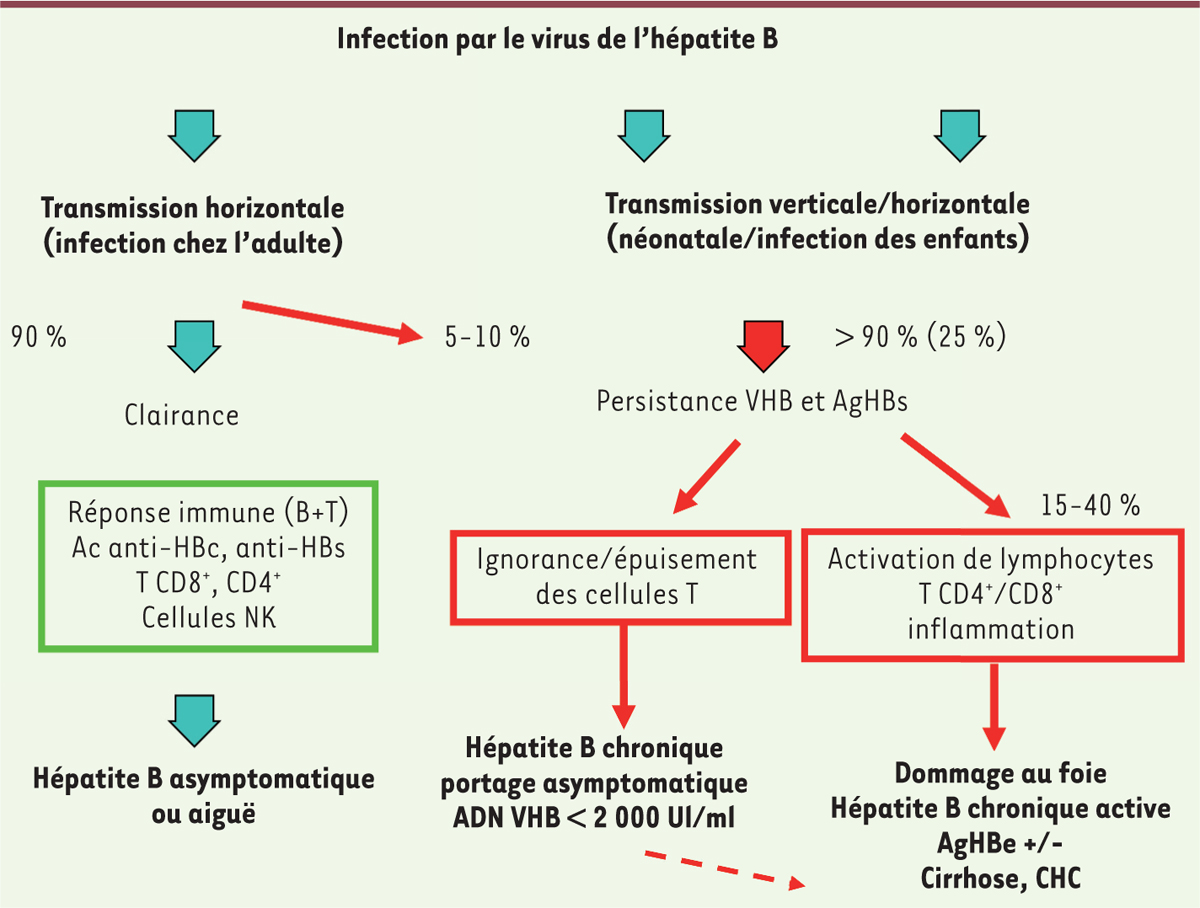
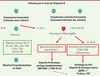 | Figure 1.
Infection par le VHB et réponse immunitaire. L’infection à l’âge adulte se résout spontanément dans 90 % des cas grâce à la mise en place d’une réponse immunitaire efficace caractérisée par l’activation des lymphocytes natural killer (NK), puis par l’activation des lymphocytes T et B, la production de cytokines antivirales et d’anticorps (Ac anti-HBc, anti-HBs). Chez l’adulte, l’infection est le plus souvent asymptomatique mais peut être aiguë avec élévation des transaminases sériques. L’infection devient chronique chez plus de 90 % des nouveau-nés lorsque la mère est porteur chronique du virus et dans plus de 25 % des cas lorsque l’enfant est infecté dans la petite enfance. Le portage chronique du virus est défini par la présence de l’AgHBs dans le sérum pendant plus de 6 mois. L’hépatite chronique est dite asymptomatique lorsque l’on n’observe pas de dommages au foie et que la charge virale est contrôlée (ADN viral inférieur à 2 000 UI [unités internationales]/ml). La réponse immune est associée à des cellules de phénotype dit « épuisé », incapables d’exercer leurs fonctions et de contrôler l’infection. L’hépatite peut évoluer vers une hépatite chronique active avec une forte attaque du foie, des charges virales élevées et la présence de l’AgHBe ou de formes mutantes de cet antigène (AgHBe-). Le foie présente des infiltrats lymphocytaires de type inflammatoire qui ne sont généralement pas spécifiques du VHB. Une évolution vers la cirrhose ou le carcinome hépatocellulaire (CHC) est possible en l’absence de traitement. |
En effet, en dépit des énormes progrès de la thérapie antivirale depuis ses débuts en 1998, la suppression de la réplication virale ne conduit pas à l’éradication du virus et la guérison complète est très rarement observée [2]. Le développement de vaccins anti-hépatite B basés sur l’utilisation de l’antigène de surface du virus (AgHBs) représente un succès dans l’histoire des vaccins. Avec plus de 30 ans de recul, ce vaccin a prouvé son aptitude non seulement à protéger de l’infection par le VHB mais aussi des maladies qui lui sont associées. Plus récemment, on a tenté d’utiliser ce vaccin à des fins thérapeutiques mais avec un succès limité et des approches complémentaires en cours d’étude sont indispensables pour qu’il puisse faire un jour partie de l’arsenal thérapeutique anti-hépatite B. |
Le virus et ses modes de transmission Le VHB est un virus enveloppé à ADN (Figure 2) transmis de manière horizontale chez l’adulte, principalement par le sang contaminé, selon divers modes d’exposition (soins et actes invasifs) et par les rapports sexuels. Cependant, le mode d’infection reste inconnu dans 30 % des cas. Il est également transmis de manière verticale de la mère à l’enfant [2]. L’infection à l’âge adulte est en général spontanément résolutive grâce à la mise en place d’une réponse immunitaire complète. Ce n’est que dans 5 à 10 % des cas qu’une infection chronique est observée (Figure 1). Celle-ci se caractérise par la persistance de l’antigène viral AgHBs dans le sang pendant plus de 6 mois. Dans les régions de forte endémie comme en Asie, c’est la transmission périnatale qui prévaut alors qu’en Afrique sub-saharienne, la transmission est plutôt horizontale, dans la petite enfance [3]. Les enfants nés de mères porteuses du VHB ont un risque élevé d’acquisition d’une infection chronique. Il est important de noter que l’âge auquel survient l’infection conditionne l’issue de celle-ci, vers la guérison ou vers l’infection chronique. En l’absence d’immunoprophylaxie du nouveau-né, lorsque la mère présente une infection chronique avec une forte charge virale (mise en évidence par la présence d’antigène HBe, AgHBe+), la transmission du virus conduit à une infection chronique de l’enfant dans 95 % des cas. Pour les mères dont la réplication virale est partiellement contrôlée (AgHBe négatif ; présence d’anticorps [Ac] spécifiques : Ac anti-HBe+), le risque tombe à 5 %. Chez l’enfant, le risque de devenir PC (porteur chronique) décroît avec l’âge auquel celui-ci contracte l’infection [4, 5]. Ce sont ces observations qui ont conduit à utiliser la vaccination anti-hépatite B chez les nouveau-nés conjointement à l’utilisation des immunoglobulines anti-VHB comme outil de prévention de la transmission périnatale. Cette approche est efficace. Elle protège plus de 90 % des enfants. Plus récemment, le traitement des mères avec fortes charges virales, pendant le 3e trimestre de la grossesse, a montré son efficacité en réduisant encore les échecs de vaccination [6].
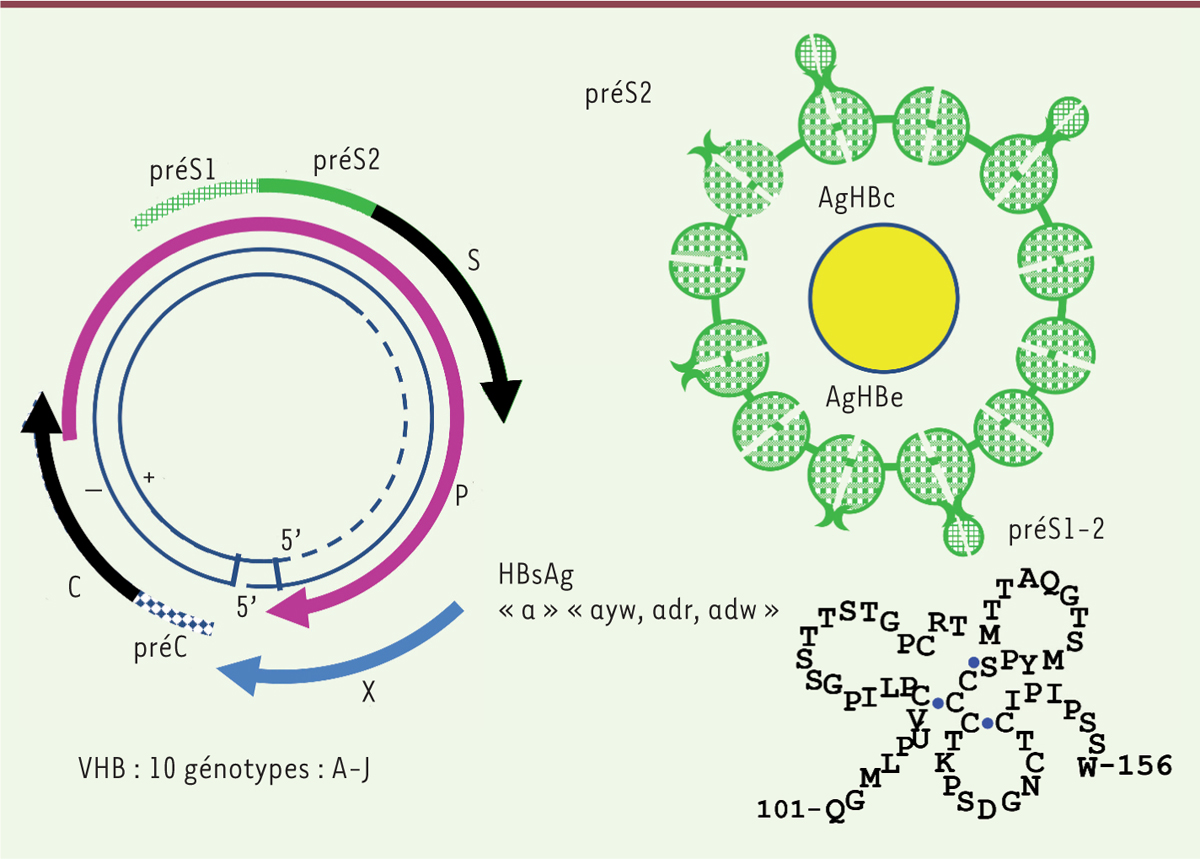
 | Figure 2.
Structure du VHB, antigènes viraux et boucle antigénique. Le virus de l’hépatite B (VHB) est un virus dont le génome est un ADN partiellement double brin de 3,2 kb. Le brin (-) est complet tandis que le brin (+) présente une longueur variable couvrant 50 à 90 % de la longueur. La configuration circulaire du génome est maintenue par appariement des extrémités 5’ des deux brins. Le génome du VHB est extrêmement compact et la synthèse des protéines virales est permise grâce à l’existence de quatre phases ouvertes de lecture (ou ORF) chevauchantes. Le virus est classé en 10 génotypes (de A à J). On distingue quatre régions génomiques (C, P, S et X) codant respectivement les protéines de la capside (AgHBc) et l’AgHBe, la polymérase virale, les protéines de l’enveloppe et la protéine régulatrice HBx. Une seule ORF code les protéines d’enveloppe. Elle contient 3 codons d’initiation en phase qui divisent cette séquence codante en 3 régions : préS1, préS2 et S. Les 3 protéines portent l’AgHBs défini par un déterminant de groupe « a » et 3 déterminants de sous-types principaux « ayw, adr, adw ». L’antigénicité est portée par la boucle antigénique structurée par des ponts disulfures entre les acides aminés en position 101 à 156. Les vaccins actuels sont majoritairement constitués de la petite protéine (S). Certains vaccins contiennent en plus les protéines moyenne (M) et longue (L). |
|
Le vaccin, ses cibles et son impact sur l’infection et les maladies associées Le premier vaccin anti-hépatite B a été obtenu à la suite de travaux réalisés aux États-Unis et en France qui avaient montré que l’AgHBs administré d’abord à des chimpanzés, puis à l’homme, induisait des anticorps protecteurs, les Ac anti-HBs [7]. Ce vaccin consiste en des particules d’enveloppe virale vides, donc non infectieuses, mais immunogènes, qui sont encore appelées AgHBs. Initialement purifiées à partir du plasma des PC (vaccin plasmatique), elles ont été obtenues par la suite par les techniques de recombinaison génétique (vaccin recombinant). Grâce au clonage, puis au séquençage du génome viral réalisé en 1979 [8, 9], le vaccin a été produit en exprimant les gènes codant les protéines d’enveloppe du virus (Figure 2) dans la levure Saccharomyces cerevisiae ou dans des cellules animales [10, 11]. De nombreuses études ont montré que les deux types de vaccin sont également sûrs et efficaces. Les sujets cibles de la vaccination anti-hépatite B sont certes tous les individus à risque de contamination, et en particuliers les enfants nés de mères infectées, mais aussi, vu le large spectre des modes de transmission, l’ensemble de la population. C’est pourquoi l’organisation mondiale de la santé (OMS) a recommandé la vaccination universelle de tous les nouveau-nés. En 2013, 183 pays avaient adopté ce programme de vaccination ce qui a conduit à une diminution significative du taux d’infections chroniques chez les enfants et les adolescents. Ceci est particulièrement bien illustré à Taïwan où le taux des PC a diminué depuis 1984, de 10 % à moins de 1 % chez les adolescents et les jeunes adultes [12]. Mais le plus grand succès du vaccin contre l’hépatite B est certainement son impact sur l’incidence des carcinomes hépatocellulaires (CHC) qui ont diminué de plus de 80 % chez l’enfant et le jeune adulte à Taïwan [13], au Japon [14], au Canada [15] et en Chine [16] à la suite des campagnes de vaccination massive. Malgré ces succès, la couverture vaccinale reste basse dans de nombreux pays d’Asie ou d’Afrique, principalement pour des raisons économiques. Cette observation ainsi que l’augmentation du nombre absolu des PC [1] ont conduit l’OMS à proposer un programme global pour lutter contre l’hépatite B. L’organisation recommande l’injection de la première dose de vaccin avant l’âge de 2 mois, date à laquelle les enfants reçoivent la première dose de vaccin pentavalent, et, pour les enfants nés de mère avec infection chronique, de préférence dans les premières 24 h de vie. |
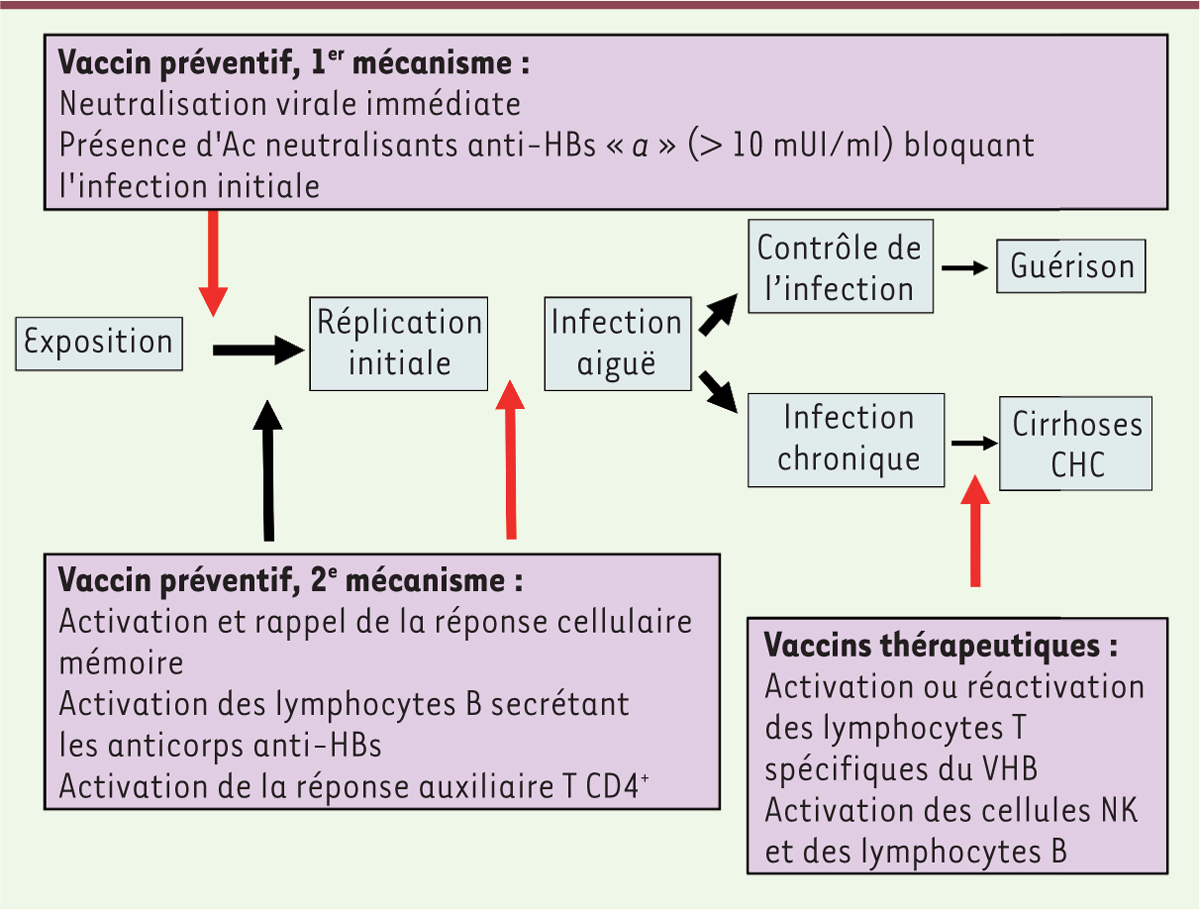
Problèmes à résoudre pour un meilleur contrôle de l’hépatite B Malgré les succès probants du vaccin, quelques questions se posent encore comme le problème des non répondeurs et des mauvais répondeurs à la vaccination, la nécessité d’une dose de rappel à l’âge adulte pour ceux qui ont été vaccinés dans la petite enfance, et l’émergence de virus mutants. Les mécanismes de réponse à la vaccination anti-hépatite B sont de deux types : la neutralisation immédiate du virus par les anticorps anti-HBs, à condition que ceux-ci aient un taux supérieur à 10 milliunités internationales (mUI)/ml et un rappel de la mémoire des lymphocytes B et T (Figure 3). En effet, ce vaccin qui est administré en présence d’alun comme adjuvant, induit une réponse immunitaire de type T CD4+ (ou T auxiliaire) et une réponse anticorps consécutive, produite par les lymphocytes B. En l’absence d’un taux d’anticorps suffisant pour neutraliser le virus, la mémoire immunitaire est réactivée et la production par les cellules B est relancée (Figure 3). C’est la raison pour laquelle il est possible, parfois, d’observer les traces immunologiques d’une petite réplication virale même en l’absence d’une hépatite à proprement parler. Cela a été très élégamment démontré dans une étude récente réalisée chez des personnes vaccinées régulièrement exposées au virus de par leur profession [17]. La réponse anticorps étant conditionnée par la réponse T et la présentation des peptides antigéniques par les molécules du complexe majeur d’histocompatibilité (CMH), des restrictions génétiques à la production d’anticorps anti-HBs, liées à certaines molécules du CMH de classe II, ont pu être mises en évidence [18]. D’autres facteurs comme le genre masculin, le surpoids, l’âge, les maladies chroniques, ou les pathologies affectant le système immunitaire, sont également impliqués dans la mauvaise réponse au vaccin telle que définie par un taux d’anticorps inférieur à 100 mUI/ml produit après un cycle complet de vaccination (2 ou 3 doses à un mois d’intervalle suivies d’un rappel après 6 ou 12 mois). En ce qui concerne les personnes infectées par le VIH (virus de l’immunodéficience humaine), deux études françaises récentes ont montré que l’emploi d’une double dose de vaccin (40 µg au lieu de 20) permettait de pallier la mauvaise réponse chez ces patients [19, 20]. Plusieurs solutions ont été envisagées pour améliorer la réponse au vaccin chez les mauvais répondeurs : l’utilisation d’adjuvants plus puissants [21], la voie d’injection intradermale à la place de l’intramusculaire classiquement utilisée [22], et l’utilisation de vaccins contenant, en plus de la petite protéine virale, les protéines d’enveloppe moyenne et grande du virus. Ces vaccins, également appelés vaccins de troisième génération, ont fait leurs preuves en améliorant la réponse chez des individus mauvais répondeurs [23]. En stimulant les lymphocytes T CD4+ par l’apport de nouveaux domaines antigéniques, ils contribuent en effet à l’augmentation de la réponse anticorps. Ces vaccins sont malheureusement distribués dans peu de pays.
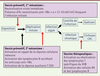 | Figure 3.
Mécanismes d’action des vaccins anti-hépatite B. Les vaccins préventifs agissent (1) par induction d’anticorps (Ac) neutralisants spécifiques du déterminant antigénique « a ». Ils préviennent l’infection par neutralisation immédiate du virus à condition que le titre des Ac anti-HBs soit supérieur à 10 mUI (unités internationales)/ml ; (2) par réactivation de la mémoire T auxiliaire CD4+ et de la mémoire B, et donc la production d’Ac anti-HBs. La phase d’incubation avant la réplication est suffisamment longue pour que la mémoire puisse être activée. Le vaccin bloque la phase réplicative avant l’apparition d’une infection aiguë ou chronique. Les vaccins thérapeutiques permettent soit d’induire, soit de réactiver une réponse immunitaire spécifique du VHB présente mais non fonctionnelle chez les porteurs chroniques du virus. Selon le type de vaccin utilisé, on peut observer une activation des cellules NK (natural killer) secrétant des cytokines antivirales, l’activation de lymphocytes T CD4+ et/ou T CD8+, et la production d’anticorps par les lymphocytes B. VHB : virus de l’hépatite B ; CHC : carcinome hépatocellulaire. |
La protection conférée par la vaccination dure entre 15 et 20 ans pour les enfants qui ont été vaccinés à la naissance ou dans la petite enfance. La question de la nécessité d’une dose de rappel après la primo vaccination était donc posée [24]. La politique de revaccination varie selon les pays. Elle est basée sur l’évaluation du risque de réinfection sachant que la mémoire immunitaire peut rapidement pallier le défaut d’anticorps [25]. On considère généralement que ce rappel n’est pas nécessaire dans les pays de faible endémie pour le VHB mais des recommandations ont cependant été émises pour certains sujets à risques [26]. Un autre problème à considérer concerne l’émergence de VHB mutants qui résistent à la neutralisation par les anticorps anti-HBs et ne sont pas détectés par les tests classiques de dépistage (par ELISA). Ces mutations peuvent survenir à la suite d’erreurs produites par les enzymes impliqués dans la réplication virale, par pression du système immunitaire, ou par des facteurs extrinsèques comme la vaccination ou les traitements antiviraux. La mutation la plus couramment observée touche le domaine antigénique majeur de l’AgHBs « a » (Figure 2) avec une substitution de glycine (G) en arginine (R) à la position 145 (G145R) de la protéine virale. Chez le chimpanzé, ce mutant est stable et infectieux. À côté de ce mutant, d’autres ont été décrits et sont potentiellement infectieux chez des individus vaccinés [27]. Néanmoins, les opinions divergent quant à l’impact de tels mutants à l’échelle d’une stratégie de vaccination globale [28, 29] et le consensus actuel semble indiquer que la vaccination de masse n’aurait qu’une faible incidence sur l’émergence de tels mutants. Plusieurs centaines de millions de vaccinations ont été effectuées dans le monde avec un bilan exceptionnel en terme d’efficacité pour réduire les infections et l’incidence des maladies qui sont liées au VHB. En terme de sécurité, aucune augmentation d’incidence ou de réactivation de maladies potentiellement liées à cette vaccination n’a pu être démontrée [30]. On peut néanmoins regretter qu’à la suite de différentes polémiques [45] (→), le taux de couverture vaccinale en France (voir
Encadré
) soit parmi les plus bas d’Europe [31].
|
Épidémiologie actuelle de l’hépatite B en France On considère qu’en France plus de 3 millions d’adultes ont été infectés par le VHB au cours de leur vie et qu’en 2004 près de 280 000 personnes étaient porteuses du virus dont près de la moitié (55 %) l’ignorait [31]. Le VHB serait, chaque année, à l’origine de 2 400 contaminations dont un quart symptomatiques, et de près de 1 300 décès [32]. On estime à 1/100 000 l’incidence des hépatites aiguës symptomatiques et le taux de mortalité imputable au VHB à 2,2/100 000 habitants. Une étude explorant les facteurs de risque potentiels dans un contexte d’hépatites B aiguës ne retrouve aucun facteur de risque dans 30 % des cas, un risque sexuel dans 35,8 % des cas, un voyage en pays d’endémie pour 21,4 %, des soins invasifs pour 8,6 %, une exposition familiale dans 6,8 % des cas, l’usage de drogues pour 2,5 %, de piercing/tatouage pour 4,9 %, etc. À noter que le risque périnatal, malgré un dépistage maternel de l’AgHBs incomplet, a heureusement été réduit à 0,4 %. Ces éléments font qu’une stratégie vaccinale reposant uniquement sur des groupes « à risque » n’est pas cohérente et qu’une vaccination universelle doit être instaurée. En France, cette option a été retenue mais la couverture vaccinale (vaccination complète) n’était en 2014 que de 72 % chez les enfants à l’âge de 24 mois et de 32,5 % chez les adolescents, donc très insuffisante et très en dessous des objectifs nationaux [33] et des couvertures obtenues dans la plupart des pays européens. La vaccination contre l’hépatite B doit être relancée en rétablissant la confiance dans ce vaccin remarquablement efficace et en affichant une politique claire et volontariste.
|
(→) Voir la Perspective de D. Floret, m/s n° 12, décembre 2010, page 1087
|
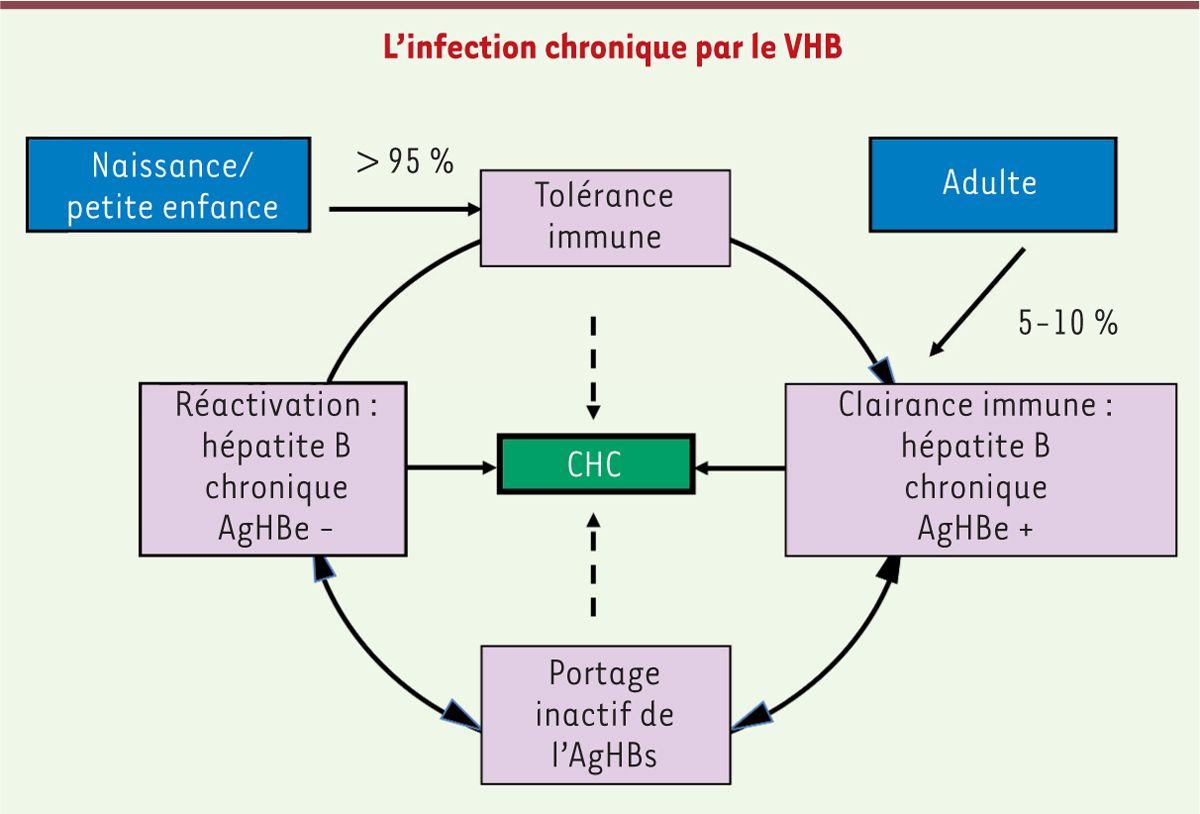
La vaccination contre l’hépatite B : une approche thérapeutique potentielle ? Malgré les campagnes de vaccination massives et les récents progrès des thérapies antivirales, les 200 à 300 millions de porteurs chroniques (PC) du VHB représentent un réservoir viral important à l’échelle mondiale [34]. L’hépatite B chronique est une maladie avec une évolution dynamique et complexe. Elle a été divisée schématiquement en quatre formes différentes en fonction de paramètres virologiques et cliniques (Figure 4) [2]. C’est le dialogue permanent entre le virus et le système immunitaire qui conditionne l’évolution de cette maladie [35]. Aussi, le vaccin a très tôt été utilisé pour stimuler la production d’anticorps anti-HBs et favoriser l’élimination du virus circulant chez les porteurs chroniques. Les premières études réalisées dans de petits groupes de sujets, puis celles comparant le vaccin au traitement par l’interféron-alpha, ont montré quelques améliorations virologiques et immunologiques mais celles-ci sont restées malheureusement transitoires [36]. Le vaccin a été par la suite combiné à différents adjuvants de l’immunité et à des antiviraux, comme la lamivudine2, mais sans augmentation significative d’efficacité antivirale [37]. Avec une connaissance de plus en plus poussée de l’immunité anti-VHB chez les PC [35], et la mise en évidence de la nécessité d’activer les lymphocytes T CD8+ afin d’éliminer les hépatocytes infectés, de nombreuses approches ont été développées parmi lesquelles la vaccination à base d’ADN nu [37]. Ainsi lors d’un essai de phase I réalisé chez des patients PC du VHB, l’injection d’ADN codant deux des protéines d’enveloppe du virus s’est montrée efficace pour réactiver les réponses T CD8+ spécifiques du VHB à l’origine de la production de cytokines antivirales [38]. Mais, à nouveau, le passage aux essais randomisés avec groupe contrôle n’a pas permis de confirmer ces avancées, même en combinaison avec d’autres antiviraux et/ou des cytokines [37]. Cependant, la grande hétérogénéité des situations cliniques des patients PC inclus lors de ces essais représente une difficulté majeure (Figure 4). En effet, l’histoire naturelle de la maladie chez ces patients (ancienneté, mode d’infection, etc.) et la durée du traitement antiviral peuvent fortement compliquer l’analyse des résultats.
 | Figure 4.
Histoire naturelle de l’infection chronique. L’infection chronique a été définie en quatre phases. La phase de tolérance immune, principalement observée chez les individus infectés à la naissance ou dans la petite enfance. Elle se caractérise par des charges virales élevées et un foie pratiquement normal. La phase de clairance immune observée chez l’adulte correspond à l’activation du système immunitaire qui tente alors de contrôler l’infection. On note la présence de l’AgHBe, des charges virales fluctuantes, une élévation des transaminases sériques et une forte inflammation du foie. Cette phase est suivie par la phase dite de « portage inactif de l’AgHBs » caractérisée par la séroconversion AgHBe/Ac anti-HBe, une charge virale inférieure à 2 000 UI (unités internationales)/ml et une atteinte minime du foie. Cette phase peut durer plusieurs décades. La phase dite de « réactivation » peut survenir tardivement avec une ré-augmentation de la charge virale, l’émergence de virus mutants AgHBe négatifs et une forte inflammation du foie. Un patient peut progresser vers le carcinome hépatocellulaire (CHC) à partir des quatre phases encadrées. |
Les données récentes portant sur l’immunité anti-VHB au cours de l’infection chronique suggèrent que les approches vaccinales devront prendre en compte la situation complexe d’immunotolérance qui est induite par les fortes charges antigéniques présentes dans le sérum des patients ainsi que la présence de cellules T anti-VHB dont les fonctions sont fortement altérées [39]. De nouveaux vecteurs viraux ont ainsi été développés, comme ceux utilisant l’adénovirus, et les cibles antigéniques ont été élargies afin d’inclure la protéine de capside et la polymérase virale [40]. Pour tenter de contrecarrer les mécanismes d’épuisement ou d’inhibition des cellules T, des anticorps appelés « checkpoint inhibitors » (inhibiteurs de points de blocage) ayant fait leurs preuves dans le domaine de l’immunothérapie du cancer, sont en cours d’essais dans des modèles animaux en combinaison avec des vaccins ADN [41]. À la faveur des avancées scientifiques l’arsenal thérapeutique destiné à renforcer l’effet des vaccins thérapeutiques se diversifie donc. Aujourd’hui, plusieurs essais de vaccins thérapeutiques, réalisés chez des patients sous traitements antiviraux (Entécavir ou Ténofovir), sont enregistrés sur le site officiel référençant les études cliniques (www.clinicaltrials.gov) : un vaccin basé sur des levures inactivées à la chaleur exprimant les protéines d’enveloppe, la capside et la protéine « HBx » (GS4774, NCT02174276) ; un vaccin recombinant comprenant l’AgHBs et l’AgHBc sous la forme de particules agglomérées administrées par voie nasale (NASVAC, NCT01374308 et ABX203, NCT02249988) ; un vaccin ADN codant l’enveloppe, la capside du virus et une cytokine, l’IL(interleukine)-12 (INO-9112, NCT02431312) ; un vecteur dérivé d’un adénovirus non réplicatif codant une protéine de fusion combinant les protéines de capside et de la polymérase avec des domaines antigéniques de la protéine d’enveloppe virale (TG 1050, NCT02428400). Trois autres essais utilisent le vaccin recombinant classique commercial en l’administrant pour l’un, de manière répétée après 3 ans de traitement antiviral, avec l’idée de stimuler la séroconversion anti-HBs (NCT02505009) ; pour le second, tous les 2 mois chez des patients où le taux d’AgHBs sérique est déjà diminué (NCT01817725) ; et pour le troisième, à triple dose en association avec un antiviral (l’Entécavir), de l’interféron alfa-2b et une cytokine, l’IL-2 (NCT02360592). De nombreuses autres approches sont en cours de réalisation dans des modèles animaux ou chez l’homme, notamment celles qui ciblent directement le virus ou l’immunité innée de l’hôte. Des molécules très prometteuses ciblant l’entrée virale, la formation de la capside, l’encapsidation de l’ARN prégénomique ou la sécrétion de l’enveloppe virale, ainsi que l’expression des protéines virales dans le foie sont en cours de développement ou déjà en essais cliniques. Parmi les nouvelles molécules immunomodulatrices, les agonistes de TLR (Toll-like receptors) sont en cours d’essai (pour revue [42]). Leur combinaison avec les vaccins thérapeutiques et les molécules antivirales actuelles devraient permettre d’obtenir un contrôle soutenu et persistant du virus jusqu’au but final qui est l’élimination du virus du foie, de l’AgHBs du sérum, et la guérison [43]. |
L’auteur déclare avoir participé à des activités de conseil pour les entreprises Janssen, Abivax et Transgene en matière de vaccins thérapeutiques.
|
Footnotes |
1.
Ott JJ, Stevens GA, Groeger J, Wiersma ST. Global epidemiology of hepatitis B virus infection: new estimates of age-specific HBsAg seroprevalence and endemicity . Vaccine. 2012; ; 30 : :2212.–2219. 2.
Ganem D, Prince AM. Hepatitis B virus infection: natural history and clinical consequences . N Engl J Med. 2004; ; 350 : :1118.–1129. 3.
Shimakawa Y, Lemoine M, Njai HF, et al. Natural history of chronic HBV infection in West Africa: a longitudinal population-based study from The Gambia . Gut. 2015 ; pii: gutjnl-2015-309892. doi : 10.1136/gutjnl-2015-309892. 4.
Stevens CE, Beasley RP, Tsui J, Lee WC. Vertical transmission of hepatitis B antigen in Taiwan . N Engl J Med. 1975; ; 292 : :771.–774. 5.
Beasley RP, Hwang LY, Lin CC, et al. Incidence of hepatitis B virus infections in preschool children in Taiwan . J Infect Dis. 1982; ; 146 : :198.–204. 6.
Sarkar M, Terrault NA. Ending vertical transmission of hepatitis B: the third trimester intervention . Hepatology. 2014; ; 60 : :448.–451. 7.
Maupas P, Goudeau A, Coursaget P, et al. Hepatitis B vaccine: efficacy in high-risk settings, a two-year study . Intervirology. 1978; ; 10 : :196.–208. 8.
Galibert F, Mandart E, Fitoussi F, et al. Nucleotide sequence of the hepatitis B virus genome (subtype ayw) cloned in E. coli . Nature. 1979; ; 281 : :646.–650. 9.
Pasek M, Goto T, Gilbert W, et al. Hepatitis B virus genes and their expression in E. coli . Nature. 1979; ; 282 : :575.–579. 10.
Valenzuela P, Medina A, Rutter WJ, et al. Synthesis and assembly of hepatitis B virus surface antigen particles in yeast . Nature. 1982; ; 298 : :347.–350. 11.
Michel ML, Pontisso P, Sobczak E, et al. Synthesis in animal cells of hepatitis B surface antigen particles carrying a receptor for polymerized human serum albumin . Proc Natl Acad Sci USA. 1984; ; 81 : :7708.–7712. 12.
Chiang CJ, Yang YW, You SL, et al. Thirty-year outcomes of the national hepatitis B immunization program in Taiwan . JAMA. 2013; ; 310 : :974.–976. 13.
Chang MH, You SL, Chen CJ, et al. Decreased incidence of hepatocellular carcinoma in hepatitis B vaccinees: a 20-year follow-up study . J Natl Cancer Inst. 2009; ; 101 : :1348.–1355. 14.
Tajiri H, Tanaka H, Brooks S, Takano T. Reduction of hepatocellular carcinoma in childhood after introduction of selective vaccination against hepatitis B virus for infants born to HBV carrier mothers . Cancer Causes Control. 2011; ; 22 : :523.–527. 15.
McMahon BJ, Bulkow LR, Singleton RJ, et al. Elimination of hepatocellular carcinoma and acute hepatitis B in children 25 years after a hepatitis B newborn and catch-up immunization program . Hepatology. 2011; ; 54 : :801.–807. 16.
Qu C, Chen T, Fan C, et al. Efficacy of neonatal HBV vaccination on liver cancer and other liver diseases over 30-year follow-up of the Qidong hepatitis B intervention study: a cluster randomized controlled trial . PLoS Med. 2014; ; 11 : :e1001774.. 17.
Werner JM, Abdalla A, Gara N, et al. The hepatitis B vaccine protects re-exposed health care workers, but does not provide sterilizing immunity . Gastroenterology. 2013; ; 145 : :1026.–1034. 18.
Li ZK, Nie JJ, Li J, Zhuang H. The effect of HLA on immunological response to hepatitis B vaccine in healthy people: a meta-analysis . Vaccine. 2013; ; 31 : :4355.–4361. 19.
Launay O, van der Vliet D, Rosenberg AR, et al. Safety and immunogenicity of 4 intramuscular double doses and 4 intradermal low doses vs standard hepatitis B vaccine regimen in adults with HIV-1: a randomized controlled trial . JAMA. 2011; ; 305 : :1432.–1440. 20.
Rey D, Piroth L, Wendling MJ, et al. Safety and immunogenicity of double-dose versus standard-dose hepatitis B revaccination in non-responding adults with HIV-1 (ANRS HB04 B-BOOST): a multicentre, open-label, randomised controlled trial . Lancet Infect Dis. 2015; ; 15 : :1283.–1291. 21.
Kong NC, Beran J, Kee SA, et al. A new adjuvant improves the immune response to hepatitis B vaccine in hemodialysis patients . Kidney Int. 2008; ; 73 : :856.–862. 22.
Filippelli M, Lionetti E, Gennaro A, et al. Hepatitis B vaccine by intradermal route in non responder patients: an update . World J Gastroenterol. 2014; ; 20 : :10383.–10394. 23.
Krawczyk A, Ludwig C, Jochum C, et al. Induction of a robust T- and B-cell immune response in non- and low-responders to conventional vaccination against hepatitis B by using a third generation PreS/S vaccine . Vaccine. 2014; ; 32 : :5077.–5082. 24.
Zanetti AR, Mariano A, Romano L, et al. Long-term immunogenicity of hepatitis B vaccination and policy for booster: an Italian multicentre study . Lancet. 2005; ; 366 : :1379.–1384. 25.
Lu CY, Ni YH, Chiang BL, et al. Humoral and cellular immune responses to a hepatitis B vaccine booster 15–18 years after neonatal immunization . J Infect Dis. 2008; ; 197 : :1419.–1426. 26.
Are booster immunisations needed for lifelong hepatitis B immunity? European Consensus Group on Hepatitis B Immunity . Lancet. 2000; ; 355 : :561.–565. 27.
Romano L, Paladini S, Galli C, et al. Hepatitis B vaccination. Hum Vaccin Immunother. 2015; ; 11 : :53.–57. 28.
Hsu HY, Chang MH, Ni YH, et al. No increase in prevalence of hepatitis B surface antigen mutant in a population of children and adolescents who were fully covered by universal infant immunization . J Infect Dis. 2010; ; 201 : :1192.–1200. 29.
Locarnini S, Shouval D. Commonly found variations/mutations in the HBsAg of hepatitis B virus in the context of effective immunization programs: questionable clinical and public health significance . J Virol. 2014; ; 88 : :6532.. 30.
Launay O, Floret D. Vaccination contre l’hépatite B. Med Sci (Paris). 2015; ; 31 : :551.–558. 31.
Denis F, Cohen R, Martinot A, et al. Evolution of hepatitis B vaccine coverage rates in France between 2008 and 2011 . Med Mal Infect. 2013; ; 43 : :272.–278. 32.
Antona D, Lefort MJ, Larsen C, Levy-Bruhl D. L’infection par le virus de l’hépatite B : une maladie sexuellement transmissible . Bull Epidemiol Hebd. 2011; ; 26–27-28 : :307.–310. 33.
Stahl JP, Denis F, Gaudelus J, et al. Hepatitis B vaccination and adolescents: a lost generation . Med Mal Infect. 2016; ; 46 : :1.–3. 34.
Liang TJ, Block TM, McMahon BJ, et al. Present and future therapies of hepatitis B: from discovery to cure . Hepatology. 2015; ; 62 : :1893.–1908. 35.
Rehermann B, Nascimbeni M. Immunology of hepatitis B virus and hepatitis C virus infection . Nat Rev Immunol. 2005; ; 5 : :215.–229. 36.
Couillin I, Pol S, Mancini M, et al. Specific vaccine therapy in chronic hepatitis B: induction of T cell proliferative responses specific for envelope antigens . J Infect Dis. 1999; ; 180 : :15.–26. 37.
Michel ML, Deng Q, Mancini-Bourgine M. Therapeutic vaccines and immune-based therapies for the treatment of chronic hepatitis B: perspectives and challenges . J Hepatol. 2011; ; 54 : :1286.–1296. 38.
Mancini-Bourgine M, Fontaine H, Scott-Algara D, et al. Induction or expansion of T-cell responses by a hepatitis B DNA vaccine administered to chronic HBV carriers . Hepatology. 2004; ; 40 : :874.–882. 39.
Protzer U, Maini MK, Knolle PA. Living in the liver: hepatic infections . Nat Rev Immunol. 2012; ; 12 : :201.–213. 40.
Martin P, Dubois C, Jacquier E, et al. TG1050, an immunotherapeutic to treat chronic hepatitis B, induces robust T cells and exerts an antiviral effect in HBV-persistent mice . Gut. 2015; ; 64 : :1961.–1971. 41.
Liu J, Zhang E, Ma Z, et al. Enhancing virus-specific immunity in vivo by combining therapeutic vaccination and PD-L1 blockade in chronic hepadnaviral infection . PLoS Pathog. 2014; ; 10 : :e1003856.. 42.
Testoni B, Zoulim F. Liver capsule: validated and potential novel targets to treat hepatitis B virus . Hepatology. 2015; ; 62 : :1619.. 43.
Zeisel MB, Lucifora J, Mason WS, et al. Towards an HBV cure: state-of-the-art and unresolved questions. Report of the ANRS workshop on HBV cure . Gut. 2015; ; 64 : :1314.–1326. 44.
Launay O, Floret D. Vaccination contre l’hépatite B. Med Sci (Paris). 2015; ; 31 : :551.–558. 45.
Floret D. Les résistances à la vaccination . Med Sci (Paris). 2010; ; 26 : :1087.–1093. |