| |
| Med Sci (Paris). 32(10): 812–814. doi: 10.1051/medsci/20163210007.Un modèle murin pour une infection chronique méconnue : l’hépatite E ! Hélène Gilgenkrantz,1* Jérôme Gouttenoire,2 and Vincent Mallet3 1Institut Cochin, Inserm U1016, CNRS UMR 8104, Université Paris-Descartes, 24, rue du faubourg saint-Jacques, 75005Paris, France 2Division de gastro-entérologie et d’hépatologie, centre hospitalier universitaire vaudois, université de Lausanne, Suisse 3Université Paris Descartes, assistance publique-hôpitaux de Paris, groupe hospitalier Cochin Port Royal, service d’hépatologie, Inserm U1223, Institut Pasteur, Paris, France MeSH keywords: Animaux, Maladie chronique, Modèles animaux de maladie humaine, Hépatite E, Hépatocytes, Hétérogreffes, Humains, Souris, Souris de lignée NOD, Souris SCID, Souris transgéniques, Ribavirine, Activateur du plasminogène de type urokinase, traitement médicamenteux, virologie, transplantation, usage thérapeutique, génétique |
Un virus oublié, une maladie émergente… L’hépatite E est reconnue comme la première cause d’hépatite à transmission entérique dans le monde [1] (→).
(→) Voir la Nouvelle de J. Izopet et N. Kamar, m/s n° 12, décembre 2008, page 1023
Si la première épidémie a été décrite dans les années 1950 en Inde, le virus n’a été identifié qu’en 1983 par un chercheur soviétique, Mikhail Balayan, et le génome cloné quelques années plus tard, en 1990. Cette infection oubliée ne fait pourtant parler à nouveau d’elle que depuis quelques années dans les meilleurs journaux scientifiques, notamment depuis que l’on connaît sa prévalence en France et sa gravité chez les individus fragiles. Le virus de l’hépatite E (VHE) appartient à la famille Herpesviridae. C’est un petit virus non enveloppé qui possède un génome à ARN simple brin à polarité positive, comportant 3 phases ouvertes de lecture (ORF, open reading frame) qui conduisent à la traduction de seulement 3 protéines virales : ORF1, 2 et 3. Grâce à l’avènement des puissantes techniques de séquençage à haut-rendement, le VHE a pu être identifié dans de nombreuses espèces animales. La diversité d’animaux susceptibles d’être infectés par ce virus constitue un réservoir potentiel de transmission zoonotique à l’homme. Actuellement, on connaît quatre génotypes majeurs : les VHE1 et 2 sont restreints à l’homme et sont endémiques dans les régions en voie de développement, alors que les VHE3 et 4 peuvent également infecter certains mammifères et sont surtout présents dans les pays industrialisés. En France, le génotype VHE3 est particulièrement représenté avec une nette prévalence dans le sud toulousain, sans que la raison en soit actuellement comprise. L’origine de la majorité des infections serait essentiellement l’ingestion d’eau contaminée dans les régions endémiques et la consommation de viande (porc, gibier) insuffisamment cuite dans les pays industrialisés. De nouveaux modes de contamination ne cessent néanmoins d’être rapportés. La transfusion sanguine par exemple, effectuée en général chez des individus fragiles, est un mode de transmission qui a été récemment mis en exergue dans plusieurs publications [2]. Un vaccin très efficace a été développé à partir de la protéine recombinante de la capside virale mais son utilisation et sa commercialisation restent cependant restreintes à l’Asie. Dans la majorité des cas, l’infection par le VHE est asymptomatique et spontanément résolutive. Cependant, l’infection par VHE1, chez la femme enceinte, peut avoir des conséquences dramatiques, avec un taux de mortalité atteignant 25 %. C’est en 2008 que le VHE fait son entrée parmi les causes de cirrhose, au même titre que les hépatites B et C [3]. Cependant, la persistance du virus, définie par une virémie enregistrée au-delà de 6 mois, n’est observée qu’en cas d’immunosuppression, notamment chez des patients traités par chimiothérapie, ou infectés par le VIH (virus de l’immunodéficience humaine) présentant de faibles taux de lymphocytes CD4 ou, plus couramment, chez les patients transplantés d’organes (rein, cœur, poumon, foie). L’histoire naturelle de l’hépatite chronique E se caractérise par une progression rapide vers la cirrhose et ses complications, et ce de façon beaucoup plus rapide qu’au cours des hépatites chroniques B et C. Les personnes âgées, ou avec une maladie du foie sous-jacente, sont à risque d’insuffisance hépatite sévère. Des atteintes extrahépatiques, dont le mécanisme sous-jacent n’est pour l’instant pas compris, sont également rapportées. |
Un ancien traitement, une nouvelle indication Les moyens pour traiter cette infection chronique sont encore limités. Des premiers cas d’éradication virale par la ribavirine1, utilisée contre le virus de l’hépatite C en combinaison avec l’interféron ou les nouveaux antiviraux, ont été rapportés en 2010 sur des cas isolés par deux équipes françaises. Une collaboration entre ces deux équipes a alors permis de démontrer que cet analogue de la guanosine permettait de guérir presque 3/4 des patients chroniquement infectés par le VHE [4]. Rappelons que dans le cas du virus de l’hépatite C, ce médicament n’a jamais montré de pouvoir antiviral lorsqu’il est utilisé isolément. Le mécanisme d’action de la ribavirine reste mal compris. Certaines études suggèrent qu’elle induirait un appauvrissement en nucléotides libres et qu’en se combinant avec un inhibiteur de l’inosine monophosphate déshydrogénase (IMPDH), elle permettrait une inhibition plus profonde de la réplication du VHE [5]. À noter qu’une des molécules stars des nouvelles thérapies contre l’hépatite C, le sofosbuvir, peut également avoir un effet inhibiteur, additif à celui de la ribavirine, sur la réplication du VHE in vitro [6]. Malgré ces dernières données, un certain nombre de patients chroniquement infectés par le VHE ne bénéficient pas d’un traitement efficace. Le développement d’un modèle animal pour l’infection chronique par le VHE permettrait donc d’évaluer l’efficacité in vivo de potentiels traitements. Un tel modèle d’étude autoriserait l’exploration des mécanismes de développement de la maladie et une meilleure compréhension du cycle de vie de ce virus qui reste encore très énigmatique. Si plusieurs hôtes naturels du VHE, notamment le lapin, le porc, le rat, le furet et le poulet, constituent de potentiels modèles d’étude, la plupart d’entre eux ne peuvent être infectés que par des souches qui sont génétiquement éloignées des VHE « humains » et ne développent pas d’hépatite ni de persistance du virus. Les primates non humains (comme les macaques cynomolgus et rhesus) sont infectables par le virus humain mais ils restent d’utilisation expérimentale délicate. |
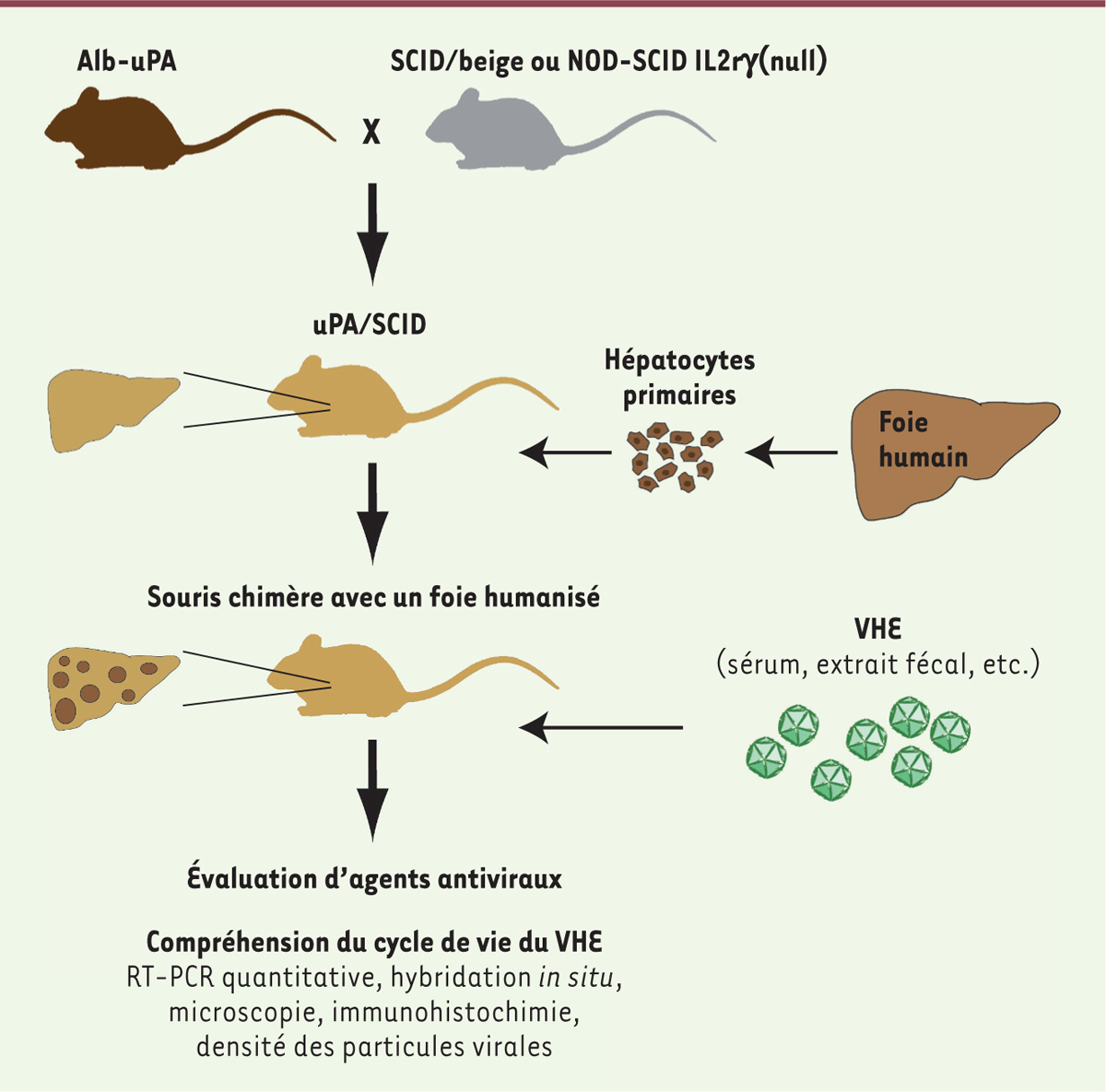
Une souris avec un foie humanisé comme modèle d’infection chronique par le VHE En suivant une démarche similaire à celle employée pour le développement des modèles murins d’infection chronique par les virus des hépatites B et C, trois équipes européennes ont simultanément développé un modèle murin d’hépatite E chronique [7-9]. Les auteurs ont utilisé un modèle classique de repeuplement du foie de souris immunosupprimées par des hépatocytes humains (Figure 1). Ces souris expriment le transgène uPA (urokinase-type plasminogen activator) qui entraîne une lyse continue autocrine des hépatocytes qui l’expriment, laissant ainsi un avantage sélectif de prolifération aux hépatocytes transplantés qui n’en sont pas porteurs. Quelques mois après la transplantation d’hépatocytes humains, le foie est chimérique, c’est-à-dire qu’il est repeuplé partiellement par les hépatocytes normaux provenant du donneur. Pour permettre l’implantation et la prolifération d’hépatocytes humains dans ce modèle, les souris sont génétiquement immunodéprimées. Les auteurs de ces études ont infecté ces souris au foie humanisé, par le VHE1 et 3, par voie sanguine à partir de divers échantillons provenant d’extraits sériques ou fécaux de patients ou de chimpanzés, ou par des virus produits en culture cellulaire [7–9]. De façon remarquable, une virémie stable est observée dans ce modèle de souris au-delà de 6 mois après l’infection, attestant d’une infection chronique. Un résultat important, obtenu dans l’une de ces études, est la mise en évidence d’une transmission par contact. En effet, la cohabitation de souris infectées et de souris naïves, dans la même cage, résulte en une infection de la population naïve sur une période de 10 semaines. Il est à noter qu’aucun signe d’hépatite n’a été constaté, excluant ainsi la possibilité d’étudier la pathogenèse de l’infection par le VHE dans ce modèle.
 | Figure 1.
Protocole d’infection virale par le VHE d’une souris au foie humanisé. Des souris transgéniques exprimant le transgène activateur du plasminogène (uPA) dans le foie sont croisées avec des souris immunodéprimées. Les souris ainsi obtenues reçoivent une transplantation d’hépatocytes primaires issus d’un foie humain. Lorsque le foie de la souris receveuse est partiellement humanisé, elle peut être infectée par un extrait sérique ou fécal d’un patient infecté par le virus. Les souris sont alors disponibles pour l’étude du cycle viral ou pour tester l’efficacité de nouveaux médicaments. Alb : albumine ; SCID : severe combined immunodeficiency ; NOD : nonobese diabetic ; IL2rg : interleukin 2 receptor subunit gamma ; VHE : virus de l’hépatite E ; RT-PCR : reverse transcriptase polymerase chain reaction. |
L’hépatite E chronique est caractérisée par une inflammation du foie certainement intimement liée à l’activité du système immunitaire, même affaibli chez les patients immunosupprimés. Un modèle doublement humanisé sur les hépatocytes et le système immunitaire a été établi avec succès pour l’hépatite C, permettant l’étude de la fibrogenèse et de la réponse immunitaire induite par le virus [10]. Gageons qu’il en sera de même prochainement pour l’hépatite E ! En attendant, quelles peuvent être les retombées de l’usage de ce nouveau modèle de souris ?
1. Utiliser ces souris comme modèle préclinique pour l’essai de nouvelles options thérapeutiques constitue un intérêt évident. Deux de ces études ont par ailleurs déjà testé l’effet du seul traitement efficace, la ribavirine. Un effet antiviral prononcé a été observé avec une chute de la virémie après quelques semaines de traitement sans que celui-ci n’atteigne cependant l’éradication du virus. Dans la mesure où disposer d’hépatocytes humains pour l’obtention de ce modèle est une contrainte importante, l’avenir passe sans doute par l’utilisation de cellules souches humaines pluripotentes, ou iPS (induced-pluripotent stem cells), différenciées en hépatocytes à l’instar de ce qui a déjà été développé pour l’hépatite C [11].
2. Pouvoir étudier le cycle de vie du virus in vivo est un des atouts majeurs de ce modèle de souris. À ce titre, ces premières études montrent que la protéine de la capside, ORF2, est présente dans le cytoplasme alors que la petite protéine ORF3, impliquée dans la sécrétion des particules virales, se localise dans la membrane apicale des hépatocytes et les canalicules biliaires les jouxtant. Ces informations sont d’autant plus uniques et intéressantes que les modèles de culture cellulaire actuels pour étudier ce virus sont encore limités et inefficaces en terme de réplication virale.
3. Glaner des informations sur la nature du virus retrouvé dans les différents compartiments du corps est également un enjeu important que ce modèle autorise. Plus précisément, le virus est présent dans le sang sous forme enveloppée dans une membrane cellulaire alors que dans la bile il est nu, plus infectieux et présent en quantité très importante. En outre, le VHE1, le plus pathogène chez l’homme, conduit à des virémies plus élevées que le VHE3, expliquant sans doute les différences symptomatiques observées en clinique. Nous avons encore beaucoup à apprendre sur le virus de l’hépatite E mais, en attendant des progrès spectaculaires, mieux vaut se méfier de l’adage qui dit que tout est bon dans le cochon, en particulier pour les amateurs de figatellù corse2 qui préféreront la manger cuite… |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Izopet J, Kamar N. Hépatite E : de la transmission zoonotique du virus à l’évolution chronique de l’infection chez l’immunodéprimé . Med Sci (Paris). 2008; ; 24 : :1023.–1025. 2.
Hewitt PE, Ijaz S, Brailsford SR, et al. Hepatitis E virus in blood components: a prevalence and transmission study in southeast England . Lancet. 2014; ; 384 : :1766.–1773. 3.
Kamar N, Selves J, Mansuy JM, et al. Hepatitis E virus and chronic hepatitis in organ-transplant récipients . N Engl J Med. 2008; ; 358 : :811.–817. 4.
Kamar N, Izopet J, Tripon S, et al. Ribavirin for chronic hepatitis E virus infection in transplant recipients . N Engl J Med. 2014; ; 370 : :1111.–1120. 5.
Wang Y, Zhou X, Debing Y, et al. Calcineurin inhibitors stimulate and mycophenocolic acid inhibits replication of hepatitis E virus . Gastroenterology. 2014; ; 146 : :1775.–1783. 6.
Dao Thi VL, Debing Y, Wu X, et al. Sofosbuvir inhibits hepatitis E virus replication in vitro and results in an additive effect when combined with ribavirin . Gastroenterology. 2016; ; 150 : :82.–85. 7.
Allweiss L, Gass S, Giersch K, et al. Human liver chimeric mice as a new model of chronic hepatitis E virus infection and preclinical drug evaluation . J Hepatol. 2016; ; 64 : :1033.–1040. 8.
Sayed IM, Verhoye L, Cocquerel L, et al. Study of hepatitis E virus infection of genotype 1 and 3 in mice with humanised liver . Gut. 2016 ; doi: 10.1136/gutjnl-2015-311109.
9.
Van de Garde MD, Pas SD, van der Net G, et al. Hepatitis E virus (HEV) genotype 3 infection of human liver chimeric mice as a model for chronic HEV infection . J Virol. 2016; ; 90 : :4394.–4401. 10.
Gilgenkrantz H. Des souris humanisées pour l’étude du virus de l’hépatite C . Med Sci (Paris). 2011; ; 27 : :587.–589. 11.
Carpentier A, Liang TJ. Transplantation d’hépatocytes humains dérivés des cellules souches dans le foie de souris . Med Sci (Paris). 2015; ; 31 : :256.–259. |