| |
| Med Sci (Paris). 32(10): 839–841. doi: 10.1051/medsci/20163210016.Régénération hépatique Deux pièces du puzzle réunies Anthony Lambert1* and Boris Julien2** 1M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 2Inserm U-1174, Université Paris-Sud, 91405Orsay, France MeSH keywords: Adénosine triphosphate, Animaux, Hépatectomie, Humains, Inflammation, Interleukines, Foie, Maladies du foie, Régénération hépatique, Lymphocytes, Souris, métabolisme, biosynthèse, physiologie, physiopathologie, thérapie, immunologie |
La régénération hépatique : un processus complexe avec encore de nombreuses zones d’ombre Le foie, situé à une position anatomique stratégique à l’interface entre le tractus digestif et la circulation sanguine générale, assure un très grand nombre de fonctions métaboliques et immunitaires de notre organisme. Ces fonctions l’exposent à des agressions variées et expliqueraient en partie pourquoi, chez les mammifères, le foie a conservé au cours de l’évolution une exceptionnelle capacité de régénération. Cette propriété du foie est utilisée dans la prise en charge de certaines pathologies hépatiques. Ainsi, elle permet d’envisager l’hépatectomie partielle avec peu de complications à long terme, notamment dans le contexte d’une résection tumorale. De plus, la transplantation d’un greffon hépatique issu d’un donneur vivant est également possible pour remplacer le foie non fonctionnel d’un patient, puisque le foie rémanent du donneur ainsi que le greffon chez le receveur régénéreront pour restituer un foie de taille normale. Il est déjà bien établi que la régénération mobilise un très grand nombre d’acteurs cellulaires et moléculaires, non seulement localement dans le foie, mais aussi dans tout l’organisme. Ces interactions vont réguler la progression du cycle des différents types cellulaires du foie ainsi que la survie des hépatocytes exposés à de nombreux stress lors de la régénération. Cependant, la complexité de ce processus est telle que beaucoup de zones d’ombre subsistent quant à la nature des signaux intercellulaires impliqués, leur source et leurs cibles [1]. Le travail de Kudira et al. [2] – dont nous analysons ici les résultats – améliore notre compréhension du réseau d’interactions régulant la régénération. En effet, cette équipe avait déjà montré que la signalisation purinergique (l’adénosine triphosphate [ATP] extracellulaire, ses produits de dégradation et leurs récepteurs) contrôlait les propriétés pro-régénératrices des cellules natural killer (NK) après résection hépatique, sans pouvoir en déterminer les mécanismes précis [3]. Dans cette nouvelle étude [2], les auteurs explicitent ce mécanisme et montrent que la signalisation purinergique stimule la production d’interleukine 22 (IL-22) – une cytokine hépatoprotectrice – par les innate lymphoid cells (ILC), famille de cellules de la lignée lymphoïde impliquées dans la réponse immunitaire innée et à laquelle appartiennent les cellules NK ([4]) (→).
(→) Voir la Synthèse de M. Cherrier récemment consacrée à ce thème, m/s n° 3, mars 2014, page 280
|
L’IL-22 protège le parenchyme après hépatectomie partielle Les signaux émis par les cellules de l’immunité innée jouent un rôle central dans la régulation fine du déclenchement, de la progression et de la terminaison du processus de régénération. Cependant, ces cellules peuvent avoir des fonctions ambivalentes sur la progression de la réparation tissulaire selon les messages qu’elles reçoivent. Par exemple, les macrophages favorisent la régénération en produisant de l’IL-6 [1], mais ils peuvent également l’inhiber via la sécrétion d’IL-10 [5]. Il est donc important d’étudier les médiateurs libérés par les cellules de l’immunité innée ainsi que les conditions environnementales qui déterminent leur production. L’IL-22 est sécrétée par les cellules de l’immunité et exerce des propriétés hépatoprotectrices [6]. Kudira et al. [2] se sont intéressés dans ce travail à identifier les cellules productrices de cette cytokine et les mécanismes de régulation de sa production au cours de la régénération après hépatectomie partielle. Dans un premier temps, les auteurs [2] ont complété les observations faites par l’équipe de B. Gao [7], qui avait montré que, chez des souris transgéniques surexprimant l’IL-22, la régénération hépatique après hépatectomie partielle (résection chirurgicale des 2/3 du foie) était plus rapide. Kudira et al. ont confirmé l’implication de cette cytokine : ils ont mis en évidence une augmentation de la concentration en IL-22 circulante dans le plasma de patients ayant subi une résection hépatique. De plus, ils ont montré que la régénération après hépatectomie partielle était ralentie chez des souris invalidées génétiquement pour l’IL-22 (il-22-/-) par comparaison avec des souris sauvages. Ce phénotype pourrait s’expliquer par un défaut de protection du parenchyme hépatique, puisque les chercheurs ont observé une souffrance hépatique accrue chez les souris il-22-/- ainsi qu’une augmentation du stress du réticulum dans leur foie. |
L’IL-22 est produite par les cellules lymphoïdes innées (ILC) lors d’une hépatectomie partielle Kudira et al. ont cherché ensuite à déterminer la source cellulaire d’IL-22 dans le modèle d’hépatectomie partielle. Plusieurs candidats potentiels étaient sur les rangs parmi les cellules lymphoïdes : les lymphocytes gd T, les lymphocytes T helper de type Th17, les lymphocytes NKT ou encore les innate lymphoid cells (ILC), parmi lesquelles nous trouvons les ILC de type 1 et les cellules NK [4, 5]. Afin de départager ces différents candidats, Kudira et al. ont utilisé les modèles de souris invalidées pour les gènes de recombinaison rag-1 (rag 1-/-, qui n’ont ni lymphocyte T [LT] ni lymphocyte B [LB]), ou invalidées à la fois pour le gène de recombinaison rag-2 et le gène codant la chaîne commune (g) à différents récepteurs de cytokines (souris rag2-/-yc-/-, déficientes en LT, LB et ILC). Ces deux types de souris ainsi que des souris contrôles ont été soumis à une hépatectomie partielle. Après résection hépatique, la sécrétion d’IL-22 augmentait chez les souris rag 1-/- comme chez les contrôles. Cependant, cette augmentation était fortement diminuée chez les souris rag2-/- yc-/- déficientes en ILC, , suggérant donc que la source principale d’IL-22 dans ce modèle serait les ILC. L’analyse séparée des différentes sous-populations lymphocytaires hépatiques chez l’homme et le rongeur a permis d’identifier les NK et les ILC de type 1 comme les sources principales de production d’IL-22 hépatique après hépatectomie partielle. |
Quel signal inducteur de la production d’IL-22 après hépatectomie partielle ? L’IL-22 n’étant pas produite de manière constitutive, Kudira et al. ont cherché à identifier le signal environnemental inducteur de la production d’IL-22 par les ILC dans le modèle d’hépatectomie partielle. En se fondant sur leur observation précédente d’une implication de la signalisation purinergique dans les propriétés pro-régénératrices des cellules NK [3], ils ont donc exploré l’hypothèse de l’implication de ce système ligand-récepteurs dans la libération d’IL-22 après hépatectomie partielle. Outre son rôle bien connu comme molécule énergétique et comme précurseur des acides nucléiques, l’ATP est un médiateur cellulaire. Lorsqu’il est libéré dans le milieu extracellulaire, notamment après un stress, l’ATP est souvent interprété comme un signal de danger par les cellules environnantes, et joue le rôle de message activateur et chémoattracteur pour les cellules de l’immunité. Cette molécule est détectée à la surface de la membrane plasmique par des récepteurs purinergiques métabotropiques (famille des récepteurs P2Y) ou ionotropiques (famille des récepteurs P2X) [8]. Dans le foie, chaque type cellulaire exprime son propre répertoire de récepteurs purinergiques qui sont impliqués dans plusieurs processus physiologiques et physiopathologiques pouvant influencer la régénération du foie [9, 10]. L’équipe de T. Tordjmann avait déjà montré, chez l’homme et dans un modèle murin, qu’une résection hépatique provoquait une libération immédiate d’ATP dans la circulation, en réponse à l’augmentation de la pression portale et intra-hépatique [11]. Kudira et al. ont confirmé ces résultats après hépatectomie chez l’homme. Pour établir le lien entre la sécrétion d’IL-22 par les ILC et la signalisation purinergique, les auteurs ont réalisé une étude pharmacologique ex vivo et in vivo en utilisant des antagonistes relativement spécifiques de chacun des récepteurs purinergiques exprimés par les ILC. Les antagonistes de P2X1 et P2Y6 se sont avérés les plus efficaces pour réduire la synthèse d’IL-22 in vitro. Néanmoins, dans le modèle d’hépatectomie partielle chez la souris, seul l’antagoniste du récepteur P2X1 était capable d’inhiber la production d’IL-22. On pourrait conclure de cette observation que, parmi les récepteurs purinergiques, seul le récepteur P2X1 est impliqué dans le contrôle de la libération d’IL-22. Cependant, au vu des homologies de structure des récepteurs de cette famille, l’utilisation de la seule approche pharmacologique est délicate. En effet, aux concentrations (jusqu’à 100 µM) employées dans cette étude, les antagonistes utilisés sont en mesure de bloquer plusieurs types de récepteurs purinergiques exprimés à la surface des ILC. Le rôle de P2X1 dans la production/libération d’IL-22 contrôlée par l’ATP devra être confirmé dans des modèles cellulaires d’ARN interférence, ou animaux d’invalidation génique (souris P2X1-/-). L’étude de Kudira et al. [2] a permis d’élucider les liens entre deux signaux intercellulaires régulant la régénération hépatique après HP : l’IL-22 et l’ATP. Il est désormais possible de décrire un enchaînement d’évènements de signalisations débutant avec l’acte chirurgical d’hépatectomie jusqu’à l’effet biologique favorisant la régénération (Figure 1). Bien évidemment, ce n’est qu’un fil parmi l’écheveau gouvernant la régénération hépatique. L’importance de cet article repose également sur la confirmation de la libération de ces deux facteurs, l’IL-22 et l’ATP, chez l’homme. Ces observations donnent des arguments rationnels pour explorer la pertinence d’un ciblage thérapeutique des voies de signalisation en amont ou en aval de ces deux facteurs de façon à favoriser la régénération du foie.
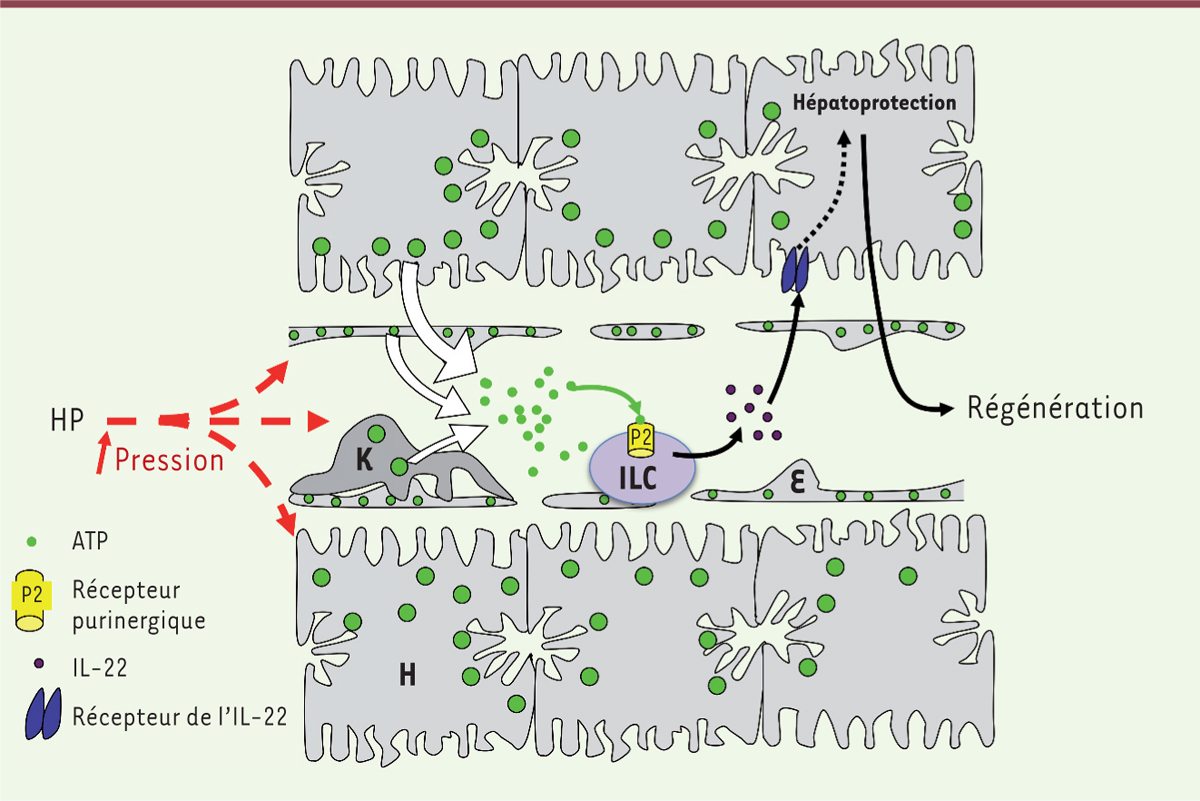
 | Figure 1.
La libération d’ATP post-hépatectomie contrôle la libération de la cytokine hépatoprotectrice IL-22 par les ILC. L’hépatectomie partielle provoque une augmentation de la pression portale et intra-hépatique suite à la résection d’une partie du lit vasculaire alors que le débit entrant reste constant. Par un mécanisme encore non identifié, cette augmentation de pression provoque la libération d’ATP dans le foie [ 2, 9]. L’ATP libéré se fixe sur un récepteur purinergique, probablement le récepteur P2X1, présent à la surface des innate lymphoid cells, stimulant ainsi la libération d’IL-22 [ 2]. En se fixant sur son récepteur à la surface des hépatocytes, cette cytokine induit l’expression de molécules antiapoptotiques (Bcl2, BclX L), favorisant ainsi le bon déroulement de la régénération hépatique [ 2, 6, 7]. K : cellule de Kupffer ; H : hépatocyte ; HP : hépatectomie partielle ; E : cellule endothéliale ; ILC : innate lymphoid cell. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Taub R. Liver regeneration: from myth to mechanism . Nat Rev Mol Cell Biol. 2004; ; 5 : :836.–847. 2.
Kudira R, Malinka T, Kohler A, et al. P2X1-regulated IL-22 secretion by innate lymphoid cells is required for efficient liver regeneration . Hepatology. 2016; ; 63 : :2004.–2017. 3.
Graubardt N, Fahrner R, Trochsler M, et al. Promotion of liver regeneration by natural killer cells in a murine model is dependent on extracellular adenosine triphosphate phosphohydrolysis . Hepatology. 2013; ; 57 : :1969.–1979. 4.
Cherrier M. Les cellules lymphoïdes innées : de nouveaux acteurs de la réponse immune mucosale . Med Sci (Paris). 2014; ; 30 : :280.–288. 5.
Yin S, Wang H, Park O, et al. Enhanced liver regeneration in IL-10–deficient mice after partial hepatectomy via stimulating inflammatory response and activating hepatocyte STAT3 . Am J Pathol. 2011; ; 178 : :1614.–1621. 6.
Dudakov JA, Hanash AM, van den Brink MR Interleukin-22: immunobiology and pathology . Annu Rev Immunol. 2015; ; 33 : :747.–785. 7.
Park O, Wang H, Weng H, et al. In vivo consequences of liver-specific interleukin-22 expression in mice: Implications for human liver disease progression . Hepatology. 2011; ; 54 : :252.–261. 8.
Schwiebert EM, Zsembery A Extracellular ATP as a signaling molecule for epithelial cells . Biochim Biophys Acta. 2003; ; 1615 : :7.–32. 9.
Burnstock G, Vaughn B, Robson SC Purinergic signalling in the liver in health and disease . Purinergic Signal. 2014; ; 10 : :51.–70. 10.
Besnard A, Gautherot J, Julien B, et al. The P2X4 purinergic receptor impacts liver regeneration after partial hepatectomy in mice through the regulation of biliary homeostasis . Hepatology. 2016; ; 64 : :941.–953. 11.
Gonzales E, Julien B, Serrière-Lanneau V, et al. ATP release after partial hepatectomy regulates liver regeneration in the rat . J Hepatol. 2010; ; 52 : :54.–62. |