| |
| Med Sci (Paris). 32(10): 861–866. doi: 10.1051/medsci/20163210019.Vers de nouvelles cibles de traitement pour l’hypertension artérielle ?
Anne-Laure Faucon,1* Anne-Marie Madjalian,1 Guillaume Bobrie,1 Laurence Amar,1 and Michel Azizi1 1Unité d’hypertension artérielle, Hôpital Européen Georges Pompidou, AP-HP, 20, rue Leblanc, 75015 ParisParis, France; Centre d’investigation clinique (CIC 1418), Hôpital Européen Georges Pompidou, AP-HP, Paris, 20, rue Leblanc, 75015ParisFrance; Université Paris-Descartes, Paris, France |

Vignette (Photo © Inserm - Bruno Villoutreix). La pression artérielle est un déterminant majeur du risque cardiovasculaire. L’hypertension artérielle (HTA) est un facteur de risque indépendant de cardiopathie ischémique, d’accident vasculaire cérébral (AVC), d’insuffisance cardiaque, d’insuffisance rénale et de démence. Si le traitement de l’hypertension artérielle permet de réduire le risque cardiovasculaire, la cible de pression artérielle à atteindre sous traitement antihypertenseur reste à l’heure actuelle encore débattue. Les études épidémiologiques observationnelles ont montré une relation linéaire entre le niveau de pression artérielle, en particulier systolique (PAS), et le risque d’événement cardiovasculaire, quel que soit l’âge, débutant à partir du seuil de 115/75 mmHg [1]. Cette relation est décalée vers le haut et sa pente est accentuée avec l’augmentation de l’âge. Ainsi, toute réduction, même faible, de la pression artérielle permet une diminution du risque de survenue d’un AVC ou d’une cardiopathie ischémique [1, 2] : « the lower is better ». La pente de la relation est aussi plus accentuée pour le risque de survenue d’un AVC que pour le risque de survenue d’un infarctus du myocarde (IDM). Si la réduction du risque d’AVC suit parfaitement la réduction de la pression artérielle, pour l’insuffisance coronaire, certains auteurs privilégient la théorie de la « courbe en J » qui s’oppose à celle de « the lower is better ». Selon la théorie de la « courbe en J », il existerait une valeur seuil de pression artérielle, en particulier diastolique (PAD), en dessous de laquelle le risque d’IDM augmenterait, puisque la perfusion myocardique se fait en diastole [3, 4]. Cette théorie est très débattue et des résultats contradictoires ont été publiés. Cependant, il s’agit d’études a posteriori, sans que l’objectif tensionnel n’ait été fixé comme critère de jugement. Ainsi, en 2009, Cooper et al. avaient montré qu’il existait une augmentation du risque de décès (quelle qu’en soit la cause) et d’événements cardio-vasculaires lorsque la PAD était inférieure à 70-80 mmHg [5]. En revanche, dans l’étude menée par Kjeldsen et al., le risque d’événements cardiovasculaires n’était pas majoré lorsque la PAD était inférieure à 70 mmHg [6]. En 2005, la méta-analyse des BP (blood pressure) trialists avait montré qu’un contrôle plus strict de la pression artérielle réduisait significativement (p = 0,03) le risque cardio-vasculaire chez tous les patients, qu’ils soient diabétiques ou non [7]. Les résultats des différentes études sont contradictoires et varient en fonction de la population étudiée. En 2010, les résultats de l’étude ACCORD (action of control cardiovascular risk in diabetes) n’avaient pas montré de différence significative chez les patients diabétiques de type II du groupe « traitement intensif » (PAS < 120 mmHg) par rapport aux patients du groupe « traitement standard » (PAS < 140 mmHg) sur le risque de survenue du critère combiné : AVC ou IDM non mortel, ou décès cardiovasculaire [8]. Une réduction significative du risque d’AVC était observée, sans augmentation du risque coronaire mais avec une augmentation significative du risque d’événements indésirables (p < 0,001) liée à l’intensité du traitement (hypotension, insuffisance rénale, dyskaliémie). L’absence de bénéfice observé dans l’étude ACCORD est-elle en rapport avec un manque de puissance (patients à faible risque cardio-vasculaire, âgés de 62 ans en moyenne, sans dyslipidémie, ni insuffisance rénale) ? Certains auteurs ont émis l’hypothèse que le diabète aurait une influence négative sur la fonction artériolaire en altérant l’autorégulation locale du flux sanguin [9]. En 2013, l’étude randomisée SPS3 (secondary prevention of small subcortical strokes) menée chez des patients ayant fait un AVC, a montré qu’il existait une diminution non significative de 19 % du risque de récidive d’AVC (p = 0,08) chez les patients dont la PAS était inférieure à 130 mmHg (versus PAS = 130-149 mmHg) [10]. En revanche, dans l’étude PROGRESS, les patients (avec antécédent d’AVC, hypertendus ou non) qui recevaient un traitement par perindopril1, (avec ou sans indapamide2) avaient une diminution significative de la morbi-mortalité cardiovasculaire et leur pression artérielle était en moyenne de 132/79 mmHg (versus 141/83 mmHg dans le groupe placebo) [11]. Enfin, en 2012, une méta-analyse incluant 37 348 patients a également montré une diminution de 11 à 24 % du risque d’événements cardiovasculaires majeurs chez les patients qui recevaient un traitement « intensif ». En revanche, aucun effet sur la mortalité cardiovasculaire n’avait été mis en évidence [12]. L’ensemble de ces résultats a conduit la Société européenne d’hypertension artérielle à réviser les cibles de PA à atteindre en 2013. Elles ont été harmonisées pour la PAS pour toutes les catégories de patients (< 140 mmHg). Une cible plus basse a été retenue pour la PAD (< 85 mmHg) uniquement pour les patients diabétiques, et maintenue inférieure à 90 mmHg pour les autres catégories de patients [13]. Ces cibles pourraient être revues à la baisse avec les résultats de l’essai multicentrique nord-américain SPRINT (systolic blood pressure intervention trial) qui a pris fin en 2015 [14]. |
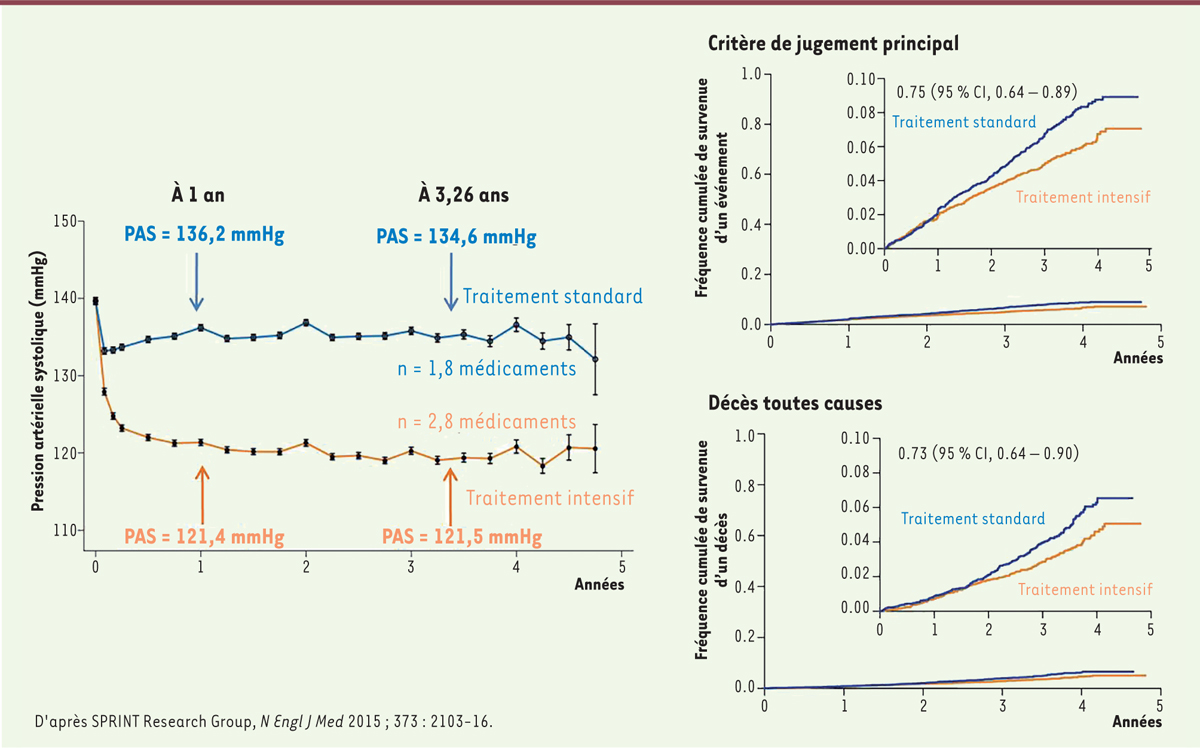
Dans cet essai randomisé, ouvert, avec analyse en insu (i.e. en aveugle) de la randomisation, 9 361 patients hypertendus (PAS clinique ≥ 130 mmHg avec 0 à 4 médicaments antihypertenseurs) de plus de 50 ans, non diabétiques et sans antécédent d’AVC, mais à haut risque cardiovasculaire (maladie cardiovasculaire clinique ou infraclinique, ou insuffisance rénale chronique [DFG, débit de filtration glomérulaire ; MDRD, modification of diet in renal disease : 20-60 ml/min/1,73m²], ou un risque cardiovasculaire à 10 ans supérieur à 15 % selon le score de Framingham3 ou un âge ≥ 75 ans) étaient randomisés soit dans le groupe « traitement standard » (PAS clinique cible < 140 mmHg) soit dans le groupe « traitement intensif » (PAS cible < 120 mmHg). Les patients qui avaient un diabète, un antécédent d’AVC, une protéinurie supérieure à 1 g/g de créatinine ou une insuffisance cardiaque (fraction d’éjection ventriculaire gauche échographique inférieure à 35 %) étaient exclus. Le critère de jugement principal était un critère composite associant la survenue d’un IDM ou d’un syndrome coronarien aigu, d’un AVC, d’une insuffisance cardiaque, ou d’un décès de cause cardiovasculaire. Un algorithme de renforcement ou d’allègement de traitement et de nombre de visites nécessaires pour atteindre les objectifs tensionnels était utilisé par les médecins. Après un an de suivi, la PAS clinique moyenne était de 121,4 mmHg dans le groupe « traitement intensif » et de 136,2 mmHg dans le groupe « traitement standard », soit 14,8 mmHg d’écart entre les deux groupes (Figure 1). L’étude a été arrêtée prématurément après un suivi médian de 3,26 ans en raison de l’apparition d’un bénéfice net chez les patients du groupe « traitement intensif ». En effet, ces patients avaient une diminution de 25 % du risque de survenue du critère composite majeur (HR = 0,75 ; IC 95 % : 0,64-0,89 ; p < 0,001 ; nombre de sujets nécessaires à traiter pour éviter un événement, NNT = 61), une diminution de 27 % du risque de décès toutes causes confondues (HR = 0,73 ; IC 95 % : 0,60 - 0,90 ; p = 0,003 ; NNT = 90) (Figure 1), une diminution significative du risque de survenue d’une insuffisance cardiaque (p = 0,002 ; NNT = 125) et de décès de cause cardiovasculaire (p = 0,005 ; NNT = 172). En revanche, aucune différence n’était observée entre les deux groupes sur le risque de survenue d’un AVC (p = 0,50) ou d’un IDM (p = 0,19) ou d’un syndrome coronarien aigu (p = 0,99). Dans le groupe « traitement intensif », il était observé une augmentation significative du risque d’insuffisance rénale (réduction de plus de 30 % du DFG ; p < 0,001 ; NNT pour induire un événement indésirable = 90) et d’hypotension artérielle (p = 0,001 ; NNT = 100), mais sans surcroît de risque de syncope.
 | Figure 1.
Pressions artérielles systoliques (PAS) dans le groupe « traitement intensif » (objectif PAS < 120 mmHg) (en orange) et dans le groupe « traitement standard » (objectif PAS < 140 mmHg) (en bleu). Le critère de jugement principal est un critère composite associant la survenue d’un infarctus du myocarde, d’un syndrome coronarien aigu, d’un AVC (accident vasculaire cérébral), d’une insufffisance cardiaque ou d’un décès de cause cardiovasculaire. 95% CI : intervalle de confiance à 95%. |
Le résultat de cet essai montrant que « the lower is better » a donné lieu à de nombreux débats [15–23], car il pourrait être à l’origine d’une modification des recommandations internationales. Il est utile de faire une analyse critique de cet essai randomisé de bonne facture qui ne pose à l’évidence aucun problème de validité interne. En revanche, sa validité externe et donc l’applicabilité des résultats est plus discutable, en particulier pour la population française de patients hypertendus qui est à plus bas risque cardiovasculaire que la population nord-américaine. Le contexte Cet essai, financé par le NIH ( National Institutes of Health) aux États-Unis, avait aussi pour objectif de réconcilier les experts nord-américains sur les cibles tensionnelles à atteindre après la publication des recommandations JNC VIII ( eighth joint national committee) [ 24] et les résultats négatifs de l’essai ACCORD-BP chez les patients diabétiques hypertendus [ 8]. Les patients La population de l’étude a été sélectionnée (patients non diabétiques, sans antécédent d’AVC, ni HTA sévère, protéinurie < 1 g/g), en bon état général. Il s’agissait plutôt d’hommes (65 %) âgés (âge moyen 68 ans ; 28 % des patients avaient plus de 75 ans), représentatifs de la population nord-américaine (50 % d’obèses, 31 % d’Afro-Américains), à haut risque cardiovasculaire (20 % d’entre eux avaient une maladie cardiovasculaire, 28 % une maladie rénale chronique et 61 % avaient un score de Framingham ≥ 15 %). Plus de 40 % des patients étaient traités par statine et plus de 50 % d’entre eux recevaient de l’aspirine. La PA clinique avant randomisation était peu élevée (139,7/78,1 mmHg), chez des patients préalablement traités par 1,8 ± 1,0 médicaments antihypertenseurs pour plus de 90 % d’entre eux. Les patients étaient donc déjà sélectionnés par la tolérabilité antérieure de leur traitement antihypertenseur initial et leur apparente bonne observance, ce qui est loin d’être le cas en pratique courante. De plus, ces caractéristiques ne justifient aucunement de démarrer un traitement antihypertenseur chez des patients dont la PAS est < 140 mmHg et qui sont naïfs de tout traitement. La mesure de PA Celle-ci a été réalisée dans des conditions non habituelles de mesure dans un cabinet médical : la PA était mesurée 3 fois à une minute d’intervalle en position assise après 5 minutes de repos par un appareil oscillométrique semi-automatique en l’absence de toute présence médicale ou paramédicale auprès du patient. Les résultats de ce type de mesure de PA s’apparentent plus aux résultats obtenus en automesure tensionnelle ou en MAPA diurne et peuvent être jusqu’à 20 mmHg plus faible que les mesures conventionnelles de PA au cabinet médical. Ainsi, il est probable que les chiffres de PAS de 140 et de 120 mmHg selon la technique employée dans l’essai correspondraient plus aux chiffres de 160 et 140 mmHg mesurés par un médecin à son cabinet de consultation. L’application des résultats de l’étude SPRINT nécessiterait l’emploi de la technique de mesure de PA décrite dans l’essai dans tous les cabinets de consultation médicale, ce qui est faisable, et même réalisé dans les consultations spécialisées des centres d’HTA ( www.centre-hypertension.org), mais semble plus difficile chez un médecin, seul dans son cabinet. Les résultats tensionnels Après un suivi médian de 3,26 ans, la PAS clinique moyenne était de 121,5 mmHg dans le groupe « traitement intensif » et de 134,6 mmHg dans le groupe « traitement standard », avec 1,8 (groupe « traitement standard ») ou 2,8 (groupe « traitement intensif ») traitements antihypertenseurs en moyenne. Le niveau tensionnel restait parfaitement stable tout au long de l’étude témoignant d’une adhérence et d’une observance parfaites des patients et des médecins au protocole de traitement, ce qui est loin d’être le cas en pratique clinique quotidienne. Les valeurs moyennes de PA obtenues indiquent que plus de 50 % des patients avaient une PAS ≥ 121,5 mmHg dans le groupe « traitement intensif » et une PAS > 134,6 mmHg dans le groupe « traitement standard ». La PA à la randomisation était de 139,7 mmHg sous 1,8 médicaments antihypertenseurs, indiquant qu’environ 50 % des patients n’étaient pas contrôlés puisqu’ayant une PAS > 140 mmHg. Ainsi dans le groupe « traitement standard », aucun effort thérapeutique majeur n’a été effectué : le nombre de médicaments antihypertenseurs est resté stable (1,8), la baisse de PAS a été minime (≈ 5,1 mmHg) et, en conséquence, environ 30-40 % des patients de ce groupe ont été maintenus avec une HTA non contrôlée. Le traitement Le choix des molécules et leur posologie étaient laissés libres au prescripteur. Il est donc difficile de différencier « l’effet pression artérielle » d’un éventuel « effet de classe thérapeutique » [ 25, 26]. Alors qu’il s’agissait de patients à haut risque cardiovasculaire qui auraient dû recevoir un traitement préventif par IEC ou ARA2 dans les deux groupes, il faut noter que 76,7 % des patients du groupe « traitement intensif » et seuls 55,2 % des patients du groupe « traitement standard » recevaient un traitement par IEC ou ARA2. Ces chiffres contrastent très fortement avec ceux de l’essai ACCORD où 90 % des patients du groupe « traitement intensif » et 80 % des patients du groupe « traitement standard » recevaient un IEC ou un ARA2 [ 8]. Par ailleurs, le traitement associé comportait dans moins de 50 % des cas, une statine ou de l’acide acétylsalicylique avant la randomisation – les données en fin d’essai n’étant pas rapportées lors de l’écriture de cet article – alors que le bénéfice de ces traitements, en particulier pour les statines, a été prouvé en matière de prévention cardiovasculaire chez des patients à haut risque [ 27– 30]. En comparaison, environ 57 % des patients recevaient une statine et environ 54 % de l’aspirine en fin d’étude dans l’essai ACCORD. Cette différence de prise en charge peut aussi participer à la différence observée entre les deux études en terme de morbidité-mortalité cardiovasculaire. Le traitement plus optimisé dans les deux bras de l’essai ACCORD et les effectifs plus faibles que dans l’essai SPRINT, réduisaient la probabilité de montrer une réduction des événements, dans une population plus jeune en moyenne (62 ans versus 68 ans dans SPRINT), avec les mêmes taux annuels d’événements dans le groupe « traitement standard » (respectivement 2,09 % versus 2,19 %). Les résultats en termes d’événements Même s’il existe une différence significative entre les deux groupes sur le critère de jugement principal, on peut se demander si l’amplitude du bénéfice observé n’est pas surestimée du fait de l’arrêt prématuré de l’étude [ 30]. Le nombre d’événements observés pendant les 3,26 ans de suivi reste modeste, quel que soit le groupe étudié (243/4678 patients du groupe « traitement intensif », et 319/4683 patients du groupe « traitement standard »), possiblement lié à la participation à l’essai en lui-même. Le résultat le plus inhabituel est l’absence de différence significative du risque de survenue d’un AVC ( n = 62 [1,3 %] dans le groupe « traitement intensif » versus n = 70 [1,5 %] dans le groupe « traitement standard » ; p = 0,50), alors même que le niveau de PA sous traitement en est un des déterminants majeurs. Le bénéfice en termes de réduction de l’incidence des AVC avait été obtenu dans l’essai ACCORD pour une différence de PAS entre les deux groupes de traitement de même amplitude (14 mmHg), dans l’essai SPRINT (14,8 mmHg). Le faible nombre d’AVC et donc un manque de puissance statistique pour cet événement, un suivi plus court dans l’essai SPRINT que dans l’essai ACCORD (3,26 ans versus 4,7 ans) et l’exclusion des patients ayant déjà fait un AVC peuvent expliquer l’absence de réduction significative du risque d’AVC malgré une différence de 14,8 mmHg de PAS entre les deux groupes. Il en est de même pour la cardiopathie ischémique, qu’il s’agisse de la survenue d’un IDM ( p = 0,19) ou d’un syndrome coronarien aigu ( p = 0,99). Il faut aussi noter que le bénéfice cardiovasculaire est principalement sous la dépendance de la réduction de l’incidence de poussées d’insuffisance cardiaque. Il s’agit d’un critère difficile à mesurer qui est très sensible à la baisse tensionnelle et à la prescription d’un traitement diurétique et/ou d’un inhibiteur du système rénine angiotensine, ce qui a été le cas dans le groupe « traitement intensif » (diurétique : 67 % ; IEC ou ARA2 : 76,7 %) par rapport au groupe « traitement standard » (diurétique : 43 % ; IEC ou ARA2 : 55,2 %). Enfin, l’amélioration du pronostic pour des pathologies non cardiovasculaires et la réduction de la mortalité toute cause dans le groupe « traitement intensif » suggère un effet bénéfique lié à une meilleure prise en charge globale des patients de ce groupe qui consultaient plus fréquemment par définition. Dans ces conditions, faire la part du bénéfice qui revient au maintien de la PAS inférieure à 120 mmHg, de la nature des traitements antihypertenseurs, ou d’une meilleure condition de prise en charge, dans un essai ouvert est difficile à apprécier, pour conclure avec certitude. Les effets indésirables Les effets indésirables (hypotension, insuffisance rénale, troubles hydro-électrolytiques, etc.) étaient significativement plus fréquents chez les patients du groupe « traitement intensif ». L’arrêt prématuré de l’étude SPRINT ne permet pas d’évaluer avec précision le risque d’hypotension orthostatique, de malaise et de syncope au long cours, en particulier chez des patients âgés. Avoir un objectif tensionnel inférieur à 120 mmHg pour la PAS doit imposer une surveillance médicale clinique et biologique, spécialisée et rapprochée en particulier chez des patients âgés polymédiqués, ainsi qu’une parfaite compréhension du patient et de son entourage sur les signes d’alerte, afin d’adapter rapidement le traitement antihypertenseur si nécessaire. Validité externe de l’étude Enfin, peut-on extrapoler aisément les résultats de l’étude SPRINT à l’ensemble de la population américaine et à la population française à moindre risque cardiovasculaire ? Probablement pas. Bress et al. ont montré que 7,6 % (16,8 millions) d’adultes américains et 16,7 % (8,2 millions) des américains hypertendus traités auraient les critères d’éligibilité de l’étude SPRINT [ 31]. Cependant, l’ambition d’un tel objectif de pression artérielle nécessite le développement d’importants moyens médicaux et paramédicaux très coûteux et difficiles à mettre en place avec les systèmes de santé actuels, qu’ils soient américains ou français. Au-delà des contraintes logistiques et financières, la population américaine reste très différente de la population française (prévalence de l’obésité, du diabète, mode de vie, régime alimentaire, etc.). Il faut à nouveau insister sur le fait que l’incidence de survenue d’effets indésirables liés à un niveau tensionnel plus bas – en particulier chez des patients âgés et polymédiqués – risque d’être plus élevée dans le monde réel en dehors de l’essai, comme rapporté à la suite de la publication de l’essai RALES [ 32]. |
En conclusion, la prise en charge des patients à haut risque cardiovasculaire doit s’inscrire dans une prise en charge thérapeutique globale. Certaines classes thérapeutiques doivent être privilégiées pour leurs propriétés protectrices cardiovasculaires et néphro-protectrices, en plus de leur effet antihypertenseur intrinsèque (inhibiteurs du système rénine-angiotensine-aldostérone). Le contrôle de la pression artérielle doit être associé à un traitement vasculo-protecteur (acide acétylsalicylique et statine), une perte de poids, une diminution de la consommation sodée, l’arrêt du tabac… Le bénéfice absolu de la baisse de la pression artérielle n’est probablement pas identique chez tous les patients [33]. Par conséquent, il n’existe sans doute pas une cible unique de pression artérielle, mais plusieurs cibles. Le rapport bénéfice/risque est donc à évaluer au cas par cas, en fonction du terrain du patient (âge physiologique, risque cardiovasculaire, etc.) et de la survenue éventuelle d’effets indésirables. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
|
MAPA
|
mesure ambulatoire de la pression artérielle |
|
IEC
|
inhibiteur de l’enzyme de conversion de l’angiotensine |
|
ARA 2
|
antagoniste du récepteur de l’angiotensine 2 |
|
DFG
|
débit de filtration glomérulaire |
|
Score de Framingham
|
score permettant une estimation du risque de survenue d’un événement cardio-vasculaire dans les 10 ans |
|
HR
|
hazard ratio
|
|
NNT
|
number needed to treat ; nombre de sujets nécessaires à traiter pour éviter un événement |
|
Footnotes |
1.
Lewington S, Clarke R, Qizilbash N, et al. Prospective studies collaboration. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies . Lancet. 2002; ; 360 : :1903.–1913. 2.
Law MR, Morris JK, Wald NJ. Use of blood pressure lowering drugs in the prevention of cardiovascular disease: meta-analysis of 147 randomised trials in the context of expectations from prospective epidemiological studies . Br Med J. 2009; ; 338 : :b1665.. 3.
Cruickshank JM, Thorp JM, Zacharias FJ. Benefits and potential harm of lowering high blood pressure . Lancet. 1987; ; 1 : :581.–584. 4.
Chalmers J. Is a blood pressure target of < 130/80 mmHg still appropriate for high-risk patients? Circulation. 2011; ; 124 : :1700.–1702. 5.
Cooper-DeHoff RM, Handberg EM, Mancia G, et al. INVEST revisited: review of findings from the international verapamil SR-trandolapril study . Expert Rev Cardiovasc Ther. 2009; ; 7 : :1329.–1340. 6.
Kjeldsen SE, Berge E, Bangalore S, et al. No evidence for a J-shaped curve in treated hypertensive patients with increased cardiovascular risk: The VALUE trial . Blood Press. 2015 ; :1.–10. 7.
Turnbull F, Neal B, Algert C, et al. Blood pressure lowering treatment trialists’ collaboration. Effects of different blood pressure-lowering regimens on major cardiovascular events in individuals with and without diabetes mellitus: results of prospectively designed overviews of randomized trials . Arch Intern Med. 2005; ; 165 : :1410.–1419. 8.
ACCORD Study Group . Effects of intensive blood-pressure control in type 2 diabetes mellitus . N Engl J Med. 2010; ; 362 : :1575.–1585. 9.
Mancia G. Effects of intensive blood pressure control in the management of patients with type 2 diabetes mellitus in the action to control cardiovascular risk in diabetes (ACCORD) trial . Circulation. 2010; ; 122 : :847.–849. 10.
SPS3 Study Group . Blood-pressure targets in patients with recent lacunar stroke: the SPS3 randomised trial . Lancet. 2013; ; 382 : :507.–515. 11.
PROGRESS Collaborative Group . Randomised trial of a perindopril-based blood-pressure-lowering regimen among 6,105 individuals with previous stroke or transient ischaemic attack . Lancet. 2001; ; 358 : :1033.–1041. 12.
Lv J, Neal B, Ehteshami P, et al. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: a systematic review and meta-analysis . PLoS Med. 2012; ; 9 : :e1001293.. 13.
2013 ESH-ESC guidelines for the management of arterial hypertension . J Hypertens. 2013; ; 31 : :1281.–1357. 14.
SPRINT Research Group . A randomized trial of intensive versus standard blood-pressure control . N Engl J Med. 2015; ; 373 : :2103.–2116. 15.
MacMahon S, Neal B, Rodgers A. Hypertension: time to move on . Lancet. 2005; ; 365 : :1108.–1109. 16.
Chobanian AV. Time to reassess blood-pressure goals . N Engl J Med. 2015; ; 373 : :2093.–2095. 17.
Drazen JM, Morrissey S, Campion EW, et al. A SPRINT to the finish . N Engl J Med. 2015; ; 373 : :2174.–2175. 18.
Perkovic V, Rodgers A. Redefining blood-pressure targets–SPRINT starts the marathon . N Engl J Med. 2015; ; 373 : :2175.–2178. 19.
Jones DW, Weatherly L, Hall JE. SPRINT: What remains unanswered and where do we go from here? Hypertension. 2016; ; 67 : :261.–262. 20.
Cushman WC, Whelton PK, Fine LJ, et al. SPRINT Trial results: Latest news in hypertension management . Hypertension. 2016; ; 67 : :263.–265. 21.
Esler M. SPRINT, or false start, toward a lower universal treated blood pressure target in hypertension . Hypertension. 2016; ; 67 : :266.–267. 22.
Touyz RM, Dominiczak AF. Successes of SPRINT, but still some hurdles to cross . Hypertension. 2016; ; 67 : :268.–269. 23.
Kjeldsen SE, Oparil S, Narkiewicz K, et al. The J-curve phenomenon revisited again: SPRINT outcomes favor target systolic blood pressure below 120 mmHg . Blood Press. 2016; ; 25 : :1.–3. 24.
James PA, Oparil S, Carter BL, et al. 2014 evidence-based guideline for the management of high blood pressure in adults: report from the panel members appointed to the Eighth Joint National Committee (JNC 8) . JAMA. 2014; ; 311 : :507.–520. 25.
Yusuf S, Sleight P, Pogue J, et al. The heart outcomes prevention evaluation (HOPE) study investigators. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients . N Engl J Med. 2000; ; 342 : :145.–153. 26.
Brugts JJ, Ninomiya T, Boersma E, et al. The consistency of the treatment effect of an ACE-inhibitor based treatment regimen in patients with vascular disease or high risk of vascular disease: a combined analysis of individual data of ADVANCE, EUROPA, and PROGRESS trials . Eur Heart J. 2009; ; 30 : :1385.–1394. 27.
Sever PS, Dahlöf B, Poulter NR, et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian cardiac outcomes trial: lipid lowering arm (ASCOT-LLA): a multicenter randomised controlled trial . Lancet. 2003; ; 361 : :1149.–1158. 28.
Amarenco P, Bogousslavsky J, Callahan A, 3rd, et al. Stroke prevention by aggressive reduction in cholesterol levels (SPARCL) investigators. High-dose atorvastatin after stroke or transient ischemic attack . N Engl J Med. 2006; ; 355 : :549.–559. 29.
Hansson L, Zanchetti A, Carruthers SG, et al. Effects of intensive blood-pressure lowering and low-dose aspirin in patients with hypertension: principal results of the hypertension optimal treatment (HOT) randomised trial . HOT Study Group. Lancet. 1998; ; 351 : :1755.–1762. 30.
Bassler D, Briel M, Montori VM, et al. Stopping randomized trials early for benefit and estimation of treatment effects: systematic review and meta-regression analysis . JAMA. 2010; ; 303 : :1180.–1187. 31.
Bress AP, Tanner RM, Hess R, et al. Generalizability of SPRINT results to the U.S. adult population . J Am Coll Cardiol. 2016; ; 67 : :463.–472. 32.
Pitt B, Zannad F, Remme WJ, et al. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. Randomized aldactone evaluation study investigators . N Engl J Med. 1999; ; 341 : :709.–717. 33.
Collins R, Peto R, MacMahon SW, et al. Blood pressure, stroke, and coronary heart disease. Part 2 . Lancet. 1990; ; 335 : :827.–838. |