| |
| Med Sci (Paris). 32(11): 933–936. doi: 10.1051/medsci/20163211007.CARD9 et colite : un pont entre dysbiose et immunité Bruno Lamas,1,2,3,4,5,6 Mathias L. Richard,5,6 and Harry Sokol1,2,3,4,5,6,7* 1Sorbonne Université-université P. et M. Curie (UPMC), Paris, France 2Inserm, ERL 1157, Avenir team Gut Microbiota and Immunity, Paris, France 3CNRS, UMR 7203, Paris, France 4Laboratoire de BioMolécules, CHU Saint-Antoine27, rue de Chaligny, Paris, France 5Micalis Institute, INRA, AgroParisTech, université Paris-Saclay, 78350Jouy-en-Josas, France 6Inflammation-Immunopathology-Biotherapy Department (DHU i2B), Paris, France 7Département de gastroentérologie, hôpital Saint-Antoine, Assistance Publique-Hôpitaux de Paris, université P. et M. Curie (UPMC), 184, rue du faubourg Saint-Antoine, 75571Paris, France MeSH keywords: Adulte, Animaux, Translocateur nucléaire du récepteur des hydrocarbures aromatiques, Protéines adaptatrices de signalisation CARD, Colite, Cytokines, Susceptibilité à une maladie, Microbiome gastro-intestinal, Humains, Inflammation, Ligands, Souris, Souris de lignée C57BL, Souris knockout, Jeune adulte, métabolisme, génétique, physiologie, microbiologie, rééducation et réadaptation |
Les maladies inflammatoires chroniques de l’intestin (MICI) Les MICI regroupent la maladie de Crohn (MC) et la rectocolite hémorragique (RCH). Elles se caractérisent par une inflammation pathologique du tube digestif. Dans la MC, l’inflammation affecte tout le tractus digestif alors que seuls le rectum et le côlon sont touchés dans la RCH. Ces maladies évoluent par poussées inflammatoires de durée et de fréquence variables selon les patients. Les MICI touchent le plus souvent des sujets jeunes âgés de 20 à 30 ans. Ce sont des pathologies qui touchent de plus en plus de personnes dans les pays industrialisés et qui dégradent très fortement et à long terme la qualité de vie des patients. Il n’existe pas de traitement curatif à ce jour. La pathogénèse des MICI est inconnue mais implique une réponse immunitaire intestinale dérégulée vis-à-vis du microbiote intestinal chez des hôtes génétiquement prédisposés et sous l’influence de facteurs environnementaux [19] (→).
(→) Voir la Synthèse de O. Rahmouni et al.,page 968 de ce numéro
Le microbiote intestinal humain est un écosystème complexe composé de plus de 1011 microorganismes par gramme de fèces. Il joue un rôle crucial dans de nombreuses fonctions vitales comme la digestion, le développement du système immunitaire [20] (→), la lutte contre les organismes pathogènes [21] (→), etc. À titre d’exemple, chez la souris, les bactéries filamenteuses segmentées induisent le développement au niveau du petit intestin de cellules T helper 1 (Th1) et Th17 qui ont des effets pro-inflammatoires [1]. D’autres bactéries telles que Bacteroides fragilis [2] et Faecalibacterium prausnitzii [3, 4] ont des effets anti-inflammatoires via la production de métabolites et/ou le recrutement de cellules T régulatrices. Les bactéries intestinales et leurs métabolites sont donc essentiels dans l’équilibre de la réponse immune intestinale. Un déséquilibre du microbiote intestinal appelé dysbiose, caractérisé par une diminution de la biodiversité et le développement d’espèces bactériennes aux dépens d’autres, est observé chez les patients atteints de MICI sans que l’on sache si cela est la cause ou la conséquence de l’inflammation [5]. En association avec la dysbiose, les chercheurs suspectent également des facteurs génétiques dans la pathogénèse des MICI. Plus de 160 gènes de susceptibilité aux MICI ont été identifiés. Parmi ces gènes, on retrouve notamment le gène CARD9 [6].
(→) Voir la Synthèse de V. Gaboriau-Routhiau et N. Cerf-Bensussan, page 961 de ce numéro
(→) Voir la Nouvelle de B. Chassaing, m/s n° 4, avril 2015, page 355
|
Caspase recruitment domain 9 (CARD9) et colite La protéine CARD9 est fortement exprimée dans les cellules myéloïdes et particulièrement dans les macrophages et les cellules dendritiques. Le gène CARD9 code une protéine adaptatrice jouant un rôle central dans l’intégration de signaux provenant de récepteurs reconnaissant des motifs moléculaires. CARD9 participe ainsi à la reconnaissance des mycobactéries, des bactéries, des champignons et des virus via différents récepteurs (en particulier Mincle, TLR [toll-like receptor], NOD2 [nucleotide-binding oligomerization domain 2] – aussi appelé CARD15 – et Dectin). La signalisation via CARD9 induit notamment les voies NF-kB (nuclear factor-kappa B) et p38/JNK (c-Jun N-terminal kinase) provoquant ainsi la production de cytokines et la destruction des microorganismes détectés. CARD9 est donc une protéine clé dans la réponse immune innée contre de nombreux microorganismes dont des commensaux et des pathogènes de la flore intestinale [7, 8]. Nos travaux précédents ont montré que les souris invalidées pour le gène CARD9 (Card9
-/-) présentent une sensibilité accrue à la colite chimiquement induite par le dextran sulfate sodium (DSS), ce qui permet de mimer une MICI chez la souris1. Ces animaux ont une réponse immune anormale, avec une diminution de l’expression d’IL(interleukine)-6, IL-17, IFN-γ (interféron gamma) et IL-22 dans le côlon [9]. L’IL-22 est impliquée dans la réparation tissulaire intestinale [10]] et participe à la réponse immune contre les infections bactériennes et fongiques via l’induction de la production des peptides antimicrobiens Reg3γ (regenerating islet-derived protein 3-gamma) et Reg3β par les cellules épithéliales intestinales [11], 12]. De plus, nous avons montré récemment qu’il existe, au niveau des cellules épithéliales intestinales des souris Card9
-/-, une diminution de la prolifération et une augmentation de l’apoptose à la suite d’une colite induite par le DSS [13]]. Il a également été observé chez ces animaux une diminution de l’expression de Reg3γ et Reg3β au niveau colique et une altération du microbiote intestinal bactérien et fongique [13]]. Ces données confirment l’importance de CARD9 au niveau de l’intestin dans l’immunité, le maintien d’un microbiote normal et la résistance à l’inflammation (Figure 1).
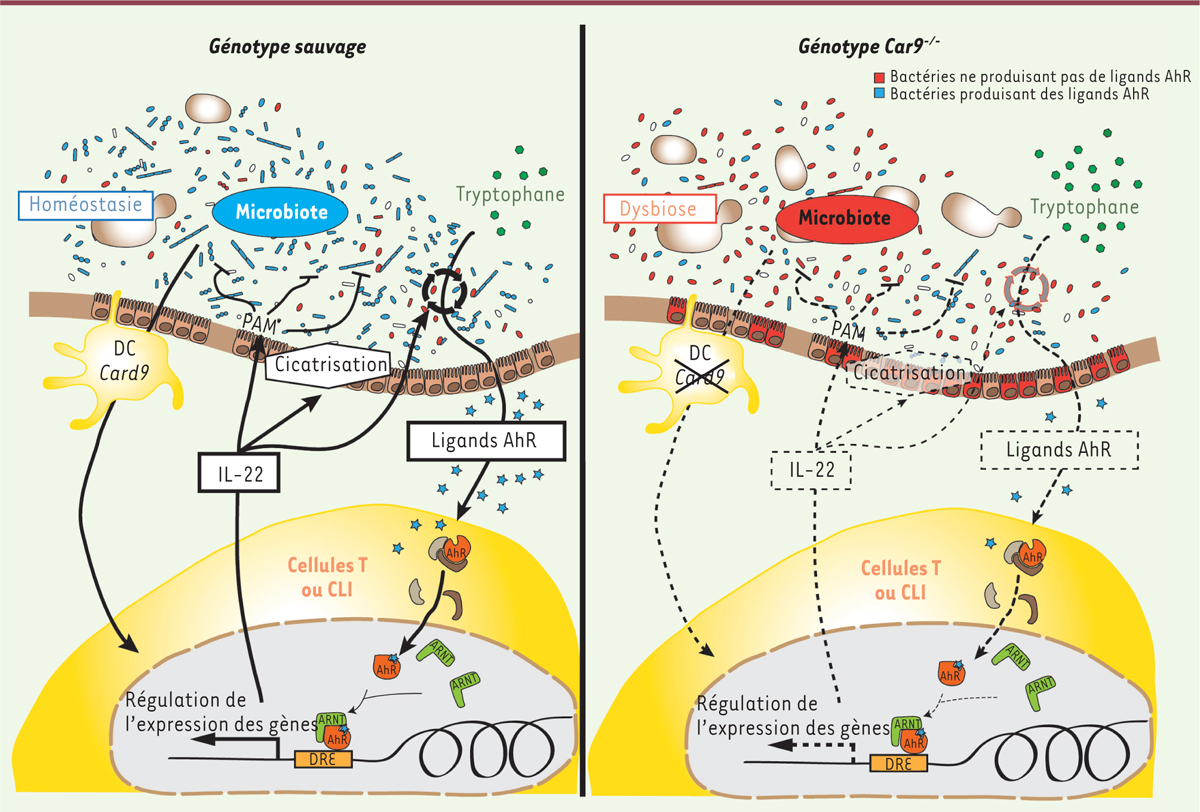
 | Figure 1.
Modèle suggérant le rôle de CARD9 dans l’interaction hôte-microbiote. La déplétion de CARD9 a des effets délétères sur le microbiote intestinal bactérien et fongique et le microbiote des souris Card9
-/- est incapable d’induire la production d’IL(interleukine)-22 par les cellules T et les CLI (cellules lymphoïdes innées) dans le côlon. Ce défaut est dû à l’incapacité du microbiote des souris Card9-/- à métaboliser le tryptophane en ligands reconnus par le récepteur aryl-hydrocarbone (AhR), ce qui provoque une diminution de son activation modulant la production d’IL-22. Le défaut d’IL-22 amplifie également la dysbiose dans un cercle vicieux induisant la perte de l’homéostasie intestinale. PAM : peptides antimicrobiens ; DC : cellules dendritiques ; DRE : dioxin response element; ARNT : aryl hydrocarbon receptor nuclear translocator protein. |
|
Est-ce que le microbiote intestinal des souris Card9-/- à lui seul est responsable de cette hypersensibilité à l’inflammation ? Afin de répondre à cette question, nous avons colonisé des souris axéniques2, (Ax) sauvages (WT, wild type) avec le microbiote de souris WT (MWT➔Ax) ou de souris Card9-/- (MCard9-/- ➔Ax ). Nous avons ensuite induit une colite au DSS. Le transfert du microbiote d’une souris Card9-/- dans une souris WT est suffisant pour reproduire le phénotype observé chez les souris Card9-/-. En effet, nous avons retrouvé une susceptibilité accrue à la colite, une diminution de la prolifération et une augmentation de l’apoptose des cellules épithéliales intestinales chez les souris MCard9-/- ➔Ax. L’analyse transcriptomique du côlon a également montré une diminution de l’expression d’IL-22, de Reg3γ et de Reg3β chez ces souris MCard9-/- ➔Ax. Une réduction de la production d’IL-22 au niveau du côlon et des ganglions lymphatiques mésentériques de ces mêmes souris a aussi été observée [13]]. Différentes sources d’IL-22 ont été décrites au niveau intestinal dont les cellules lymphoïdes innées (CLI, en anglais innate lymphoid cells, ILC), les cellules NK (natural killer), les lymphocytes Th17, les lymphocytes Th22, les cellules Tγδ et les inducteurs du tissu lymphoïde (iTL) [11], 14]. Un marquage et des analyses de ces différentes cellules par cytométrie en flux nous ont permis de montrer que le microbiote des souris Card9-/- est incapable d’induire la production d’IL-22 par les cellules T et les CLI du côlon, ce qui provoque une susceptibilité accrue à la colite [13]]. |
Le métabolisme du tryptophane est altéré chez les souris M Card9-/- ➔ Ax Des études suggèrent que les catabolites du tryptophane générés par le microbiote intestinal ont un rôle dans la réponse immune mucosale via le récepteur aryl-hydrocarbone (AhR) en modulant la production d’IL-22 [17], 18]. AhR est un récepteur intracellulaire qui, par sa fonction de régulateur transcriptionnel, agit sur de nombreux gènes impliqués dans la détoxification, le développement ou la modulation du système immunitaire [17]]. Le tryptophane peut être métabolisé soit par les bactéries intestinales en dérivés indoles, comme l’indole-3-acétique acide (IAA), soit par les cellules hôtes en kynurénine3 [15], 18]. Les dérivés indoles sont des ligands d’AhR connus pour induire une production locale d’IL-22 par les cellules immunitaires [18]]. Afin de déterminer si la modulation de l’activation d’AhR par le microbiote intestinal est à l’origine de la diminution de la production d’IL-22 dans notre modèle, nous avons mesuré la concentration de ligands d’AhR dans les fèces de nos animaux. Nous avons pu observer une activation notablement plus faible d’AhR (et moins de ligands IAA) dans les fèces des souris MCard9-/- ➔Ax et Card9-/- par rapport aux souris MWT ➔Ax et WT. L’analyse du microbiote bactérien des souris WT a permis d’identifier plusieurs souches produisant de fortes quantités de ligands d’AhR dont notamment 3 souches de Lactobacillus (L. murinus, L. reuteri et L. taiwanensis). Chez les souris MCard9-/- ➔Ax, le traitement avec un agoniste d’AhR, ou l’inoculation avec les 3 souches de Lactobacillus productrices d’agonistes du récepteur, diminue la sévérité de la colite, restaure la production d’IL-22 et améliore ainsi l’homéostasie intestinale [13]]. L’ensemble de ces résultats montrent un défaut du métabolisme du tryptophane par le microbiote intestinal des souris Card9-/- qui induit une diminution de l’activation d’AhR et contribue ainsi à la susceptibilité vis-à-vis de la colite en altérant la production d’IL-22 (Figure 1). |
Diminution de l’activité AhR et des métabolites du tryptophane chez les patients atteint de MICI Afin de déterminer si nos résultats étaient pertinents chez l’homme, nous avons analysé l’activité AhR de fèces issus de volontaires sains et de patients atteints de MICI. Une diminution de l’activité AhR associée avec une réduction des concentrations de tryptophane a été observée dans les fèces des patients atteints de MICI. Ces résultats montrent que le métabolisme du tryptophane par le microbiote des patients atteints de MICI est altéré et induit un défaut de l’activation d’AhR. Un génotypage pour différents polymorphismes associés aux MICI dont CARD9 à été effectué sur les patients et montre que les porteurs du polymorphisme de CARD9 qui est associé aux MICI (rs10781499) ont une réduction encore plus forte de l’activité AhR. Aucune association n’a été observée pour les autres polymorphismes associés aux MICI tels que ceux de NOD2 [13]]. Ces résultats suggèrent une connexion entre MICI, CARD9 et la capacité du microbiote à produire des agonistes AhR chez l’homme. Corriger le défaut de production de métabolites du tryptophane par le microbiote intestinal via des dérivés indoles ou des probiotiques de nouvelle génération produisant des agonistes AhR pourrait devenir une nouvelle thérapie contre les MICI. De manière plus générale, nos travaux montrent qu’un défaut d’un facteur impliqué dans l’immunité innée, tel que CARD9, peut induire une altération du microbiote qui, à son tour, modifie la réponse immune de l’hôte et amplifie la dysbiose dans un cercle vicieux conduisant à la perte de l’homéostasie intestinale. Les facteurs génétiques de l’hôte et le microbiote intestinal ne peuvent être dissociés dans la pathogenèse des MICI. La dysbiose ne doit donc pas être considérée comme une cause ou une conséquence des MICI, mais les deux à la fois. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Gaboriau-Routhiau V, Rakotobe S, Lécuyer E, et al. The key role of segmented filamentous bacteria in the coordinated maturation of gut helper T cell responses . Immunity. 2009; ; 31 : :677.–689. 2.
Round JL, Mazmanian SK. Inducible Foxp3+ regulatory T-cell development by a commensal bacterium of the intestinal microbiota . Proc Natl Acad Sci USA. 2010; ; 107 : :12204.–12209. 3.
Sokol H, Seksik P, Furet JP, et al. Low counts of Faecalibacterium prausnitzii in colitis microbiota . Inflamm Bowel Dis. 2009; ; 15 : :1183.–1189. 4.
Sokol H, Pigneur B, Watterlot L, et al. Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients . Proc Natl Acad Sci USA. 2008; ; 105 : :16731.–16736. 5.
Sokol H, Leducq V, Aschard H, et al. Fungal microbiota dysbiosis in IBD . Gut. 2016 ; Feb 3. pii: gutjnl-2015-310746. doi: 10.1136/gutjnl-2015-310746. 6.
Liu TCC, Stappenbeck TS. Genetics and pathogenesis of inflammatory bowel disease . Annu Rev Pathol. 2016; ; 11 : :127.–148. 7.
Lanternier F, Mahdaviani SA, Barbati E, et al. Inherited CARD9 deficiency in otherwise healthy children and adults with Candida species-induced meningoencephalitis, colitis, or both . J Allergy Clin Immunol. 2015; ; 135 : :1558.–1568.e2. 8.
Hsu YMSM, Zhang Y, You Y, et al. The adaptor protein CARD9 is required for innate immune responses to intracellular pathogens . Nat Immunol. 2007; ; 8 : :198.–205. 9.
Sokol H, Conway KL, Zhang M, et al. Card9 mediates intestinal epithelial cell restitution, T-helper 17 responses, and control of bacterial infection in mice . Gastroenterology. 2013; ; 145 : :591.–601.e3. 10.
Pickert G, Neufert C, Leppkes M, et al. STAT3 links IL-22 signaling in intestinal epithelial cells to mucosal wound healing . J Exp Med. 2009; ; 206 : :1465.–1472. 11.
Sonnenberg GF, Fouser LA, Artis D. Border patrol: regulation of immunity, inflammation and tissue homeostasis at barrier surfaces by IL-22 . Nat Immunol. 2011; ; 12 : :383.–390. 12.
Stelter C, Käppeli R, König C, et al. Salmonella-induced mucosal lectin RegIIIβ kills competing gut microbiota . PLoS One. 2011; ; 6 : :e20749.. 13.
Lamas B, Richard ML, Leducq V, et al. CARD9 impacts colitis by altering gut microbiota metabolism of tryptophan into aryl hydrocarbon receptor ligands . Nat Med. 2016; ; 22 : :598.–605. 14.
Spits H, Artis D, Colonna M, et al. Innate lymphoid cells: a proposal for uniform nomenclature . Nat Rev Immunol. 2013; ; 13 : :145.–149. 15.
Zelante T, Iannitti RG, Cunha C, et al. Tryptophan catabolites from microbiota engage aryl hydrocarbon receptor and balance mucosal reactivity via interleukin-22 . Immunity. 2013; ; 39 : :372.–385. 16.
Rutz S, Eidenschenk C, Ouyang W. IL-22, not simply a Th17 cytokine . Immunol Rev. 2013; ; 252 : :116.–132. 17.
Stockinger B, Di Meglio P, Gialitakis M, et al. The aryl hydrocarbon receptor: multitasking in the immune system . Annu Rev Immunol. 2014; ; 32 : :403.–432. 18.
Jin UHH, Lee SOO, Sridharan G, et al. Microbiome-derived tryptophan metabolites and their aryl hydrocarbon receptor-dependent agonist and antagonist activities . Mol Pharmacol. 2014; ; 85 : :777.–788. 19.
Rahmouni O, Dubuquoy L, Desreumaux P, Neut C. Microbiote intestinal et développement des maladies inflammatoires chroniques de l’intestin . Med Sci (Paris). 2016; ; 32 : :968.–973. 20.
Gaboriau-Routhiau V, Cerf-Bensussan N. Microbiote intestinal et développement du système immunitaire . Med Sci (Paris). 2016; ; 32 : :961.–967. 21.
Le Chassaing B. microbiote intestinal, un acteur de la réponse immunitaire adaptative antivirale ? . Med Sci (Paris). 2015; ; 31 : :355.–357. |