| |
| Med Sci (Paris). 32(11): 961–967. doi: 10.1051/medsci/20163211011.Microbiote intestinal et développement du système immunitaire Valérie Gaboriau-Routhiau1,2,3* and Nadine Cerf-Bensussan1,2** 1Inserm, U1163, Laboratoire d’immunité intestinale, Paris, France 2Université Paris Descartes-Sorbonne Paris Cité, et Institut IMAGINE, 24, boulevard du Montparnasse, 75015Paris, France 3Institut MICALIS, INRA, AgroParisTech, Université Paris-Saclay, 78350Jouy-en-Josas, France |
Environ 97 % de la masse vivante sur notre planète sont représentés par des microorganismes qui colonisent tous les environnements accessibles sur terre. Le tractus digestif des eucaryotes représente l’un des écosystèmes le plus densément peuplé avec, chez les mammifères et notamment chez l’homme, des densités bactériennes pouvant atteindre respectivement 108 à 1012 bactéries/ml dans l’iléon terminal et le côlon. Chez l’homme, le microbiote résident est composé de plus de 1 000 espèces, majoritairement non cultivables, appartenant principalement à deux grandes familles, les Firmicutes et les Bacteroidetes [1]. Au cours de leur longue coévolution, bactéries commensales et hôtes ont développé des interactions mutualistes, notamment fondées sur des échanges de nutriments et de métabolites, qui bénéficient à chacun des partenaires [2]. De multiples mécanismes de défense et de régulation se sont aussi mis en place pour assurer le confinement des bactéries dans la lumière intestinale, maintenir l’homéostasie intestinale, et permettre la coexistence des deux partenaires. Certains de ces mécanismes sont fonctionnels dès la naissance. Néanmoins, le dialogue entre hôtes et bactéries, initié lors de la colonisation intestinale à la naissance, est indispensable à la maturation de la barrière immune intestinale et à son maintien tout au long de la vie. Dans cette revue, nous discuterons les interactions entre bactéries et système immunitaire intestinal et illustrerons brièvement le rôle privilégié d’une bactérie singulière, la bactérie segmentée filamenteuse. |
L’épithélium intestinal, premier rempart contre les bactéries intestinales Les cellules épithéliales intestinales sont au cœur du dispositif de protection de l’hôte vis-à-vis du microbiote. Ces cellules forment une barrière physicochimique très efficace, facilement réparée en cas d’agression grâce à son renouvellement rapide à partir des cellules souches présentes au fond des cryptes [40] (→).
(→) Voir la Synthèse de A. Stetdman et al., page 983 de ce numéro
Dans l’iléon terminal, où la densité en bactéries augmente fortement, les cellules de Paneth présentes dans les cryptes contribuent, avec les entérocytes adjacents, à la production de peptides microbicides qui coopèrent avec le mucus sécrété par les cellules spécialisées, pour réduire les contacts entre bactéries et épithélium [3]. Dans le côlon, où la densité des bactéries est maximale, le nombre de cellules à mucus augmente considérablement, permettant la formation d’un film muqueux épais, en deux couches : une couche externe fluide, où s’accumulent les bactéries qui y puisent les substrats nécessaires à leur croissance, et une couche interne très dense et quasiment stérile, limitant les contacts directs des bactéries avec la surface épithéliale [4]. Le déclenchement spontané d’une inflammation intestinale chez des souris dont la production de mucus est compromise, souligne l’importance de ce mécanisme dans la préservation de l’homéostasie intestinale face au microbiote. Chez l’homme, des altérations des cellules de Paneth et des cellules à mucus sont respectivement mises en cause dans la pathogénie de la maladie de Crohn et de la rectocolite hémorragique [3, 4]. L’étude de souris gnotoxéniques (des souris élevées dans des conditions stériles puis colonisées par des bactéries individuelles ou des microbiotes complexes [5]) montre que la colonisation intestinale modifie la nature et la quantité du mucus, et induit la production de peptides microbicides [3]. Cette régulation dynamique de la réponse épithéliale est contrôlée par de nombreux récepteurs pour des motifs microbiens, tels que les récepteurs Toll-like et NOD (nucleotide oligomerization domain)-like qui, en activant notamment la voie NF-kB (nuclear factor-kappaB), stimulent la transcription de peptides antimicrobiens [3] mais aussi la production de chimiokines et de cytokines qui favorisent le recrutement et l’activation de phagocytes, de cellules dendritiques et de lymphocytes qui renforcent et complètent la barrière épithéliale (voir plus loin). Cette signalisation fait l’objet d’une régulation très précise [6]. En effet, l’inactivation de la voie NF-kB dans les cellules épithéliales, tout comme son activation excessive, provoquent des colites inflammatoires sévères, aggravées ou déclenchées par le microbiote. Cependant, certaines bactéries commensales, spécialement dans le côlon, produisent des facteurs solubles comme des acides gras à chaîne courte, qui freinent l’activation de la voie NF-kB dans les cellules épithéliales et évitent l’emballement des réponses inflammatoires délétères tant pour l’hôte que pour les bactéries [6]. Une réponse inflammatoire excessive peut en effet favoriser la sélection de bactéries pathogènes au détriment des bactéries commensales, réduire leur diversité ou induire des déséquilibres (dysbiose) entre espèces [7]. |
Les cellules immunes hématopoïétiques, seconde ligne de défense contre les bactéries intestinales Chez les mammifères, le tractus gastro-intestinal contient un nombre et une variété considérables de cellules immunes d’origine hématopoïétique, disséminées dans la zone sub-épithéliale (la lamina propria ou chorion), qui coopèrent avec l’épithélium pour renforcer la barrière intestinale. Phagocytes, cellules dendritiques et cellules lymphoïdes innées participent à l’immunité innée, rapidement mobilisable. Lymphocytes T et B, plus lents à mobiliser mais apportant spécificité et mémoire, sont les acteurs de l’immunité adaptative. Le recrutement et l’activation de l’ensemble de ces cellules sont très dépendants des signaux provenant du microbiote et sont étroitement régulés. Cellules immunes innées intestinales Les phagocytes Parmi les phagocytes, les macrophages CD11b +CX 3CR1 hi ( C-X3-C motif chemokine receptor 1) sont, en situation physiologique, les cellules les plus nombreuses dans le chorion [ 8]. Renouvelés en permanence à partir des monocytes sanguins, ils se différencient dans l’intestin où ils acquièrent une activité très efficace de phagocytose tout en devenant producteurs d’IL-10 (interleukine 10). Cette cytokine anti-inflammatoire, clé dans le maintien de l’homéostasie intestinale [ 9, 10], contribue à leur propre conditionnement et les rend tolérants aux signaux pro-inflammatoires induits par les motifs bactériens [ 8]. Ces macrophages peuvent ainsi éliminer les bactéries qui franchissent l’épithélium sans provoquer de réponse inflammatoire délétère. Néanmoins, en cas d’infection, des monocytes sanguins non conditionnés, capables de produire de grandes quantités de cytokines inflammatoires (TNFα [ tumor necrosis factor alpha] et IL-1β) en réponse aux signaux microbiens, sont recrutés localement pour participer à l’élimination des bactéries potentiellement pathogènes [ 8]. En complément, les éosinophiles sont nombreux même dans l’intestin normal où leur rôle reste mal compris. Une étude récente suggère qu’ils favorisent les réponses immunes adaptatives, notamment la production d’immunoglobulines (Ig)A, et participent au contrôle du microbiote [11]. Les neutrophiles, eux, sont normalement peu nombreux mais, recrutés de façon massive au cours des colites infectieuses, ils participent à l’élimination de bactéries qui auraient pénétré dans le chorion ainsi qu’à la protection de l’épithélium, notamment grâce à la sécrétion d’IL-22 [12]. Cependant, la gravité des lésions épithéliales induites en cas d’afflux massif de polynucléaires éosinophiles ou neutrophiles souligne la nécessité d’une régulation stricte de leur recrutement. Les cellules lymphoïdes innées Les cellules lymphoïdes innées ( innate lymphoid cells, ILC) [ 41] ( →) représentent seulement 1 à 2 % des cellules hématopoïétiques dans l’intestin mais elles y jouent un rôle important lié à leur capacité à initier et orienter les réponses immunes intestinales [ 13]. Contrairement aux lymphocytes T et B, elles n’ont pas de récepteur de reconnaissance des antigènes et leur activation est induite par des cytokines produites par l’épithélium ou les cellules dendritiques en réponse aux modifications de l’environnement. Parmi les ILC, les ILC de type 3 (ILC3), caractérisées par l’expression du facteur nucléaire RORγt ( retinoid acid–related orphan receptor γ t) 1,, ont une place à part dans les interactions avec le microbiote [ 13]. Leur production de lymphotoxine 2, dans la période périnatale est indispensable à la formation des tissus lymphoïdes où s’initieront les réponses immunes adaptives (voir ci-après). À travers la sécrétion d’IL-22, les ILC3 stimulent la production de mucus et de peptides antimicrobiens par l’épithélium, mais aussi sa réparation. De plus, cette production d’IL-22 est contrôlée par une cytokine, l’IL-23, produite par les cellules dendritiques en réponse aux signaux bactériens et par l’épithélium colique, en cas d’agression [ 13]. Réciproquement, les ILC3 favorisent la différenciation des cellules dendritiques intestinales [ 14]. Enfin, les ILC3 expriment des molécules du complexe majeur d’histocompatiblité de classe II et peuvent, comme les cellules dendritiques, présenter des antigènes aux lymphocytes T CD4 + et les activer. Cependant, cette présentation qui s’effectue en l’absence des molécules de costimulation, limite les réponses T pro-inflammatoires dirigées contre le microbiote [ 15]. Ainsi, par leurs multiples fonctions, les ILC3 jouent un rôle important dans la construction et la régulation de la barrière immune intestinale. Néanmoins, un contrôle de leur activité par l’IL-25 produite par l’épithélium en réponse au microbiote est nécessaire pour éviter leur activation excessive, leur production d’interféron (IFN) γ et d’IL-17 pro-inflammatoires, et le développement d’une inflammation pathologique [ 16].
(→) Voir la Synthèse de M. Cherrier, m/s n° 3, mars 2014, page 280
Les cellules dendritiques Les cellules dendritiques intestinales sont indispensables à la génération des réponses immunes adaptives. En effet, contrairement aux macrophages qui restent dans la muqueuse, les cellules dendritiques peuvent migrer via le réseau lymphatique vers les ganglions mésentériques, recruter des lymphocytes naïfs, les activer et induire des récepteurs de « homing » permettant leur domiciliation dans l’intestin [ 17]. Chez la souris, les cellules dendritiques dérivent d’un précurseur médullaire commun et se caractérisent par l’expression des intégrines CD103 et CD11c [ 17]. Une sous-population de cellules CD11c +CD103 +CD11b - (n’exprimant pas l’intégrine CD11b, ou αM) semble prédominer dans les plaques de Peyer, site clé des réponses immunes induites par le microbiote (voir ci-après), et pourrait favoriser, grâce à la production d’acide rétinoïque, la génération de lymphocytes T régulateurs. Au contraire, une sous-population exprimant l’intégrine CD11b, CD103 +CD11b +, favoriserait plutôt la génération de réponses T pro-inflammatoires. Cependant, la plasticité des cellules dendritiques leur permet probablement d’adapter leur fonction aux signaux reçus dans le microenvironnement intestinal, notamment via le microbiote [ 17]. Cellules immunes adaptatives intestinales La maturation finale du système immunitaire intestinal, caractérisée notamment par le peuplement de la muqueuse en lymphocytes mâtures effecteurs, T et plasmocytes à IgA, est induite dans la période postnatale sous l’influence des antigènes intraluminaux et particulièrement des bactéries du microbiote [ 18]. Les plaques de Peyer (PP) et, dans une moindre mesure, les follicules lymphoïdes isolés (ILF), de petites formations lymphoïdes qui se développent après la naissance en réponse aux signaux du microbiote [ 19, 20], sont les sites privilégiés de l’initiation des réponses immunes adaptatives. L’épithélium spécialisé des PP et des ILF, enrichi en cellules M 3, permet la transcytose de bactéries intactes qui peuvent alors être captées par les cellules dendritiques sous-jacentes et présentées aux lymphocytes T naïfs qui, au sein de ces structures lymphoïdes, activent la différenciation des lymphocytes B en cellules sécrétrices d’IgA [ 21]. Au cours de cette phase d’activation, notamment sous l’effet de l’acide rétinoïque synthétisé par les cellules dendritiques CD103 +, les lymphocytes acquièrent des récepteurs membranaires, dits de « homing », qui leur permettent, après un circuit à travers la lymphe et le sang, de finaliser leur maturation et de retourner dans la muqueuse intestinale qu’ils colonisent sur toute sa hauteur [ 21]. L’étude de souris gnotoxéniques4 montre que la colonisation par un microbiote complexe induit une forte réponse IgA et un large éventail de réponses T, à la fois pro-inflammatoires et régulatrices qui s’équilibrent, créant une inflammation dite physiologique qui renforce la barrière intestinale innée [22] (Figure 1). Les IgA induites en réponse aux bactéries sont produites dans le chorion par les plasmocytes, transportées à travers l’épithélium par le récepteur polymérique des immunoglobulines (pIgR) et libérées sous forme d’IgA sécrétoires (SIgA) dans la lumière intestinale où elles peuvent se fixer aux bactéries et favoriser leur liaison au mucus. Les SIgA complètent ainsi très efficacement les mécanismes immuns innés pour circonscrire les bactéries dans la lumière intestinale [21]. Une particularité de la réponse T intestinale induite lors de la colonisation intestinale est l’induction de lymphocytes TH17 (T helper 17) produisant de l’IL-17. Ceux-ci sont en effet totalement absents dans l’intestin des souris axéniques4 [22, 23]. Ces lymphocytes sont importants pour contenir les bactéries dans l’intestin. En effet, l’IL-17 stimule la production de peptides antimicrobiens par l’épithélium et favorise le recrutement de polynucléaires neutrophiles [24]. En outre, l’IL-17 induit l’expression du pIgR et favorise ainsi la transcytose efficace des IgA [25]. D’autres sous-populations de lymphocytes T, pro-inflammatoires ou régulateurs, recrutées en réponse à la colonisation, synthétisent elles aussi des cytokines, notamment de l’IFNγ (les lymphocytes TH1) qui favorise l’activité phagocytaire des macrophages, ou de l’IL-10 (les lymphocytes T régulateurs, caractérisés chez la souris par l’expression du facteur nucléaire Foxp3 [forkhead box P3]) qui joue un rôle clé pour éviter l’emballement des réponses pro-inflammatoires [26].
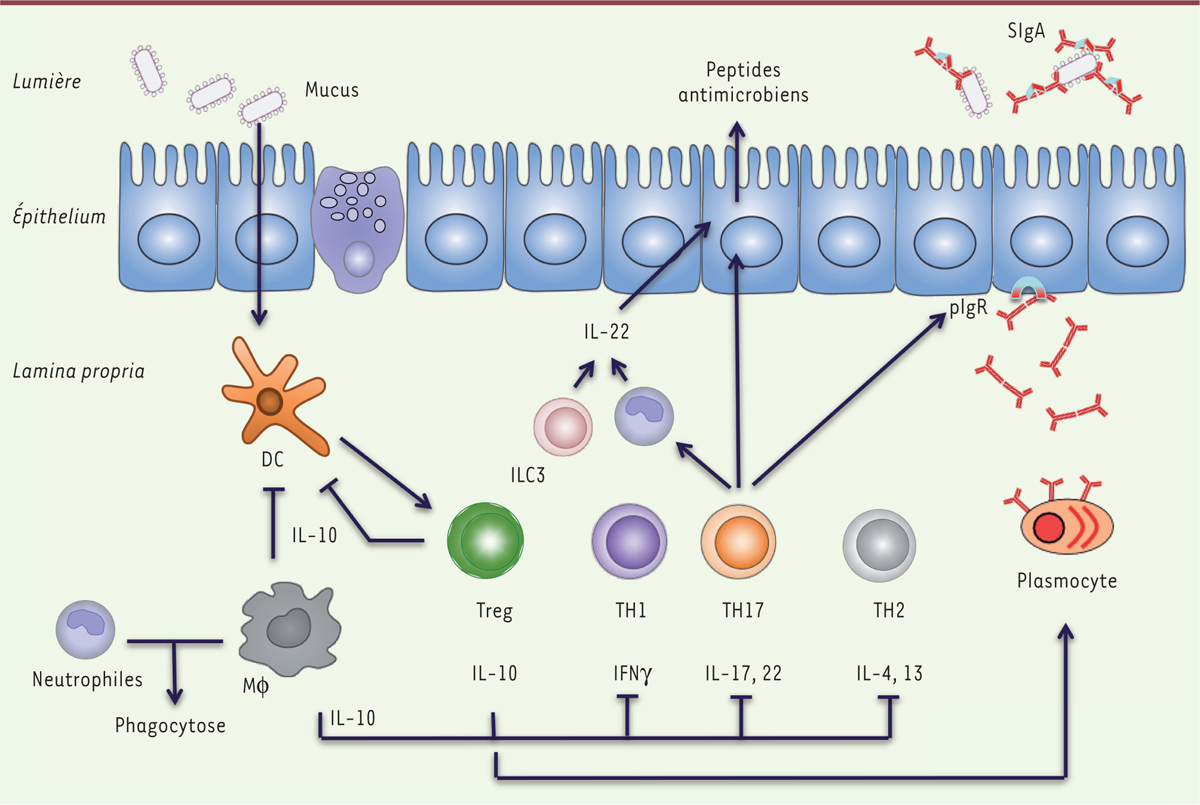
 | Figure 1.
De multiples mécanismes, induits sous l’effet de la colonisation, coopèrent pour former la barrière immune intestinale. L’épithélium intestinal produit de façon constitutive mucus et peptides antimicrobiens qui maintiennent les bactéries à distance de la surface épithéliale. Les signaux bactériens, directement captés par les cellules épithéliales via leurs récepteurs spécialisés ou transmis par l’intermédiaire des cellules dendritiques, activent les autres cellules de l’immunité innée, notamment les cellules lymphoïdes innées (ILC3) et les macrophages (Mφ), qui renforcent la production de peptides antimicrobiens et exercent leur propriété de phagocytose, respectivement. Les cellules dendritiques (DC) activées par les bactéries participent aussi au recrutement et à l’activation des cellules de l’immunité adaptative. Les plasmocytes libèrent des IgA qui, une fois fixées sur le récepteur des immunoglobulines polymériques (pIgR), sont transportées dans la lumière intestinale sous forme d’IgA sécrétoires (SIgA) où elles forment des complexes avec les bactéries, favorisant leur accrochage au mucus et leur exclusion. De plus, diverses populations de lymphocytes T CD4+ (caractérisées par les cytokines qu’elles sécrètent) sont induites simultanément, leurs fonctions s’équilibrant pour maintenir une inflammation physiologique, notamment sous contrôle des lymphocytes T régulateurs (Treg) et de l’IL(interleukine)-10. L’IL-10 et d’autres facteurs solubles produits notamment par les cellules épithéliales (TGFβ [transforming growth factors β], acide rétinoïque) contribuent à réduire l’activation des cellules dendritiques et à éviter des réponses inflammatoires excessives. Bien que potentiellement pro-inflammatoires, grâce à la production d’IL-17, les TH17 (T helper 17) participent au recrutement des neutrophiles qui, outre leur fonction de phagocytose, sont capables de produire de l’IL-22 et stimuler la barrière antimicrobienne. En cas de lésion de la barrière épithéliale, les bactéries normalement présentes dans le mucus peuvent venir au contact de la muqueuse et alors amplifier les réponses TH17 et TH1, en provoquant une inflammation pathologique. |
L’ensemble de ces données illustre la multiplicité des mécanismes mis en place pendant notre longue histoire co-évolutive avec les bactéries (Figure 1) pour construire une barrière immune intestinale dynamique et maintenir les conditions nécessaires à la coexistence des deux partenaires. |
Impact de la bactérie segmentée filamenteuse sur la stimulation des réponses immunes Comme les réponses innées qui les contrôlent, les réponses T et IgA s’ajustent en permanence à la composition et à la densité des communautés bactériennes intestinales. Elles s’intensifient en cas d’agression ou de franchissement de l’épithélium par des bactéries pathogènes. À l’inverse, elles sont profondément réduites lors d’un traitement antibiotique. L’étude de souris gnotoxéniques montre aussi que la nature et l’intensité des réponses immunes adaptatives dépendent de la composition du microbiote et particulièrement de la présence de la bactérie segmentée filamenteuse (SFB) [42] (→).
(→) Voir la Synthèse de M. Vétizou et al., page 974 de ce numéro
Contrairement à la majorité des bactéries commensales5, qui induisent une réponse IgA relativement modeste et des réponses T dominées par des réponses T régulatrices, notamment dans le côlon [18, 26–28], la SFB joue un rôle privilégié dans la maturation post-natale des réponses immunes innées et adaptatives chez son hôte [18, 22] (Figure 2). Cette bactérie, cultivable seulement récemment [29], est apparentée au genre des Clostridium [30]. Elle a été identifiée dans de nombreuses espèces, des arthropodes aux mammifères, sur la base de sa morphologie très particulière et/ou de la détection de son ARN ribosomal 16S [30]. Contrairement à la majorité des bactéries commensales qui vivent dans la lumière intestinale ou dans le mucus et restent à distance de la surface intestinale, la SFB colonise de façon élective la partie distale de l’intestin grêle en s’ancrant à la surface des cellules épithéliales des villosités et des PP [29], via un récepteur encore non identifié. Cette adhérence, généralement associée aux bactéries pathogènes, pourrait être nécessaire à la SFB pour obtenir de son hôte les nutriments indispensables à sa croissance [29]. En effet, le séquençage du génome de la SFB a montré que cette bactérie commensale possède un génome réduit, suggestif de besoins auxotrophes6, [30]. Les contacts intimes développés par la SFB avec l’épithélium semblent aussi indispensables au rôle de cette bactérie dans la stimulation du système immunitaire intestinal de son hôte [31]. Ainsi, la SFB stimule fortement les réponses innées et favorise le développement post-natal du tissu lymphoïde local, notamment les PP et les ILF [20]. Elle induit la production d’IgA et l’activation d’un éventail complet des réponses T, aussi bien pro-inflammatoires que régulatrices [18, 22, 23]. La colonisation par SFB est en particulier indispensable pour reproduire la stimulation de la réponse TH17 induite par un microbiote complexe [22, 23, 32]. De façon intéressante, les effets de la SFB sur la maturation des réponses immunes intestinales murines s’accompagnent d’un effet de barrière vis-à-vis de la colonisation par des bactéries pathogènes, non seulement dans l’intestin [30] mais aussi dans les poumons [33]. Cet effet protecteur a été attribué à l’induction de la réponse TH17 mais aussi, de façon plus indirecte, aux modifications des résidus fucosylés7 à la surface de l’épithélium, sous l’influence de l’IL-22 fortement induite par la SFB dans les ILC3 [34]. Néanmoins, les processus qui sous-tendent les effets très immunostimulants de la SFB ne sont pas entièrement élucidés. La grande sensibilité de la SFB aux mécanismes de défense de l’hôte, qu’elle contribue à induire, garantit son innocuité, sa transformation sous forme de spores lui permettant de survivre, et d’assurer sa transmission verticale [30].
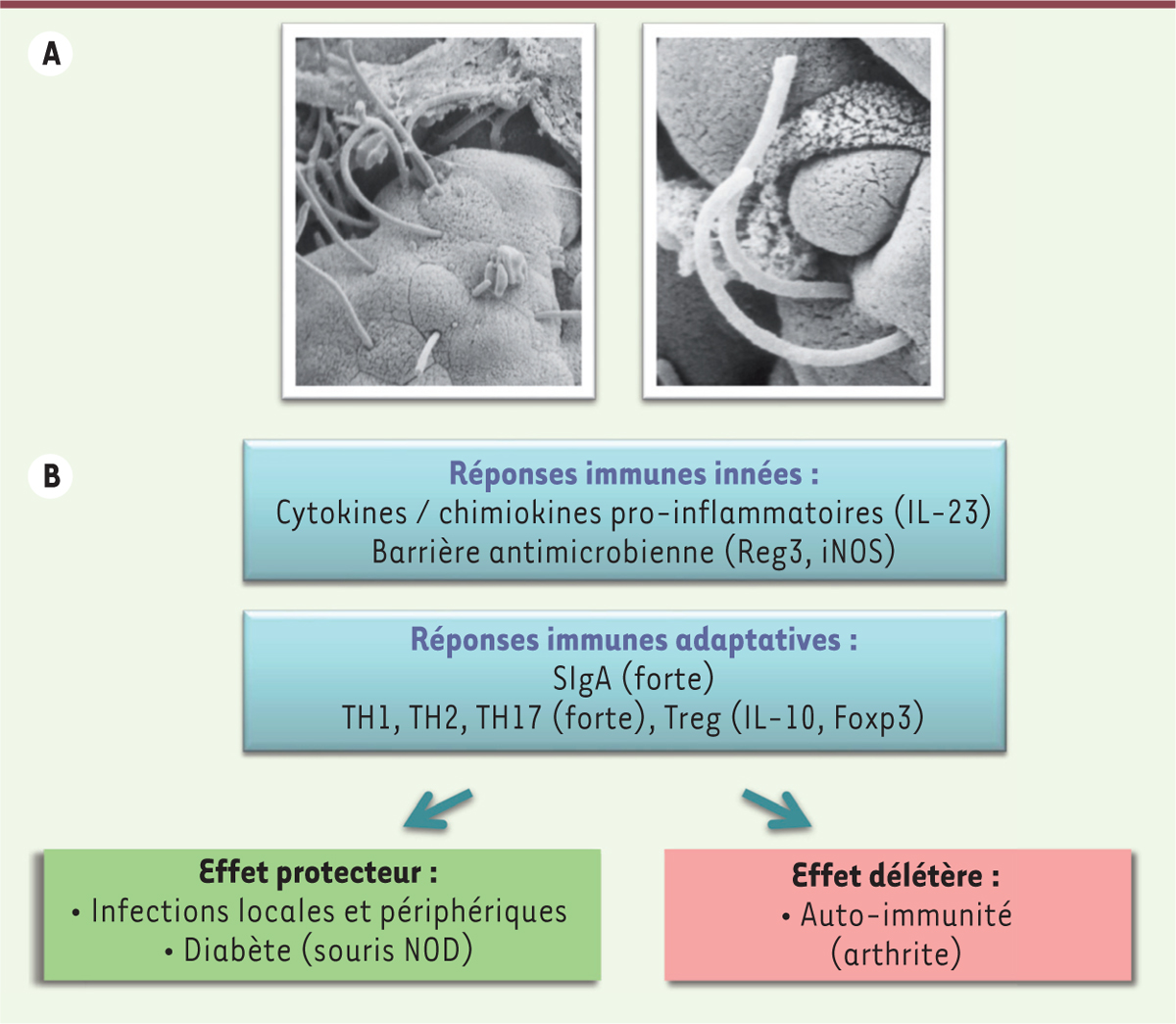
 | Figure 2.
Effets de la colonisation par SFB sur les réponses immunes. A. La bactérie segmentée filamenteuse (SFB) est une bactérie commensale identifiée dans le microbiote intestinal de nombreuses espèces, et dont la particularité est de s’ancrer à la surface des cellules épithéliales de l’iléon, sans dommage particulier pour l’hôte (image de microscopie électronique à balayage, © V. Gaboriau-Routhiau). B. Chez la souris, cette adhérence est nécessaire pour que la SFB exerce ses capacités immuno-stimulatrices puissantes, caractérisées notamment par la stimulation de la production de chimiokines et cytokines pro-inflammatoires nécessaires à l’activation des ILC3 (cellules lymphoïdes innées de type 3), comme l’IL(interleukine)-23, la synthèse de molécules participant à l’activité antimicrobienne (peptides de la famille Reg3 [antimicrobial-regenerating islet-derived lectins], enzyme inductible NO [nitric oxide] synthase-iNOS), et l’induction d’une forte réponse IgA et TH17. Celles-ci renforcent la barrière intestinale et protègent l’hôte d’infections par des bactéries pathogènes ou des parasites, mais aussi à distance de l’intestin. Cependant, la SFB peut exercer des effets délétères en favorisant le développement de pathologies auto-immunes dans des modèles d’arthrite et d’encéphalite auto-immune, impliquant notamment l’IL-17. NOD : non obese diabetic. |
Au-delà des interactions locales, le microbiote influence profondément les réponses innées et adaptatives de l’hôte en périphérie [5, 35] et semble ainsi capable de préparer le système immunitaire à répondre efficacement aux pathogènes. Les mécanismes de ces effets en périphérie sont incomplètement élucidés, mais sont principalement attribués à la diffusion vers la périphérie de facteurs solubles dérivés des bactéries et de leur métabolisme [2, 36, 37]. Une étude chez la souris montre que la SFB, notamment grâce à l’induction de la lipoprotéine sérum amyloïde A (serum amyloid A ou SAA), conditionne les cellules de moelle osseuse et la génération de cellules favorisant son rôle protecteur dans l’intestin lors d’infections parasitaires [38]. Cependant, l’effet adjuvant du microbiote sur les réponses périphériques est complexe et peut aussi avoir des conséquences sur le développement de maladies auto-immunes ou inflammatoires très dépendantes du mécanisme de la maladie [18, 30]. Ainsi, un effet protecteur est observé sur le développement du diabète de type I chez la souris NOD (non-obese diabetic) mâle. Cet effet est associé à la sélection du microbiote sous l’effet de la testostérone [30]. La présence de la SFB au sein du microbiote réduit l’incidence et la sévérité du diabète chez les souris NOD femelles, sans pour autant que l’effet, direct ou indirect, de cette bactérie ne soit identifié [30]. À l’inverse, le microbiote, et notamment la SFB, peuvent favoriser l’inflammation dans des modèles d’arthrite. Ainsi, la SFB peut exacerber la production d’auto-anticorps délétères [30, 39]. Réponse TH17 et génération de sous-populations T favorisant la stimulation des lymphocytes B sécréteurs d’anticorps ont été impliquées. Néanmoins, les mécanismes de l’effet adjuvant de la SFB et plus généralement du microbiote, à distance de l’intestin, restent à élucider. |
L’impact du microbiote sur le développement et le façonnage des réponses immunes fait aujourd’hui l’objet de travaux de plus en plus nombreux. Ceux-ci démontrent le caractère dynamique du dialogue entre l’hôte et son microbiote, et suggèrent de façon inattendue le rôle prépondérant d’un nombre limité de bactéries dans l’activation du système immunitaire, notamment dans l’intestin. Chez la souris, la bactérie type est la SFB mais son existence chez l’homme reste à démontrer formellement. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Dethlefsen L, McFall-Ngai M, Relman DA. An ecological and evolutionary perspective on human-microbe mutualism and disease . Nature. 2007; ; 449 : :811.–818. 2.
McFall-Ngai M, Hadfield MG, Bosch TC, et al. Animals in a bacterial world, a new imperative for the life sciences . Proc Natl Acad Sci USA. 2013; ; 110 : :3229.–3236. 3.
Gallo RL, Hooper LV. Epithelial antimicrobial defence of the skin and intestine . Nat Rev Immunol. 2012; ; 12 : :503.–516. 4.
Johansson ME, Sjovall H, Hansson GC. The gastrointestinal mucus system in health and disease . Nat Rev Gastroenterol Hepatol. 2013; ; 10 : :352.–361. 5.
Smith K, McCoy KD, Macpherson AJ. Use of axenic animals in studying the adaptation of mammals to their commensal intestinal microbiota . Semin Immunol. 2007; ; 19 : :59.–69. 6.
Goto Y, Kiyono H. Epithelial barrier: an interface for the cross-communication between gut flora and immune system . Immunol Rev. 2012; ; 245 : :147.–163. 7.
Stecher B. The roles of inflammation, nutrient availability and the commensal microbiota in enteric pathogen infection . Microbiol Spectrum. 2015; ; 3. doi: 10.1128/microbiolspec.MBP-0008-2014. 8.
Bain CC, Bravo-Blas A, Scott CL, et al. Constant replenishment from circulating monocytes maintains the macrophage pool in the intestine of adult mice . Nat Immunol. 2014; ; 15 : :929.–937. 9.
Li B, Alli R, Vogel P, Geiger TL. IL-10 modulates DSS-induced colitis through a macrophage-ROS-NO axis . Mucosal Immunol. 2014; ; 7 : :869.–878. 10.
Begue B, Verdier J, Rieux-Laucat F, et al. Defective IL10 signaling defining a subgroup of patients with inflammatory bowel disease . Am J Gastroenterol. 2011; ; 106 : :1544.–1555. 11.
Chu VT, Beller A, Rausch S, et al. Eosinophils promote generation and maintenance of immunoglobulin-A-expressing plasma cells and contribute to gut immune homeostasis . Immunity. 2014; ; 40 : :582.–593. 12.
Zindl CL, Lai JF, Lee YK, et al. IL-22-producing neutrophils contribute to antimicrobial defense and restitution of colonic epithelial integrity during colitis . Proc Natl Acad Sci USA. 2013; ; 110 : :12768.–12773. 13.
Sonnenberg GF, Artis D. Innate lymphoid cells in the initiation, regulation and resolution of inflammation . Nat Med. 2015; ; 21 : :698.–708. 14.
Mortha A, Chudnovskiy A, Hashimoto D, et al. Microbiota-dependent crosstalk between macrophages and ILC3 promotes intestinal homeostasis . Science. 2014; ; 343 : :1249288.. 15.
Hepworth MR, Monticelli LA, Fung TC, et al. Innate lymphoid cells regulate CD4+ T-cell responses to intestinal commensal bacteria . Nature. 2013; ; 498 : :113.–117. 16.
Sawa S, Lochner M, Satoh-Takayama N, et al. RORgammat+ innate lymphoid cells regulate intestinal homeostasis by integrating negative signals from the symbiotic microbiota . Nat Immunol. 2011; ; 12 : :320.–326. 17.
Bekiaris V, Persson EK, Agace WW. Intestinal dendritic cells in the regulation of mucosal immunity . Immunol Rev. 2014; ; 260 : :86.–101. 18.
Cerf-Bensussan N, Gaboriau-Routhiau V. The immune system and the gut microbiota: friends or foes? . Nat Rev Immunol. 2010; ; 10 : :735.–744. 19.
Bouskra D, Brezillon C, Berard M, et al. Lymphoid tissue genesis induced by commensals through NOD1 regulates intestinal homeostasis . Nature. 2008; ; 456 : :507.–510. 20.
Lecuyer E, Rakotobe S, Lengline-Garnier H, et al. Segmented filamentous bacterium uses secondary and tertiary lymphoid tissues to induce gut IgA and specific T helper 17 cell responses . Immunity. 2014; ; 40 : :608.–620. 21.
Slack E, Balmer ML, Macpherson AJ. B cells as a critical node in the microbiota-host immune system network . Immunol Rev. 2014; ; 260 : :50.–66. 22.
Gaboriau-Routhiau V, Rakotobe S, Lecuyer E, et al. The key role of segmented filamentous bacteria in the coordinated maturation of gut helper T cell responses . Immunity. 2009; ; 31 : :677.–689. 23.
Ivanov II, Atarashi K, Manel N, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria . Cell. 2009; ; 139 : :485.–498. 24.
Cypowyj S, Picard C, Maródi L, et al. Immunity to infection in IL-17-deficient mice and humans . Eur J Immunol. 2012; ; 42 : :2246.–2254. 25.
Cao AT, Yao S, Gong B, et al. Th17 cells upregulate polymeric Ig receptor and intestinal IgA and contribute to intestinal homeostasis . J Immunol. 2012; ; 189 : :4666.–4673. 26.
Geuking MB, Cahenzli J, Lawson MA, et al. Intestinal bacterial colonization induces mutualistic regulatory T cell responses . Immunity. 2011; ; 34 : :794.–806. 27.
Atarashi K, Tanoue T, Oshima K, et al. Treg induction by a rationally selected mixture of Clostridia strains from the human microbiota . Nature. 2013; ; 500 : :232.–236. 28.
Smith PM, Howitt MR, Panikov N, et al. The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis . Science. 2013; ; 341 : :569.–573. 29.
Schnupf P, Gaboriau-Routhiau V, Gros M, et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro . Nature. 2015; ; 520 : :99.–103. 30.
Schnupf P, Gaboriau-Routhiau V, Cerf-Bensussan N. Host interactions with segmented filamentous bacteria: an unusual trade-off that drives the post-natal maturation of the gut immune system . Semin Immunol. 2013; ; 25 : :342.–351. 31.
Atarashi K, Tanoue T, Ando M, et al. Th17 cell induction by adhesion of microbes to intestinal epithelial cells . Cell. 2015; ; 163 : :367.–380. 32.
Yang Y, Torchinsky MB, Gobert M, et al. Focused specificity of intestinal TH17 cells towards commensal bacterial antigens . Nature. 2014; ; 510 : :152.–156. 33.
Gauguet S, D’Ortona S, Ahnger-Pier K, et al. Intestinal microbiota of mice influences resistance to Staphylococcus aureus pneumonia . Infect Immun. 2015; ; 83 : :4003.–4014. 34.
Goto Y, Obata T, Kunisawa J, et al. Innate lymphoid cells regulate intestinal epithelial cell glycosylation . Science. 2014; ; 345 : :1254009.. 35.
Lathrop SK, Bloom SM, Rao SM, et al. Peripheral education of the immune system by colonic commensal microbiota . Nature. 2011; ; 478 : :250.–254. 36.
Macpherson AJ, Smith K. Mesenteric lymph nodes at the center of immune anatomy . J Exp Med. 2006; ; 203 : :497.–500. 37.
Arpaia N, Campbell C, Fan X, et al. Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation . Nature. 2013; ; 504 : :451.–455. 38.
Burgess SL, Buonomo E, Carey M, et al. Bone marrow dendritic cells from mice with an altered microbiota provide interleukin 17A-dependent protection against Entamoeba histolytica colitis . MBIO. 2014; ; 5 : :e01817.. 39.
Teng F, Klinger CN, Felix KM, et al. Gut microbiota drive autoimmune arthritis by promoting differentiation and migration of Peyer’s patch T follicular helper cells . Immunity. 2016; ; 44 : :875.–888. 40.
Stetdman A, Nigro G, Sansonetti P. Le dialogue microbiote-cellules souches: un élément clé pour la régénération intestinale . Med Sci (Paris). 2016; ; 32 : :983.–990. 41.
Cherrier M. Les cellules lymphoïdes innées. Med Sci (Paris). 2014; ; 30 : :280.–288. 42.
Vétizou M, Daillère R, Zitvogel L. Microbiote intestinal et réponses aux thérapies anti-tumorales . Med Sci (Paris). 2016; ; 32 : :974.–982. |