| |
| Med Sci (Paris). 32(11): 974–982. doi: 10.1051/medsci/20163211013.Microbiote intestinal et réponses aux thérapies anti-tumorales Marie Vétizou,1,2,3* Romain Daillère,1,2,3* and Laurence Zitvogel1,2,3*** 1Gustave Roussy cancer campus, 114, rue Édouard Vaillant, 94800Villejuif, France 2Université Paris-Saclay, Le Kremlin-Bicêtre, France 3Unité Inserm U1015, 94800Villejuif, France |
Les micro-organismes commensaux1 occupent toutes les barrières naturelles du corps humain, avec une colonisation particulièrement importante du tube digestif. Leur génome combiné ou « microbiome », bien que possédant des fonctions redondantes, est 100 fois plus grand que le génome humain [1]. Cet écosystème dynamique formant le microbiote est notamment composé de champignons, de virus, de bactériophages, d’archées et de bactéries ; ces dernières appartiennent à quatre phylums bactériens dominants, les Firmicutes, les Bacteroidetes, les Proteobacteria et les Actinobacteria. Le microbiote n’apparaît pas uniformément réparti au sein de notre intestin. En effet, deux gradients microbiens sont identifiés. Un premier gradient de densité et de diversité microbienne est observé entre l’estomac, qui contient environ 102 cellules microbiennes par gramme de contenu, principalement des lactobacilles, et le côlon qui peut contenir jusqu’à 1012 cellules par millilitre de contenu, caractérisé par une grande diversité d’espèces. Un second gradient de densité est identifié entre la lumière intestinale, riche en bactéries, et la couche de mucus proche du tissu [2]. Quelques espèces particulières, comme celles du phylum des Proteobacteria ou des Verrucomicrobia, comme Akkermansia muciniphila, sont capables d’adhérer, de coloniser et de dégrader cette couche de mucus chez l’homme [3, 4]. Bien que les grands groupes bactériens soient conservés entre les individus, le microbiote est spécifique de son hôte et d’importantes variations peuvent être observées entre deux individus. De nombreux facteurs d’origines environnementale (l’alimentation, le style de vie, les hormones, les antibiotiques, les xénobiotiques ou polluants) et génétique sont responsables de cette diversité. On pourrait ainsi envisager de classer les individus en fonction de leur microbiote, en définissant des signatures microbiennes à la manière d’un haplotype du complexe majeur d’histocompatibilité ou d’un groupe sanguin. Depuis plus de 500 millions d’années, les micro-organismes commensaux et leurs hôtes ont co-évolué et se sont adaptés l’un à l’autre pour aboutir à une relation mutualiste. Les bactéries intestinales profitent d’un habitat, de nutriments qu’elles extraient de notre alimentation et assurent, en retour, de nombreuses fonctions telles que la digestion des carbohydrates, la colonisation de niches, empêchant ainsi, par compétition, l’implantation de pathogènes, ainsi que le développement et la maturation du système immunitaire (SI) et du système nerveux entérique. L’intestin apparaît donc comme une interface tripartite entre la muqueuse intestinale, le SI et le microbiote dont l’interaction est nécessaire au maintien de l’homéostasie intestinale [49] (→).
(→) Voir la Synthèse de V. Gaboriau-Routhiau et N. Cerf-Bensussan, page 961 de ce numéro
|
Microbiote et immunité intestinale L’absence de flore chez des animaux axéniques2 engendre de nombreuses altérations dans le développement du SI. En effet, ces souris possèdent des taux d’IgA, de plasmocytes et de lymphocytes intra-épithéliaux diminués, des plaques de Peyer de plus petite taille ainsi qu’une altération de la sécrétion de peptides antimicrobiens [5]. L’iléum de ces animaux ne contient pas de lymphocytes T de type Th17 [6] et le côlon présente des taux de lymphocytes T régulateurs (Treg) producteurs d’interleukine (IL)-10 diminués. Le microbiote intestinal possède donc la capacité de moduler les réponses lymphocytaires T ainsi que l’homéostasie de cette muqueuse. Les bactéries filamenteuses segmentées (SFB), par exemple, induisent la polarisation d’une réponse Th17 dans la muqueuse iléale [7, 49] (→).
(→) Voir la Synthèse de V. Gaboriau-Routhiau et N. Cerf-Bensussan, page 961 de ce numéro
D’autres travaux décrivent la capacité d’un Bacteroides (Bacteroides fragilis) à induire l’expansion d’une population de Treg Foxp3 (forkhead box P3)+ producteurs d’IL-10. Cette polarisation implique la reconnaissance du polysaccharide A (PSA) bactérien par le récepteur TLR2 (toll-like receptor 2) exprimé par les lymphocytes T CD4+ [8]. De même, la transplantation du microbiote fécal humain (FMT) chez la souris s’accompagne de l’expansion des Treg. L’analyse de la composition du microbiote transplanté [50] (→) a permis d’identifier une population stable et restreinte d’espèces bactériennes composées de Clostridium groupe IV et XIV comme étant responsables du phénomène observé [9].
(→) Voir la Synthèse de J.C. Lagier et D. Raoult, page 991 de ce numéro
L’activité métabolique des bactéries est caractérisée par la production de bioproduits tels que les acides gras à chaîne courte (SCFA). Ces métabolites possèdent également des propriétés immuno-modulatrices qui impactent le chimiotactisme, la prolifération cellulaire, la production de cytokines et l’expansion de populations immunitaires. Parmi ces SCFA, le butyrate a été décrit comme particulièrement efficace dans l’induction des Treg in vivo et in vitro [10]. Il est intéressant de noter que la quantité importante de bactéries et d’antigènes qui y sont associés, contenus dans le tube digestif, n’engendre pas en condition physiologique de réponses inflammatoires spontanées dans l’intestin. Il est donc nécessaire que les mécanismes de reconnaissance puissent transmettre des signaux tolérogènes pour l’établissement d’une relation mutualiste entre l’hôte et son microbiote. |
De nombreux facteurs génétiques et environnementaux menacent cependant l’intégrité et la composition du microbiote intestinal, une perturbation communément appelée dysbiose. Elle participe à l’échec du contrôle des pathogènes, à l’induction de réactions inflammatoires et engendre des dommages tissulaires comme ceux que l’on observe dans les maladies inflammatoires de l’intestin [49, 51] (IBD [inflammatory bowel disease] ou MICI [maladies inflammatoires chroniques de l’intestin] (→).
(→) Voir les Synthèses de V. Gaboriau-Routhiau et N. Cerf-Bensussan, et de O. Rahmouni et al., pages 961 et 968 de ce numéro
La dysbiose a également été associée au développement de nombreuses pathologies telles que l’obésité, l’autisme, le diabète ou encore le cancer [11]. En effet, des études épidémiologiques associent le développement d’infections intra-abdominales et le recours à des traitements antibiotiques à une incidence plus importante de cancers colorectaux (CRC) [12]. Les travaux de Garrett réalisés chez la souris mettent en lumière le fait qu’une surreprésentation d’Enterobacteriaceae (faisant suite à un déficit génétique pour le facteur de transcription T-bet [T-box transcription factor] et Rag2 [recombination activating gene 2]) provoque une plus grande susceptibilité à la colite expérimentale conduisant à la carcinogenèse colorectale [13, 14]. Dans un autre modèle préclinique appelé ApcMin/+, les souris présentent une prédisposition aux néoplasies intestinales multiples (Min) engendrée par la mutation du gène suppresseur de tumeur Apc (adenomatous polyposis coli). Chez ces souris, le microbiote intestinal promeut la croissance tumorale. En effet, les souris ApcMin/+ maintenues en zone conventionnelle présentent une incidence de CRC augmentée par rapport à des souris de même fond génétique mais axéniques [15]. La composition du microbiote peut contribuer au développement du cancer mais peut également jouer un rôle dans l’évolution de la maladie. Les souris ApcMin/+ Msh2-/- qui présentent, en plus de la mutation du gène Apc, une mutation sur le gène Msh2 (MutS homolog 2) qui joue un rôle important dans le système de réparation de l’ADN dit DNA mismatch repair (MMR), développent spontanément un CRC. Dans ce modèle, le butyrate produit par les bactéries conduit à l’hyperprolifération des cellules épithéliales Msh2-/- du côlon et la modification du microbiote, induite par exemple par des régimes sans carbohydrates (sources de butyrate), permet de réduire le développement de CRC [16]. Toutes ces observations nous indiquent que le microbiote intestinal influence la carcinogenèse et la progression tumorale locale. D’autres travaux lui attribuent également un impact sur la progression tumorale à distance du tube digestif. En effet, des dysbioses associées à l’obésité ont été décrites comme facilitant le développement de carcinomes hépatocellulaires (HCC, induit par un carcinogène) via l’augmentation d’un métabolite bactérien, l’acide désoxycholique (DCA). Ainsi, la neutralisation du DCA permet d’empêcher la survenue d’HCC chez les souris obèses [17]. La translocation de bactéries intestinales est une caractéristique des maladies chroniques hépatiques et contribue à l’inflammation et la fibrose. Le microbiote intestinal et le TLR4, récepteur impliqué dans la reconnaissance des produits bactériens, participent ainsi au développement d’HCC [18]. Un métabolite produit par les bactéries, le propionate, possède en revanche la capacité de réduire la prolifération cellulaire dans le cancer du foie [19]. Par ailleurs, la gentamicine, un antibiotique, augmente l’agressivité du cancer du sein exprimant l’oncogène HER2/Neu (human epidermal growth factor receptor 2, ou ErbB2) dans un modèle de souris transgéniques [20]. Dans le modèle murin ApcMin/+
, l’infection intestinale par le pathogène Helicobacter hepaticus augmente, quant à elle, le risque de développement de carcinome mammaire via le recrutement de neutrophiles [21]. Enfin, une méta-analyse concluait en 2010 à l’existence d’une association entre consommation d’antibiotiques et risque plus élevé de développer des cancers du sein [22]. Plus récemment, la signalisation impliquant le récepteur TLR5, qui reconnaît la flagelline des bactéries, activée par la flore intestinale, a été associée à l’expansion de cellules myéloïdes suppressives (MDSC) au sein du microenvironnement tumoral. Stimulées par le microbiote, ces cellules vont, par l’intermédiaire des cellules Tγδ, inhiber les réponses anti-tumorales et impacter la croissance de tumeurs du sein et de l’ovaire [23]. |
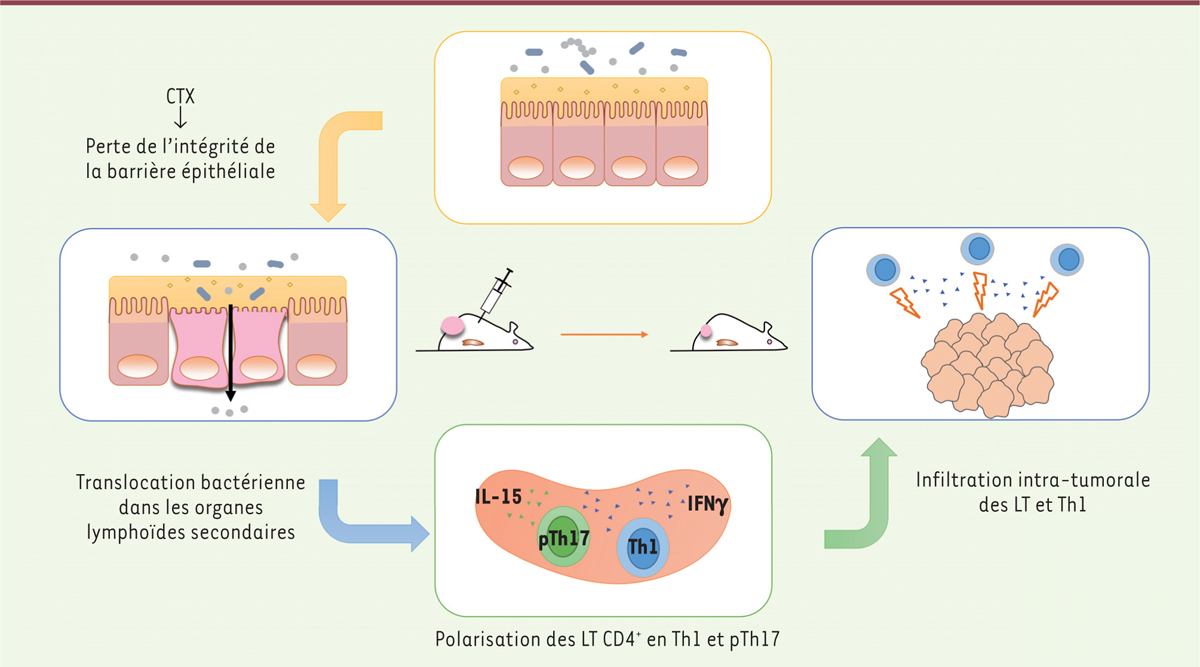
Microbiote et chimiothérapies anticancéreuses Un impact du microbiote intestinal a été suggéré dans l’efficacité des chimiothérapies anti-tumorales, dans des modèles précliniques. Notre équipe a ainsi démontré que l’efficacité du cyclophosphamide (CTX), un agent alkylant appartenant à la famille des moutardes azotées aux propriétés immunomodulatrices et anti-angiogéniques [24], repose, en partie, sur sa capacité à entraîner chez l’animal la translocation de certaines bactéries commensales à Gram positif (Lactobacillus johnsonii et Enterococcus hirae) dans les organes lymphoïdes secondaires (ganglions, rate). Le CTX induit chez l’individu qui le reçoit, une fragilisation de sa barrière intestinale avec une perméabilité augmentée, ce qui entraîne une rupture de tolérance vis-à-vis de sa flore intestinale et son immunisation contre certaines souches bactériennes [25]. L’immunisation antibactérienne implique des lymphocytes effecteurs CD4+ pTh17, appelés « Th17 pathogéniques », qui secrètent à la fois de l’IL-17 et de l’interféron (IFN) γ, et des lymphocytes mémoires de polarité Th1 qui aident les lymphocytes anti-tumoraux au contrôle de tumeurs sous-cutanées murines (sarcomes et mastocytomes) ou pulmonaires spontanées (adénocarcinomes mutés sur K-ras et p53). L’exploration des populations immunitaires au sein du lit tumoral a révélé que le CTX induit un recrutement de lymphocytes infiltrant la tumeur (TIL) CD3+ et de cellules Th1, populations associées à l’efficacité anti-tumorale de la chimiothérapie. Nous avons pu démontrer que l’utilisation d’un cocktail d’antibiotiques à large spectre, ou ciblant certaines populations bactériennes, impactait la polarisation des lymphocytes pTh17, des lymphocytes Th1, limitait l’accumulation des TIL dans la tumeur, et diminuait l’efficacité anti-tumorale de la chimiothérapie (Figure 1A).
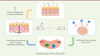 | Figure 1.
Mécanisme d’action de la flore intestinale dans l’efficacité anti-tumorale du cyclophosphamide. Le CTX (cyclophosphamide) affecte l’intégrité de la barrière intestinale et engendre la translocation de bactéries Gram+. Ces bactéries entraînent la polarisation de réponses pTh17 (Th17 pathogéniques) dans la rate ainsi que l’infiltration de lymphocytes Th1 au sein de la tumeur. LT : lymphocyte T ; IFNγ : interféron gamma ; IL : interleukine ; Th : T helper. |
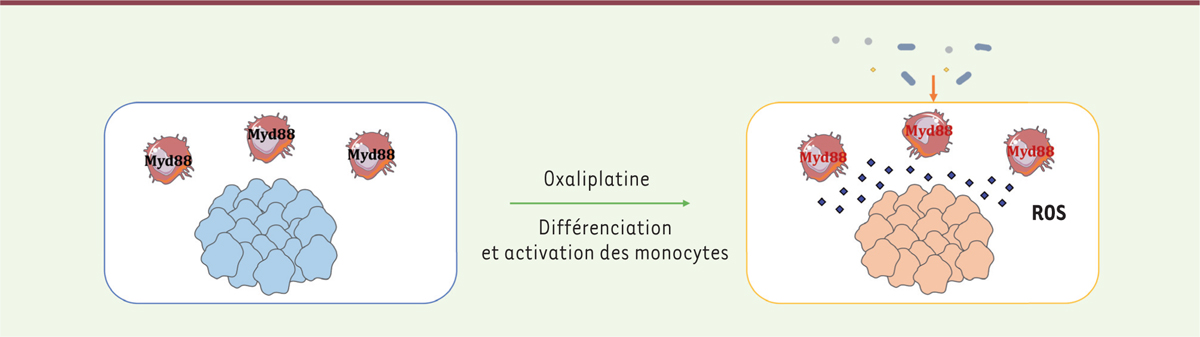
Les patients recevant une chimiothérapie par CTX présentent également des troubles digestifs, tels que des mucosites (altération de l’intégrité et de la perméabilité de la barrière intestinale, associée à une augmentation de la translocation bactérienne). Notre laboratoire évalue actuellement l’immunisation des patients contre des bactéries qui ont été identifiées à partir des modèles précliniques. Cette stratégie permettrait d’envisager des thérapeutiques relatives au microbiote et ainsi d’encadrer la prise d’antibiotiques qui sont souvent associés au CTX. La démonstration de l’impact de la flore dans la réponse aux agents chimio-thérapeutiques a été apportée, en parallèle, par une équipe américaine du NIH (National Institutes of Health) [26]. Cette équipe a en effet montré, dans un modèle murin, que les cellules apparentées aux macrophages présentes au sein des tumeurs du côlon, répondaient aux bactéries commensales en produisant des radicaux libres oxygénés (ROS). Cette synthèse de ROS s’avère nécessaire à l’induction de dommages à l’ADN et permet l’éradication des tumeurs sous chimiothérapie à base de sels de platine (oxaliplatine). La chimiothérapie est ainsi rendue inefficace par l’absence de flore intestinale, chez les souris axéniques, ou chez des animaux ayant reçu des antibiotiques (Figure 1B). |
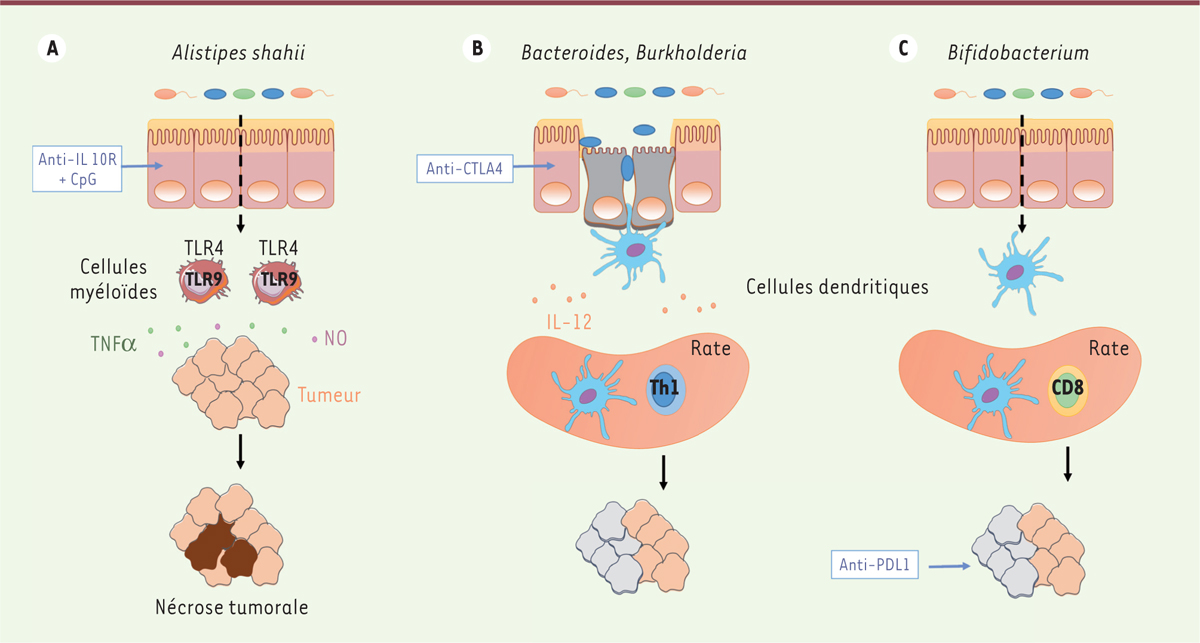
Microbiote intestinal et succès des immunothérapies La première évidence que le microbiote peut moduler l’impact des immunothérapies a émergé à partir de l’observation que l’amélioration de l’efficacité du transfert adoptif de lymphocytes T CD8+ induite par son association à une irradiation totale du patient était réduite en l’absence de microbiote intestinal (après antibiothérapie), ce qui pouvait s’expliquer par l’induction d’une translocation bactérienne facilitée par l’irradiation. En effet, des quantités importantes de lipopolysaccharide (LPS) sont retrouvées dans le sérum des patients ayant subi une irradiation [27, 28]. Iida et al. ont également abordé l’impact du microbiote intestinal dans l’efficacité de thérapies anticancéreuses fondées sur la réactivation du système immunitaire. Dans un modèle préclinique, cette équipe a montré que la croissance tumorale est ralentie par l’administration intra-tumorale de CpG (cytosine-phosphate-guanine)-oligodéoxynucléotides (ligands du TLR9) combinée à la neutralisation du récepteur de l’IL-10. Cette combinaison entraîne la nécrose de la tumeur via la production de TNFα (tumor necrosis factor-alpha) et de monoxyde d’azote (NO) par les cellules myéloïdes présentes dans le microenvironnement. En l’absence de microbiote intestinal, la production de TNFα est inhibée et l’efficacité anti-tumorale de l’immunothérapie est fortement diminuée [26]. Depuis quelques années, la prise en charge du traitement du cancer a été bouleversée par le succès d’anticorps bloquant les rétrocontrôles inhibiteurs du système immunitaire (immune checkpoint blockers, ICB). Ces molécules, comme CTLA4 (cytotoxic T-lymphocyte-associated protein 4) et PD1 (programmed cell death 1), sont exprimées à la membrane des lymphocytes T à la suite de l’engagement du TCR (récepteur des cellules T) et ont pour rôle de limiter l’activation du système immunitaire, de maintenir la tolérance au soi et de prévenir le développement de l’auto-immunité. Leur blocage par des anticorps monoclonaux spécifiques a permis de mettre en évidence des bénéfices sur la survie globale de patients atteints de mélanomes métastatiques ou de cancers avancés du poumon, du rein et de la vessie [29, 30]. L’activation des lymphocytes T requiert deux signaux complémentaires : un signal issu du TCR, spécifique de l’antigène, et un signal de co-stimulation, le mieux caractérisé impliquant la molécule CD28. L’homodimère CD28 est exprimé sur les lymphocytes T au repos. Il interagit avec CD80 (B7-1) et CD86 (B7-2), présents à la surface des cellules présentatrices de l’antigène (CPA) activées. L’engagement de CD28 avec ses partenaires amplifie ainsi les effets transcriptionnels du TCR. CTLA4 est une glycoprotéine apparentée à CD28. Elle est surexprimée 2 à 3 jours après l’activation des lymphocytes T et se lie aux mêmes molécules, CD80 et CD86, mais avec une affinité environ 20 fois supérieure à celle de CD28 [31, 32]. L’expression de CTLA4 à la surface des lymphocytes T conduit donc à une compétition avec CD28 pour l’accès aux ligands. En se liant à CD80 ou à CD86, CTLA4 déclenche un signal opposé à celui délivré par CD28. La progression dans le cycle cellulaire, l’expression du récepteur de l’IL-2 ainsi que la production d’IL-2 par les lymphocytes T sont ainsi bloquées. CTLA4 est donc un régulateur négatif de l’activation des lymphocytes T. Prenant en considération le rôle que joue la flore intestinale dans l’efficacité des chimiothérapies et de certaines immunothérapies, notre équipe a évalué le rôle du microbiote intestinal dans l’efficacité d’un anticorps anti-CTLA4. Nos résultats ont révélé que l’absence de flore intestinale, chez des animaux axéniques ou après induction par antibiothérapie à large spectre, diminuait fortement l’efficacité anti-tumorale de l’anticorps anti-CTLA4. Le blocage de CTLA4 par l’anticorps conduit parallèlement à l’induction d’un déséquilibre du microbiote intestinal. Les populations bactériennes qui sont significativement impactées par ce traitement appartiennent à l’ordre des Bacteroidales et des Burkholderiales. Nous avons donc évalué le potentiel anti-tumoral de ces bactéries en colonisant des animaux dépourvus de flore, avec différentes souches bactériennes. Seuls les gavages oraux réalisés avec Bacteroides fragilis (B. f), Bacteroides thetaiotaomicron (B. t) et Burkholderia cepacia (B. c) ont permis de restaurer l’efficacité anti-tumorale de l’anticorps anti-CTLA4. Afin d’expliquer la nécessité du microbiote intestinal dans la mise en place de la réponse anti-tumorale efficace, nous avons examiné les réponses immunitaires mémoires développées à l’encontre de ces bactéries. Des réponses de type Th1 ont été détectées à l’encontre de deux bactéries appartenant à la famille des bacteroides (B. f et B. t). Le transfert adoptif de lymphocytes T spécifiques de B. f chez des animaux axéniques permet de rétablir la réponse anti-tumorale de l’anticorps anti-CTLA4. Ces résultats obtenus chez la souris nous ont donc conduits à évaluer la pertinence clinique de ces bactéries chez l’homme en examinant chez des patients atteints de mélanome métastatique ou de cancer du poumon le degré d’immunisation développée contre leurs commensaux intestinaux pendant le traitement par l’ipilimumab (un anticorps anti-CTLA4). Nous avons mis en évidence une immunisation spécifique contre B. f et B. t dans le cas du mélanome métastatique, et contre B. c dans le cancer du poumon, ces réponses de type Th1 mémoire productrice d’IFNγ étant augmentées sous l’action de l’ipilimumab. Au cours de ces analyses, nous avons pu définir des groupes de patients selon la composition de leur microbiote intestinal (évaluée par pyroséquencage de l’ARN ribosomal 16S de leurs fèces). Trois groupes, A, B et C ont ainsi été déterminés selon la composition de leur fèces et la présence de Bacteroides et Prevotella. Le potentiel anti-tumoral présenté par chacun de ces groupes de patients a été évalué par transfert du matériel fécal (FMT) chez des animaux axéniques. Les animaux recevant les fèces du groupe C répondent significativement à l’anticorps anti-CTLA4 ; ceux recevant les fèces du groupe B sont en revanche résistants au traitement. Une corrélation inverse entre taille de la tumeur et quantité de Bacteroides fragilis retrouvée chez les animaux du groupe C, a pu être mise en évidence. Ainsi, plus l’animal est colonisé avec Bacteroides fragilis après l’injection par l’anti-CTLA4, mieux il contrôle la croissance tumorale [33]. Une équipe américaine a également attribué, dans la même édition du journal, un rôle à la flore intestinale dans l’efficacité du blocage impliquant une autre checkpoint blocker, l’axe PD1/PDL1 (programmed cell death ligand 1). Dans cette étude [34], le contrôle naturel de la croissance d’un mélanome implanté en sous-cutané a été comparé chez des animaux de fond génétique identique (C57Bl/6) mais provenant de fournisseurs différents (ce qui influe sur la colonisation des animaux en fonction de l’environnement qu’ils rencontrent au cours de l’élevage). Ils ont constaté que les animaux provenant des laboratoires Jackson (JAX) bénéficient d’un meilleur contrôle tumoral par rapport à ceux élevés par les laboratoires Taconic (TAC). Ce bénéfice peut être transmis aux souris issues de l’élevage TAC lorsque qu’elles sont hébergées avec les souris provenant de l’élevage JAX pendant plusieurs semaines avant l’implantation de la tumeur. Le nombre de lymphocytes T anti-tumoraux spécifiques est également augmenté chez les souris TAC par ce co-hébergement. L’impact environnemental sur les phénomènes observés est donc probablement dû à une transmission du microbiote par coprophagie entre les souris des deux élevages. Afin de vérifier cette hypothèse, les auteurs ont administré, par voie orale, les fèces d’animaux JAX à des animaux TAC et ils ont constaté que le contrôle de la tumeur par les souris était similaire à celui observé dans le cas d’un co-hébergement. Les résultats qu’ils ont obtenus illustrent également que le microbiote influence non seulement l’immunité anti-tumorale naturelle, mais aussi la réponse aux immunothérapies. En effet, l’efficacité anti-tumorale de l’anticorps anti-PDL1 est diminuée chez les souris TAC, par comparaison aux animaux JAX. En réalisant une analyse par pyroséquençage de l’ADN 16S des fèces des animaux JAX et TAC, Sivan et al. ont montré que la présence de Bifidobacterium était proportionnelle au nombre de lymphocytes T anti-tumoraux spécifiques. À l’image du co-hébergement et des FMT, la perte du contrôle tumoral observée chez les animaux TAC peut être restaurée par des gavages oraux avec Bifidobacterium. Les animaux TAC gavés avec Bifidus longum et Bifidus breve présentent un meilleur contrôle naturel anti-tumoral, avec des cellules dendritiques intra-tumorales plus activées et un plus grand nombre de TIL spécifiques. L’efficacité anti-tumorale de l’anti-PDL1 est également améliorée par l’administration de Bifidus chez les animaux TAC, démontrant ainsi le rôle majeur du microbiote dans l’efficacité des immunothérapies. (Figure 2)
 | Figure 2.
Rôle de la flore intestinale dans l’efficacité anti-tumorale des sels de platine. L’oxaliplatine stimule la production de ROS (espèces réactives de l’oxygène) par l’intermédiaire des cellules myéloïdes via un mécanisme dépendant du microbiote et de la signalisation myD88 (myeloid differentiation primary response gene 88). Ces composés induisent une mort par effet cytotoxique sur la cellule tumorale. |
 | Figure 3.
Impact du microbiote intestinal dans l’immunité anti-tumorale induite par les immunothérapies. A. L’administration intra-tumorale d’un ligand (le CpG, cytosine-phosphate-guanine-oligodéoxynucléotides) du TLR (toll-like receptor) 9 combinée à la neutralisation du récepteur à l’IL(interleukine)-10 entraîne la nécrose de la tumeur via la production de TNF(tumor necrosis factor)α et de monoxyde d’azote (NO) par les cellules myéloïdes du microenvironnement tumoral. Ce mécanisme est dépendant du microbiote intestinal (Alistipes shahii) et du TLR4. B. Le blocage systémique du CTLA4 (cytotoxic T-lymphocyte-associated protein 4) entraîne une modification des populations bactériennes intestinales, ainsi qu’une apoptose des cellules épithéliales de l’intestin. Certaines espèces de Bacteroides, telles que Bacteroides fragilis et Bacteroides thetaiotaomicron, vont induire une réponse Th1 grâce à la production d’IL-12 par les cellules dendritiques. L’absence de flore intestinale abroge l’efficacité anti-tumorale de l’anti-CTLA4. C. Les Bifidobacterium permettent d’améliorer les fonctions des cellules dendritiques, augmentant ainsi la prolifération et la production de cytokines des lymphocytes spécifiques intra-tumoraux. Les Bifidobacterium permettent également d’augmenter l’efficacité anti-tumorale de l’anticorps anti-PDL1 (programmed cell death ligand 1). |
|
Microbiote intestinal, immunothérapies et toxicités Malgré des réponses spectaculaires et à long terme, les ICB ne bénéficient qu’à une minorité de patients (environ 15 % dans le cas de l’anti-CTLA4). Un des défis majeurs pour l’optimisation de ces immunothérapies réside en partie dans l’association de plusieurs molécules afin d’en accroître les effets anti-tumoraux. Cependant, la levée d’un ou de plusieurs rétrocontrôles inhibiteurs du système immunitaire aboutit au développement de toxicités en lien avec des réponses auto-immunes (AI). Pour CTLA4, les toxicités sont principalement dirigées contre la peau, le foie et l’intestin, des sites particulièrement colonisés par la flore [35]. Le microbiote pourrait intervenir dans la survenue de ces toxicités. Nous avons en effet montré que l’administration simultanée de deux bactéries immunogènes (Bacteroides fragilis et Burkholderia cepacia) dans le contexte du blocage de CTLA4 permet de maintenir le bénéfice anti-tumoral chez des souris ayant reçu au préalable une antibiothérapie, tout en protégeant l’animal du développement de toxicités digestives [33]. Récemment Dubin et al. ont montré l’existence d’une association entre composition du microbiote et risque de survenue de colites, chez des patients atteints de mélanomes métastatiques et traités avec l’ipilimumab. En effet, la surreprésentation de bactéries appartenant au phylum des Bacteroidetes est corrélée à une résistance au développement de colites. Et un plus grand risque de développer des colites est associé à l’absence d’une signalisation impliquée dans le transport des polyamines et de la biosynthèse de vitamine B [36]. |
Booster les thérapies anticancéreuses via le microbiote : vers le développement d’« oncobiotiques » ? Les travaux publiés ces dernières années et décrits au long de cette revue font état d’un rôle incontestable du microbiote intestinal dans l’immunité anti-tumorale naturelle, mais également en réponse aux thérapies anticancéreuses. À l’avenir, plusieurs stratégies thérapeutiques faisant intervenir le microbiote pourront donc être envisagées en combinaison avec des ICB ou des chimiothérapies pour en améliorer les effets anti-tumoraux. Des « oncomicrobiotiques », constitués de bactéries immunogènes, de pré-, de probiotiques ou de métabolites bactériens pourront être utilisés en conditionnement chez des patients présentant une dysbiose avec des sous- ou des surreprésentations d’espèces bactériennes. Dernièrement, des travaux ont démontré le potentiel anti-tumoral d’un cocktail de probiotiques chez des souris porteuses d’HCC. Ces probiotiques ralentissent la croissance tumorale en réduisant notamment le recrutement des lymphocytes Th17 intestinaux producteurs d’IL-17 dans la tumeur et l’angiogenèse. La capacité de ce cocktail probiotique à moduler la composition du microbiote intestinal, caractérisée notamment par un enrichissement en Prevotella et Oscillibacter, bactéries reconnues pour leur capacité à produire des métabolites anti-inflammatoires et à réduire la polarisation Th17, a été également montrée [37]. Le potentiel du microbiote est d’ores et déjà utilisé en clinique pour le traitement des infections récurrentes à Clostridium difficile (CDI). En effet, les FMT de donneurs sains [50] (→), destinées à réparer la dysbiose induite par les traitements antibiotiques et à rétablir la richesse et la diversité bactérienne, ont démontré un taux d’efficacité de 81 à 90 % chez les patients atteints de CDI [38–40]. Devant le geste invasif que représente la FMT et face au risque de transmission de pathogènes, des méthodes alternatives ont été évaluées comme par exemple l’administration orale d’un composé de spores issus d’une cinquantaine d’espèces de Firmicutes isolés à partir de donneurs sains [41]
(→) Voir la Synthèse de J.C. Lagier et D. Raoult, page 991 de ce numéro
À côté des pré- et probiotiques, les antibiotiques représentent une alternative thérapeutique envisageable. On peut ainsi supposer que l’altération spécifique de l’équilibre entre les différents grands groupes bactériens pourrait affecter l’efficacité de traitements anti-cancéreux [42]. Le potentiel d’antibiotiques spécifiques pourrait aussi être exploité de manière à favoriser des populations bactériennes immuno-stimulatrices au détriment de bactéries régulatrices. Enfin, un dernier mode d’exploitation du microbiote peut être envisagé par le biais d’épitopes partagés entre les commensaux et la tumeur. Une étude publiée en 2014 a fourni la preuve de principe, grâce à un séquençage complet de l’exome, qu’une corrélation pouvait exister entre les caractéristiques génétiques de la tumeur, celles des commensaux, et la réponse au traitement par anti-CTLA4. Ainsi, les patients présentant un fort taux mutationnel de leurs cellules tumorales et une signature de néo-antigènes tumoraux sont plus propices à répondre au traitement. Ces résultats introduisent le concept d’une possible homologie entre ces néo-antigènes de tumeurs et des antigènes bactériens. Une immunité croisée pourrait donc se mettre en place à l’encontre de certaines bactéries et des cellules tumorales [43]. Ces données permettraient d’expliquer, en partie, pourquoi le transfert de lymphocytes T mémoires spécifiques de Bacteroides fragilis restaure l’efficacité anti-tumorale de l’anti-CTLA4 dans un contexte axénique. Des vaccins muqueux composés de ces épitopes communs, ainsi que des transferts de lymphocytes dirigés contre ces épitopes, pourraient donc constituer de nouvelles stratégies thérapeutiques permettant de pallier une résistance primaire aux thérapies anticancéreuses. Il faut désormais identifier les patients ayant peu de chances de répondre aux thérapies conventionnelles et pouvant bénéficier de ces nouvelles thérapies. L’avènement de nouvelles technologies (méthodes de séquençages de l’ADN 16S, de métagénomique et de métatranscriptomique) [52, 53] (→) ainsi que la renaissance de la culturomique [44–46, 54] (→) devraient permettre la multiplication des études cliniques déterminant le potentiel prédictif du microbiote. Ces descriptions pourront aboutir, dans un futur plus ou moins proche, à la compréhension du rôle des commensaux dans la réponse aux traitements anticancéreux et d’identifier les espèces, ou souches bactériennes qui sont importantes pour l’efficacité thérapeutique du traitement.
(→) Voir les Synthèses de J. Weissenbach et A. Sghir, et de H.M. Blottière et J. Doré, pages 937 et 944 de ce numéro
(→) Voir la Nouvelle de J.C. Lagier et D. Raoult, page 923 de ce numéro
Les différentes études décrivant le rôle de la flore intestinale dans la réponse aux traitements utilisés en clinique illustrent la complexité du domaine. En effet, les premières données semblent indiquer que chaque traitement implique des populations bactériennes différentes qui lui sont caractéristiques (Bacteroides fragilis et Burkholderia cepacia pour l’anti-CTLA4, Enterococcus hirae et Lactobacillus johnsonii pour le CTX, Alistipes shahii pour l’anti-IL-10R associé aux CpG ou encore les Bifidobacterium pour l’anti-PDL1). Des travaux complémentaires devront déterminer la spécificité de chaque bactérie pour un traitement donné. Il faudra également évaluer la dysbiose associée à chaque type de cancer et déterminer l’impact de ce déséquilibre microbien sur l’évolution clinique de la maladie, sur l’efficacité d’un traitement et ses possibles effets secondaires. De ces travaux émergent également la notion de microbiote sain : quel patient présente un microbiote considéré comme « normal » et quel microbiote est jugé dysbiotique ? Il est très complexe de définir un standard microbien en raison des variations inter-individuelles et de la multitude de facteurs qui l’influençent. Cette définition est importante notamment dans le cadre de la FMT et du choix des donneurs sains ou encore dans la sélection des patients potentiellement « répondeurs » à la thérapie [50] (→).
(→) Voir la Synthèse de J.C. Lagier et D. Raoult, page 991 de ce numéro
Si la diversité microbienne est un paramètre important, le développement d’études sur le rôle du microbiote est nécessaire afin d’en affiner la description et la caractérisation. La complexité réside dans le rôle central que semble jouer ce microbiote, que certains considèrent comme un organe à part entière [55] (→).
(→) Voir le Forum de B. Dodet, page 1003 de ce numéro
En effet, la découverte de liens entre microbiote et autisme, obésité ou encore cancer démontre l’étendue du domaine. Nous nous dirigerons donc vers une médecine personnalisée où le potentiel du microbiote de chaque patient devra être évalué et pourra orienter le choix thérapeutique des cliniciens. |
L’importance des travaux récents portant sur le rôle du microbiote pourrait changer la prise en charge des patients souffrant de cancers. Elle ouvre la voie au développement d’« oncomicrobiotiques », ou probiotiques adjuvants de la réponse anti-tumorale. La détection des dysbioses chez ces patients pourrait permettre de compenser la perte de certaines populations bactériennes, importantes pour l’efficacité des traitements, par l’administration de probiotiques, au potentiel immuno-modulateur, et des prébiotiques qui favorisent leur implantation et leur croissance. Cependant, de nombreuses questions restent sans réponse : Sommes-nous prédestinés par notre génétique à disposer d’un bon ou mauvais microbiote [48] ? Comment ce microbiote est-il modifié par l’évolution d’un cancer ? Comment exploiter le potentiel du microbiote si ce dernier est modifié par l’évolution d’un cancer ? Existe-t-il un « oncomicrobiotique » caractéristique de chaque traitement ? Enfin, quel est l’impact des flores extra-intestinales (cutanée, de l’arbre respiratoire supérieur et génital) en fonction de la localisation de la tumeur primaire ? Les réponses à ces questions devraient permettre de comprendre les mécanismes d’action de la flore intestinale dans l’efficacité des traitements anticancéreux et de développer de futures stratégies thérapeutiques prenant en compte l’association fondamentale entre toxicité, efficacité des médicaments et microbiote intestinal. |
L. Zitvogel est la co-fondatrice d’EverImmune. M. Vétizou et R. Daillère déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient tous les membres de leur laboratoire et leurs collaborateurs pour leur contribution (Institut Pasteur Lille, Institut Pasteur Paris, INRA). Marie Vétizou et Romain Daillère remercient la Ligue nationale contre le cancer pour son soutien financier.
|
|
CDI
|
infections récurrentes à Clostridium difficile
|
|
CRC
|
cancers colorectaux |
|
CTLA4
|
cytotoxic T-lymphocyte-associated protein 4
|
|
CTX
|
cyclophosphamide |
|
DCA
|
acide désoxycholique |
|
FMT
|
transplantation du microbiote fécal humain |
|
HCC
|
carcinome hépatocellulaire |
|
IBD
|
maladies inflammatoires de l’intestin |
|
ICB
|
rétrocontrôles inhibiteurs du système immunitaire (immune checkpoint blockers) |
|
IFNγ
|
interféron γ |
|
IL-10
|
interleukine-10 |
|
AI
|
auto-immunité |
|
LPS
|
lipopolysaccharide |
|
MDSC
|
cellules myéloïdes suppressives |
|
PD-L1
|
programmed death-ligand 1
|
|
PSA
|
polysaccharide A |
|
ROS
|
radicaux libres oxygénés |
|
SCFA
|
acides gras à chaîne courte |
|
SFB
|
bactéries filamenteuses segmentées |
|
SI
|
système immunitaire |
|
TCR
|
récepteur des cellules T |
|
TIL
|
lymphocytes infiltrant la tumeur |
|
TLR2
|
Toll-like receptor 2
|
|
Treg
|
lymphocytes T régulateurs |
|
Footnotes |
1.
Maynard CL, Elson CO, Hatton RD, et al. Reciprocal interactions of the intestinal microbiota and immune system . Nature. 2012; ; 489 : :231.–241. 2.
Holzapfel WH, Haberer P, Snel J, et al. Overview of gut flora and probiotics . Int J Food Microbiol. 1998; ; 41 : :85.–101. 3.
Swidsinski A, Loening-Baucke V, Lochs H, et al. Spatial organization of bacterial flora in normal and inflamed intestine: a fluorescence in situ hybridization study in mice . World J Gastroenterol. 2005; ; 11 : :1131.–1140. 4.
Sekirov I, Russell SL, Antunes LCM, et al. Gut microbiota in health and disease . Physiol Rev. 2010; ; 90 : :859.–904. 5.
Round JL, Mazmanian SK. The gut microbiota shapes intestinal immune responses during health and disease . Nat Rev Immunol. 2009; ; 9 : :313.–323. 6.
Atarashi K, Nishimura J, Shima T, et al. ATP drives lamina propria T(H)17 cell differentiation . Nature. 2008; ; 455 : :808.–812. 7.
Ivanov II, Atarashi K, Manel N, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria . Cell. 2009; ; 139 : :485.–498. 8.
Round JL, Lee SM, Li J, et al. The Toll-like receptor 2 pathway establishes colonization by a commensal of the human microbiota . Science. 2011; ; 332 : :974.–977. 9.
Atarashi K, Tanoue T, Oshima K, et al. Treg induction by a rationally selected mixture of Clostridia strains from the human microbiota . Nature. 2013; ; 500 : :232.–236. 10.
Furusawa Y, Obata Y, Fukuda S, et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells . Nature. 2013; ; 504 : :446.–450. 11.
Schwabe RF, Jobin C. The microbiome and cancer . Nat Rev Cancer. 2013; ; 13 : :800.–812. 12.
Wang JL, Chang CH, Lin JW, et al. Infection, antibiotic therapy and risk of colorectal cancer: a nationwide nested case-control study in patients with Type 2 diabetes mellitus . Int J Cancer. 2014; ; 135 : :956.–967. 13.
Garrett WS, Punit S, Gallini CA, et al. Colitis-associated colorectal cancer driven by T-bet deficiency in dendritic cells . Cancer Cell. 2009; ; 16 : :208.–219. 14.
Garrett WS, Gallini CA, Yatsunenko T, et al. Enterobacteriaceae act in concert with the gut microbiota to induce spontaneous and maternally transmitted colitis . Cell Host Microbe. 2010; ; 8 : :292.–300. 15.
Li Y, Kundu P, Seow SW, et al. Gut microbiota accelerate tumor growth via c-jun and STAT3 phosphorylation in APCMin/+ mice . Carcinogenesis. 2012; ; 33 : :1231.–1238. 16.
Belcheva A, Irrazabal T, Robertson SJ, et al. Gut microbial metabolism drives transformation of Msh2-deficient colon epithelial cells . Cell. 2014; ; 158 : :288.–299. 17.
Yoshimoto S, Loo TM, Atarashi K, et al. Obesity-induced gut microbial metabolite promotes liver cancer through senescence secretome . Nature. 2013; ; 499 : :97.–101. 18.
Dapito DH, Mencin A, Gwak G-Y, et al. Promotion of hepatocellular carcinoma by the intestinal microbiota and TLR4 . Cancer Cell. 2012; ; 21 : :504.–516. 19.
Bindels LB, Porporato P, Dewulf EM, et al. Gut microbiota-derived propionate reduces cancer cell proliferation in the liver . Br J Cancer. 2012; ; 107 : :1337.–1344. 20.
Rossini A, Rumio C, Sfondrini L, et al. Influence of antibiotic treatment on breast carcinoma development in proto-neu transgenic mice . Cancer Res. 2006; ; 66 : :6219.–6224. 21.
Lakritz JR, Poutahidis T, Mirabal S, et al. Gut bacteria require neutrophils to promote mammary tumorigenesis . Oncotarget. 2015; ; 6 : :9387.–9396. 22.
Sergentanis TN, Zagouri F, Zografos GC. Is antibiotic use a risk factor for breast cancer? . A meta-analysis. Pharmacoepidemiol. Drug Saf. 2010; ; 19 : :1101.–1107. 23.
Rutkowski MR, Stephen TL, Svoronos N, et al. Microbially driven TLR5-dependent signaling governs distal malignant progression through tumor-promoting inflammation . Cancer Cell. 2015; ; 27 : :27.–40. 24.
Sistigu A, Viaud S, Chaput N, et al. Immunomodulatory effects of cyclophosphamide and implementations for vaccine design . Semin Immunopathol. 2011; ; 33 : :369.–383. 25.
Viaud S, Saccheri F, Mignot G, et al. The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide . Science. 2013; ; 342 : :971.–976. 26.
Lida N, Dzutsev A, Stewart CA, et al. Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment . Science. 2013; ; 342 : :967.–970. 27.
Paulos CM, Wrzesinski C, Kaiser A, et al. Microbial translocation augments the function of adoptively transferred self/tumor-specific CD8+ T cells via TLR4 signaling . J Clin Invest. 2007; ; 117 : :2197.–2204. 28.
Dudley ME, Yang JC, Sherry R, et al. Adoptive cell therapy for patients with metastatic melanoma: evaluation of intensive myeloablative chemoradiation preparative regimens . J Clin Oncol. 2008; ; 26 : :5233.–5239. 29.
Hodi FS, O’Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma . N Engl J Med. 2010; ; 363 : :711.–723. 30.
Robert C, Thomas L, Bondarenko I, et al. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma . N Engl J Med. 2011; ; 364 : :2517.–2526. 31.
Perkins D, Wang Z, Donovan C, et al. Regulation of CTLA-4 expression during T cell activation . J Immunol. 1996; ; 156 : :4154.–4159. 32.
Linsley PS, Brady W, Urnes M, et al. CTLA-4 is a second receptor for the B cell activation antigen B7 . J Exp Med. 1991; ; 174 : :561.–569. 33.
Vétizou M, Pitt JM, Daillère R, et al. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota . Science. 2015; ; 350 : :1079.–1084. 34.
Sivan A, Corrales L, Hubert N, et al. Commensal Bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy . Science. 2015; ; 350 : :1084.–1089. 35.
Weber JS, Kähler KC, Hauschild A. Management of immune-related adverse events and kinetics of response with ipilimumab . J Clin Oncol. 2012; ; 30 : :2691.–2697. 36.
Dubin K, Callahan MK, Ren B, et al. Intestinal microbiome analyses identify melanoma patients at risk for checkpoint-blockade-induced colitis . Nat Commun. 2016; ; 7 : :10391.. 37.
Li J, Sung CYJ, Lee N, et al. Probiotics modulated gut microbiota suppresses hepatocellular carcinoma growth in mice . Proc Natl Acad Sci USA. 2016; ; 113 : :E1306.–E1315. 38.
van Nood E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile . N Engl J Med. 2013; ; 368 : :407.–415. 39.
Youngster I, Russell GH, Pindar C, et al. Oral, capsulized, frozen fecal microbiota transplantation for relapsing Clostridium difficile infection . JAMA. 2014; ; 312 : :1772.–1778. 40.
Cammarota G, Masucci L, Ianiro G, et al. Randomised clinical trial: faecal microbiota transplantation by colonoscopy vs. vancomycin for the treatment of recurrent Clostridium difficile infection . Aliment Pharmacol Ther. 2015; ; 41 : :835.–843. 41.
Khanna S, Pardi DS, Kelly CR, et al. A novel microbiome therapeutic increases gut microbial diversity and prevents recurrent Clostridium difficile infection . J Infect Dis. 2016 ; doi: 10.1093/infdis/jiv766.
42.
Zhang Y, Limaye PB, Renaud HJ, et al. Effect of various antibiotics on modulation of intestinal microbiota and bile acid profile in mice . Toxicol Appl Pharmacol. 2014; ; 277 : :138.–145. 43.
Snyder A, Makarov V, Merghoub T, et al. Genetic basis for clinical response to CTLA-4 blockade in melanoma . N Engl J Med. 2014; ; 371 : :2189.–2199. 44.
Li J, Jia H, Cai X, et al. An integrated catalog of reference genes in the human gut microbiome . Nat Biotechnol. 2014; ; 32 : :834.–841. 45.
Nielsen HB, Almeida M, Juncker AS, et al. Identification and assembly of genomes and genetic elements in complex metagenomic samples without using reference genomes . Nat Biotechnol. 2014; ; 32 : :822.–828. 46.
Lagier JC, Hugon P, Khelaifia S, et al. The rebirth of culture in microbiology through the example of culturomics to study human gut microbiota . Clin Microbiol Rev. 2015; ; 28 : :237.–264. 47.
Zitvogel L, Galluzzi L, Viaud S, et al. Cancer and the gut microbiota: an unexpected link . Sci Transl Med. 2015; ; 7 : :271ps1.. 48.
Fransen F, Zagato E, Mazzini E, et al. BALB/c and C57BL/6 Mice differ in polyreactive IgA abundance, which impacts the generation of antigen-specific IgA and microbiota diversity . Immunity. 2015; ; 43 : :527.–540. 49.
Gaboriau-Routhiau V, Cerf-Bensussan N. Microbiote intestinal et développement du système immunitaire . Med Sci (Paris). 2016; ; 32 : :961.–967. 50.
Lagier JC, Raoult D. Greffe de microbiote fécal et infections : mise au point, perspectives . Med Sci (Paris). 2016; ; 32 : :991.–997. 51.
Rahmouni O, Dubuquoy L, Desreumaux P, Neut C. Microbiote intestinal et développement des maladies inflammatoires chroniques de l’intestin . Med Sci (Paris). 2016; ; 32 : :968.–973. 52.
Weissenbach J, Sghir A. Microbiotes et Métagénomique . Med Sci (Paris). 2016; ; 32 : :937.–943. 53.
Blottière HM. Joël Doré J. Impact des nouveaux outils de métagénomique sur notre connaissance du microbiote intestinal et de son rôle en santé humaine : enjeux diagnostiques et thérapeutiques . Med Sci (Paris). 2016; ; 32 : :944.–951. 54.
Lagier JC, Raoult D. Culturomics : une méthode d’étude du microbiote humain . Med Sci (Paris). 2016; ; 32 : :923.–925. 55.
Dodet B. Les enjeux médicaux et sociétaux du microbiote . Med Sci (Paris). 2016; ; 32 : :1003.–1008. |