| |
| Med Sci (Paris). 32(12): 1056–1059. doi: 10.1051/medsci/20163212004.La molécule antivirale arbidol inhibe des virus pathogènes de prévalence mondiale Ève-Isabelle Pécheur1* and Stephen J. Polyak2 1Université de Lyon, Université Claude Bernard Lyon 1, Inserm 1052, CNRS 5286, Centre de Recherche en Cancérologie de Lyon, 151, cours Albert Thomas, 69003Lyon, France 2Departments of Laboratory Medicine and Global Health, University of Washington, Seattle, Washington, États-Unis MeSH keywords: Animaux, Antiviraux, Santé mondiale, Humains, Indoles, Prévalence, Spécificité d'espèce, Maladies virales, usage thérapeutique, statistiques et données numériques, traitement médicamenteux, épidémiologie, virologie |
À l’heure actuelle, il reste de nombreux virus de prévalence mondiale contre lesquels il n’existe ni traitement antiviral, ni vaccin. Certains de ces virus, comme le virus Ebola1, ou les membres du genre des Arenavirus2, à l’origine d’infections aiguës, causent des maladies hémorragiques sévères pouvant être fatales. D’autres, comme le virus de l’hépatite B (VHB) ou certains herpès virus, établissent des infections persistantes pouvant évoluer en maladies chroniques, dont le cancer. Afin de contrer ces virus, il apparaît donc nécessaire de pouvoir identifier une molécule à action antivirale qui soit abordable, efficace et sûre. L’arbidol, un antiviral qui est déjà utilisé en clinique dans plusieurs pays comme traitement anti-grippal, pourrait être un candidat. |
L’arbidol : un agent antiviral à large spectre L’arbidol a été initialement synthétisé dans les années 1970, en URSS3 (voir
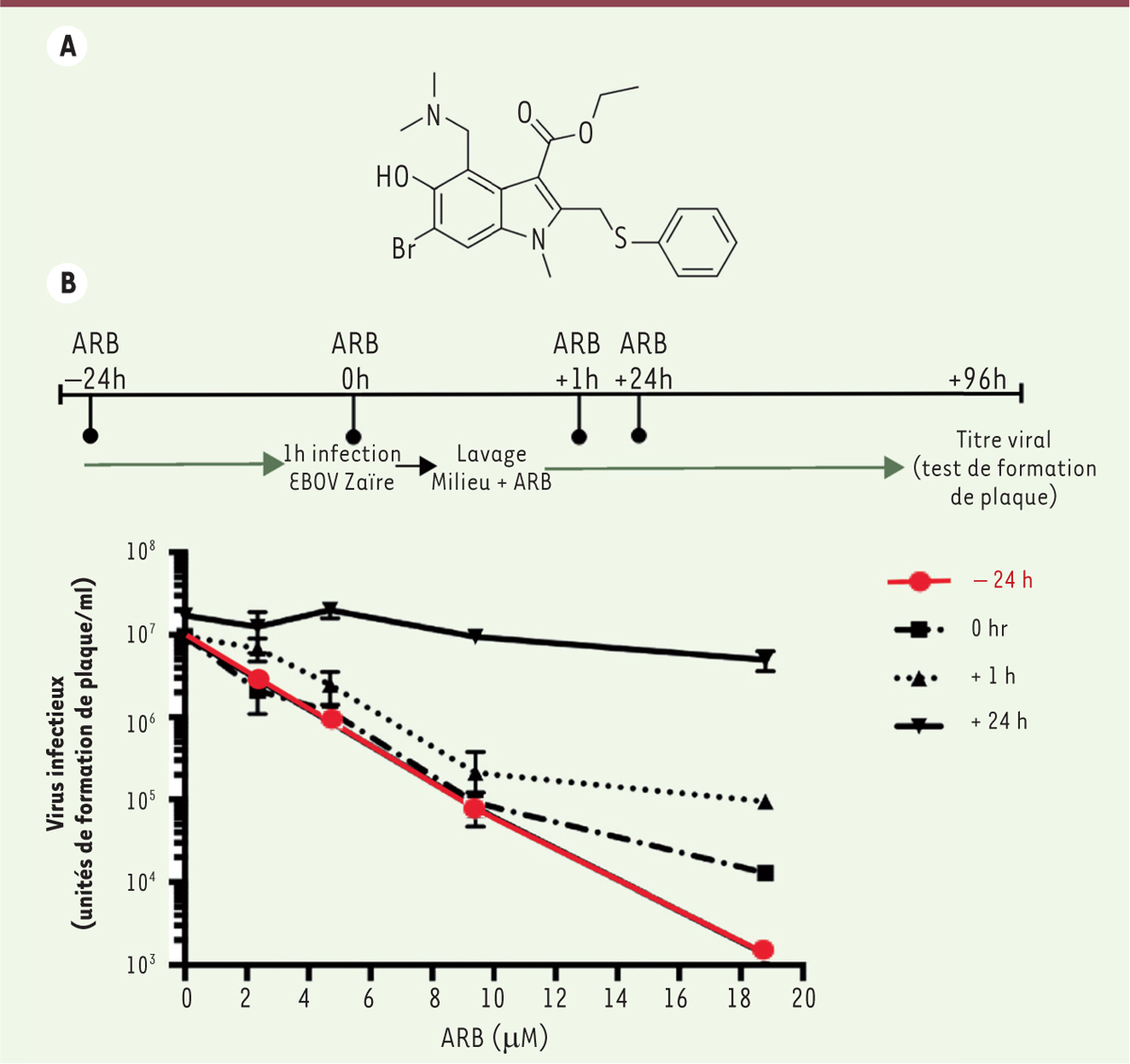
Figure 1A
pour sa structure chimique). Il y est commercialisé depuis plus de 20 ans pour la prophylaxie et le traitement de maladies pulmonaires humaines dues aux virus A et B de la grippe, ainsi que d’autres virus respiratoires pathogènes [1, 2]. Il est également utilisé en clinique en Chine depuis 2006 pour les mêmes indications ainsi que pour la prévention d’épidémies de grippe aviaire en médecine vétérinaire [3]. Son innocuité a été démontrée sur des périodes de traitement allant d’une semaine à quelques mois.
 | Figure 1.
L’arbidol inhibe un stade précoce du cycle infectieux du virus Ebola. A. Structure chimique de l’arbidol. B. Les hépatocytes HepG2 sont traités avec 0, 2,35, 4,7, 9,4 ou 18,8 μM d’arbidol (ARB) pendant 24 h avant infection (- 24 h), au moment de l’infection (0 h), 1 h (+ 1 h) ou 24 h (+ 24 h) après l’infection. Les cellules sont infectées avec le virus Ebola (EBOV) souche Zaïre pendant 1 h, puis du milieu frais contenant de l’arbidol est ajouté aux cultures. Un test de formation de plaques est effectué au bout de 96 h d’infection, pour évaluer le titre viral. |
Des études récentes ont montré l’efficacité de l’arbidol in vivo contre des virus responsables d’infections respiratoires (virus respiratoire syncytial, virus Coxsackie B5) ou contre le virus Hantaan qui cause une fièvre hémorragique accompagnée d’un syndrome rénal d’issue souvent fatale [3]. Ces études ayant été effectuées sur un petit nombre d’animaux, leur interprétation doit cependant rester prudente. Une étude récente fait en effet état d’une absence d’activité antivirale, à la dose utilisée in vivo, contre le virus de la fièvre hémorragique Crimée-Congo4. La réplication de ce virus est toutefois inhibée par l’arbidol in vitro [4]. Le spectre antiviral de l’arbidol in vitro s’élargit donc à des pathogènes émergents comme le coronavirus causant le syndrome respiratoire aigu sévère (SRAS), le virus Chikungunya, ainsi qu’aux virus des hépatites virales B et C [3]. Ces virus sont différents d’un point de vue structural (virus enveloppés ou non, à ADN ou ARN) et leurs cycles réplicatifs sont différents. Nous avons émis l’hypothèse que l’arbidol pourrait présenter une activité antivirale contre d’autres pathogènes, comme certains Arenavirus ou le virus Ebola, responsable de l’épidémie récente qui a touché plus de 28 000 personnes et est à l’origine de 11 000 décès5, et que son action pourrait cibler les particules virales et/ou la cellule infectée, en bloquant une(des) voie(s) intracellulaire(s) utilisée(s) par l’ensemble de ces virus au cours de leur cycle infectieux. L’arbidol inhibe l’infection par des virus de prévalence mondiale Nous avons étudié l’arbidol dans un programme de test antiviral in vitro de l’institut « Allergie et Maladies infectieuses » du NIH (NIAID, National institute of allergy and infectious diseases ; NIH, National institutes of health). Nous avons ainsi identifié une activité inhibitrice de l’arbidol pour les infections par l’Arenavirus Tacaribe, ainsi que par les herpès virus HHV-8 (herpèsvirus humain type 8), VHB et Ebola souche Zaïre [ 5]. Cette inhibition a été observée pour des doses efficaces bloquant 50 % de l’infection (CE 50) variant de 1 à 6 μM, sauf pour VHB où la CE 50 était de l’ordre de 20 μM. Ces doses sont comparables aux concentrations mesurées dans le plasma de sujets sains ayant reçu par voie orale une dose d’arbidol susceptible d’être administrée à des patients présentant un état grippal [ 3]. En outre, les index de sélectivité 6, mesurés in vitro variaient entre 6 et 40, ce qui indique une faible cytotoxicité de cette molécule. Dans l’infection par HHV-8, l’arbidol a démontré une efficacité antivirale équivalente à la molécule de référence, le cidofovir [ 5]. Concernant les virus Ebola et Tacaribe, responsables de fièvres hémorragiques létales et contre lesquels n’existe à ce jour aucun antiviral ni vaccin, l’arbidol pourrait constituer un espoir de lutte contre ces infections. L’arbidol inhibe les étapes précoces de l’infection par le virus Ebola Pour le virus Ebola souche Zaïre, nous avons approfondi nos études et réalisé des expériences de temps d’addition. L’arbidol est ajouté aux cellules avant infection, ou au moment de l’inoculation virale, ou à différents temps post-infection. Nous avons ainsi observé que l’action antivirale de l’arbidol s’exerçait de manière optimale quand la molécule était mise en contact avec les cellules avant l’inoculum viral [ 5] (Figure 1B). Cette observation suggérait que les étapes précoces de l’infection étaient ciblées par l’arbidol, c’est-à-dire les étapes de l’entrée virale (attachement des virions aux cellules, internalisation en compartiments intracellulaires, fusion membranaire). Pour affiner nos données, nous avons utilisé un modèle de pseudoparticules virales exprimant la glycoprotéine d’enveloppe du virus Ebola à leur surface. Ce modèle est bien adapté à l’étude de l’entrée virale, car, après leur internalisation intracellulaire, ces particules sont dépourvues de capacités réplicatives. Nous avons ainsi pu confirmer que l’arbidol ciblait l’entrée du virus Ebola dans ses cellules-hôte. |
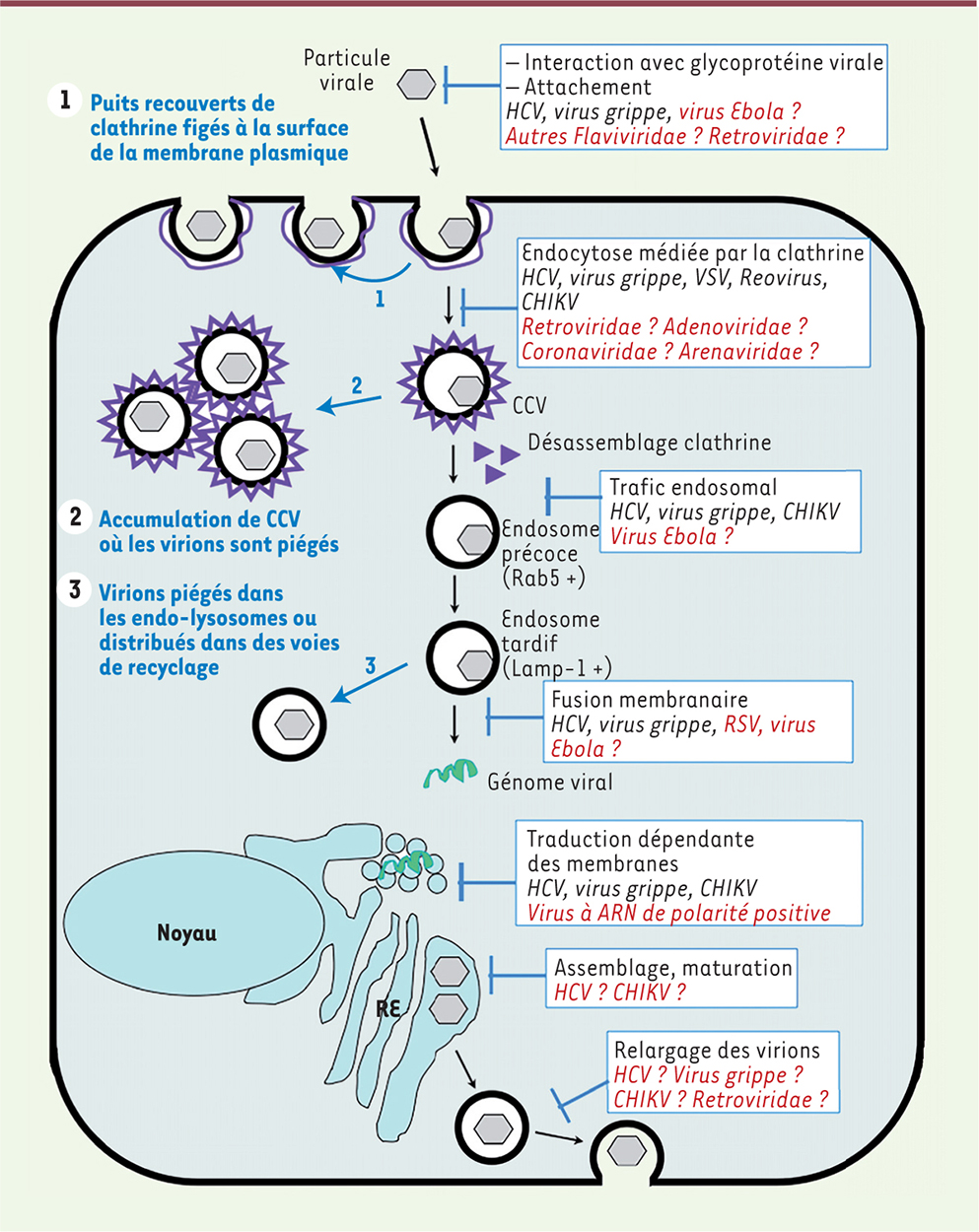
Mécanisme d’action antivirale de l’arbidol Du fait de son large spectre antiviral, deux hypothèses plausibles de mécanisme se dégagent pour expliquer l’effet inhibiteur de l’arbidol : (1) l’arbidol agirait sur les lipides et/ou les protéines composant les particules virales ; (2) l’arbidol agirait sur des cibles cellulaires. Ces hypothèses n’étant pas mutuellement exclusives, ceci rangerait l’arbidol dans la classe des agents antiviraux à action directe (direct antiviral agents, DAA) et/ou des agents ciblant l’hôte (host targeting agents, HTA). Nos études biochimiques, combinant des approches de RMN (résonance magnétique nucléaire) du solide, de spectroscopie de fluorescence, de résonance plasmonique de surface7 et d’imagerie, ont révélé que l’arbidol s’insère dans les membranes lipidiques artificielles (liposomes) et les rigidifie. Cette insertion se réalise d’autant mieux que le pH est acide, et avec une affinité de l’ordre du μM [6], réminiscente de la CE50 antivirale. L’arbidol montre également une affinité du même ordre pour les acides aminés aromatiques présents au sein d’une séquence polypeptidique. Ces acides aminés aromatiques sont notamment présents dans des régions de l’hémagglutinine de l’enveloppe du virus de la grippe ou de la glycoprotéine E2 de l’enveloppe du virus de l’hépatite C (VHC) [3, 6], régions impliquées dans l’entrée cellulaire et la fusion membranaire de ces deux virus. Ce mode d’action double, par incorporation dans les membranes d’une part (membrane virale dans ce cas), et par interaction avec les régions de protéines virales responsables de l’entrée et de la fusion virale d’autre part, rangerait l’arbidol dans la classe des DAA. L’hypothèse d’une action de type HTA a été testée dans le contexte de l’infection par VHC. Ce virus est internalisé dans ses cellules-cible, les hépatocytes, par endocytose dépendante de la clathrine [7, 8] (→).
(→) Voir la Nouvelle de E. Boucrot et H.T. McMahon, m/s n° 2, février 2011, page 122
La libération de son matériel génétique a ensuite lieu après abaissement du pH dans les endosomes et fusion des membranes virale et endosomale [9] (Figure 2). Nous avons montré que l’arbidol ralentissait l’endocytose des virions VHC et inhibait la fixation de la petite GTPase Rab5 sur les endosomes impliqués dans le trafic des virions [10, 11] (→).
(→) Voir la Nouvelle de J. Gilleron et al., m/s n° 12, décembre 2012, page 1041
 | Figure 2.
L’activité à large spectre de l’arbidol et ses mécanismes d’action moléculaire au niveau cellulaire. Les différentes étapes du cycle viral inhibées par l’arbidol sont indiquées dans des boîtes bleues. Les virus sur lesquels l’effet de l’arbidol est attesté sont indiqués en noir, l’effet potentiel de l’arbidol sur d’autres virus ou familles de virus est mentionné en rouge. Les flèches bleues et le texte indiquent les conséquences de l’effet de l’arbidol sur les voies cellulaires et les virions. Pour la clarté de la figure, et d’après les connaissances actuelles des mécanismes moléculaires d’action de l’arbidol, seule la voie de l’endocytose dépendante de la clathrine est montrée. VHC : virus de l’hépatite C ; VSV : virus de la stomatite vésiculaire ; CHIKV : virus Chikungunya ; RSV : virus respiratoire syncytial ; CCV : vésicule recouverte de clathrine ; RE : réticulum endoplasmique ; Lamp-1 : lysosomal-associated membrane protein 1 (droit de reproduction d’après [ 3], © n° de licence 3906600433506 du 12-07-2016). |
Ceci a pour effet de différer le moment auquel prend place la fusion virale ; les virions, n’ayant pas pu libérer leur nucléocapside, seraient alors dirigés vers des compartiments de dégradation de type lysosome [10]. L’arbidol inhibe également la scission membranaire induite par la dynamine-2, ce qui altère la formation des vésicules recouvertes de clathrine et donc l’endocytose dépendante de la clathrine. Dans l’état actuel de la littérature, l’arbidol montre une activité antivirale contre des virus pénétrant dans leurs cellules-hôte par des voies utilisant soit une acidification, soit l’action de la GTPase Rab5, soit l’action de la dynamine-2. L’internalisation du virus Ebola requiert une étape d’acidification endosomale, ainsi que l’intervention des petites GTPases Rab5 et Rab7 [12]. Cette étape et ces protéines pourraient donc être ciblées par l’arbidol, ce qui expliquerait l’inhibition observée sur les étapes précoces de l’entrée du virus Ebola (Figure 2). Étant donné que l’arbidol semble être le plus efficace lorsqu’il est administré avant ou au moment de la survenue de l’infection par le virus Ebola, et du fait de son innocuité démontrée en clinique, il pourrait être utilisé en prophylaxie dans les épidémies de fièvres hémorragiques, en limitant la dissémination virale chez les personnes en contact avec les malades (famille, personnel prodiguant les soins, etc.). Chez les patients infectés, l’administration d’arbidol pourrait permettre de circonscrire ou d’atténuer les symptômes de l’infection, en protégeant les cellules non infectées. Des recherches futures en ce sens pourraient donner l’espoir d’un traitement efficace et rapide à mettre en œuvre contre ces infections redoutables. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Boriskin YS, Leneva IA, Pécheur EI, Polyak SJ. Arbidol: a broad-spectrum antiviral compound that blocks viral fusion . Curr Med Chem. 2008; ; 15 : :997.–1005. 2.
Brooks MJ, Sasadeusz JJ, Tannock GA. Antiviral chemotherapeutic agents against respiratory viruses: where are we now and what’s in the pipeline? Curr Opin Pulm Med. 2004; ; 10 : :197.–203. 3.
Blaising J, Polyak SJ, Pécheur EI. Arbidol as a broad-spectrum antiviral: an update . Antiviral Res. 2014; ; 107 : :84.–94. 4.
Oestereich L, Rieger T, Neumann M, et al. Evaluation of antiviral efficacy of ribavirin, arbidol, and T-705 (favipiravir) in a mouse model for Crimean-Congo hemorrhagic fever . PLoS Negl Trop Dis. 2014; ; 8 : :e2804.. 5.
Pécheur EI, Borisevich V, Halfmann P, et al. The synthetic antiviral drug arbidol inhibits globally prevalent pathogenic viruses . J Virol. 2016; ; 90 : :3086.–3092. 6.
Teissier E, Zandomeneghi G, Loquet A, et al. Mechanism of inhibition of enveloped virus membrane fusion by the antiviral drug arbidol . PLoS One. 2011; ; 6 : :e15874.. 7.
Coller KE, Berger KL, Heaton NS, et al. RNA interference and single particle tracking analysis of hepatitis C virus endocytosis . PLoS Pathog. 2009; ; 5 : :e1000702.. 8.
Boucrot E, McMahon HT. Initiation de l’endocytose par vésicules de clathrine : des « sculpteurs de membrane » au travail . Med Sci (Paris). 2011; ; 27 : :122.–125. 9.
Blaising J, Lévy PL, Gondeau C, et al. Silibinin inhibits hepatitis C virus entry into hepatocytes by hindering clathrin-dependent trafficking . Cell Microbiol. 2013; ; 15 : :1866.–1882. 10.
Blaising J, Lévy PL, Polyak SJ, et al. Arbidol inhibits viral entry by interfering with clathrin-dependent trafficking . Antiviral Res. 2013; ; 100 : :215.–219. 11.
Gilleron J, Zeigerer A, Marsico G, et al. Rôle clé de la petite GTPase Rab5: de la biogenèse des endosomes au métabolisme du foie . Med Sci (Paris). 2012; ; 28 : :1041.–1044. 12.
Spence JS, Krause TB, Mittler E, et al. Direct visualization of Ebola virus fusion triggering in the endocytic pathway . MBio. 2016; ; 7 : :e01857.–e01815. |