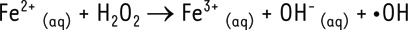| |
| Med Sci (Paris). 33(2): 176–182. doi: 10.1051/medsci/20173302013.Vieillissement moléculaire des protéines Quel rôle en physiopathologie ? Stéphane Jaisson,1,2* Aurore Desmons,1,2 Laëtitia Gorisse,1 and Philippe Gillery1,2 1Université de Reims Champagne-Ardenne, CNRS UMR 7369, Laboratoire de Biochimie Médicale et Biologie Moléculaire, UFR de Médecine, 51, rue Cognacq-Jay, 51095Reims Cedex, France 2Centre Hospitalier Universitaire de Reims, Pôle de Biologie Médicale et Pathologie, Laboratoire de Biologie et de Recherche Pédiatriques, 45, rue Cognacq-Jay, 51092Reims Cedex, France |
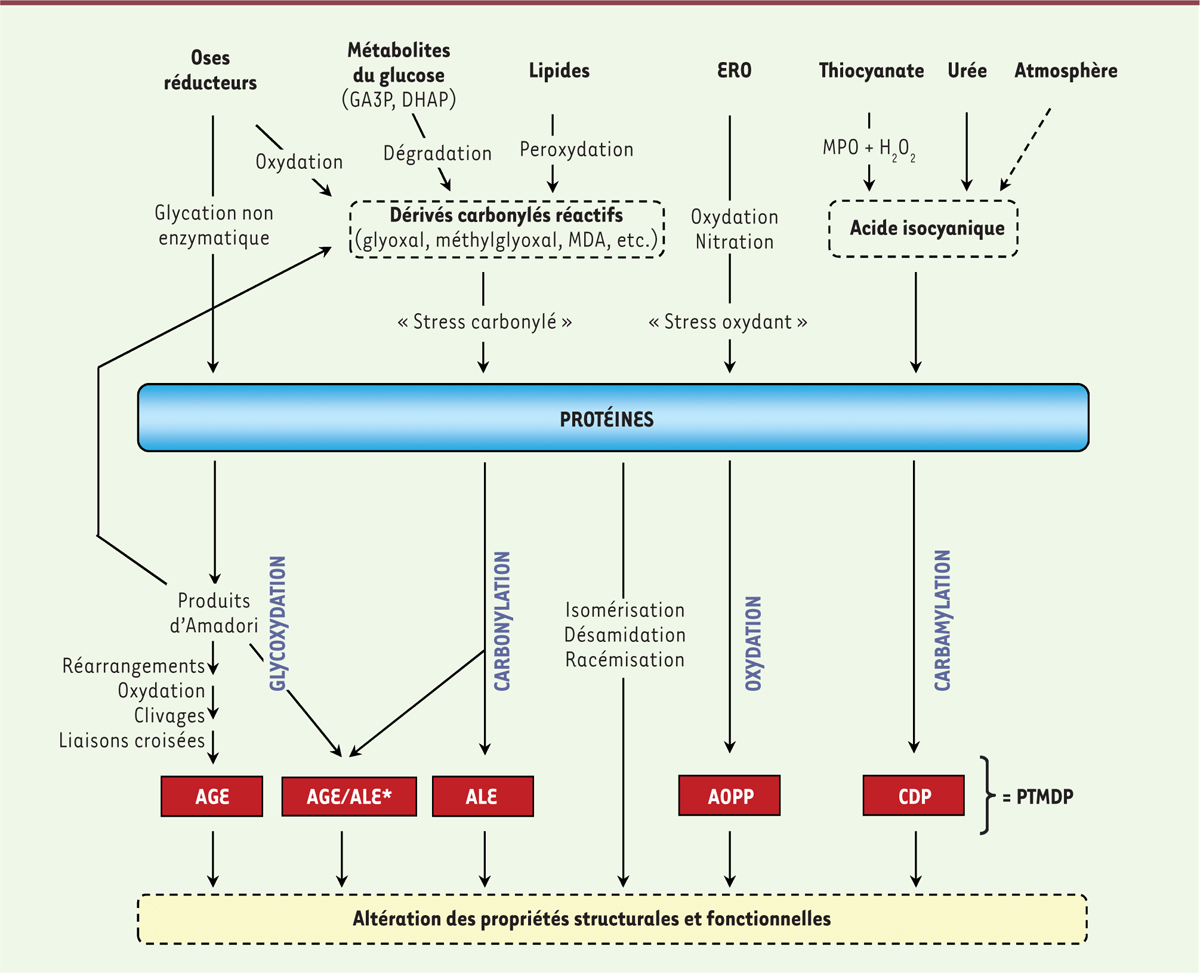
Tout au long de leur séjour dans les organismes vivants, les protéines sont exposées de manière cumulative à des réactions délétères qui contribuent progressivement à l’altération de leurs propriétés structurales et fonctionnelles, affectant leurs interactions moléculaires et cellulaires. Ces processus complexes font intervenir des modifications post-traductionnelles non enzymatiques (MPTNE), qui correspondent à la fixation de métabolites simples sur les groupements fonctionnels des protéines. Cumulatif et souvent irréversible, ce « vieillissement moléculaire des protéines » est impliqué dans le vieillissement de l’organisme et est amplifié dans certaines maladies chroniques comme le diabète sucré ou l’insuffisance rénale chronique (IRC), où il participe au développement de complications à long terme [1]. Il conduit à la formation d’un groupe hétérogène de composés appelés post-translational modifications derived products (ou PTMDP) (Figure 1).
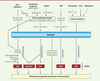 | Figure 1.
Réactions impliquées dans le vieillissement moléculaire des protéines. AGE : produits de glycation avancée ; ALE : produits de lipoxydation avancée ; AOPP : produits d’oxydation avancée des protéines ; CDP : produits de carbamylation ; DHAP : dihydroxyacétone-phosphate ; ERO : espèces réactives de l’oxygène ; GA3P : glycéraldéhyde-3-phosphate ; MDA : dialdéhyde malonique ; MPO : myéloperoxydase ; PTMDP : produits issus des modifications post-traductionnelles non enzymatiques. *AGE/ALE : Certains composés sont formés à la fois via la glycoxydation et via la carbonylation et peuvent être considérés comme AGE ou ALE (par exemple : N ε-carboxyméthyl-lysine) (traduit d’après [ 1]). |
|
Principales modifications post-traductionnelles non enzymatiques Oxydation La réaction d’oxydation compte parmi les plus importantes du vieillissement moléculaire des protéines puisqu’elle est capable de causer des dommages directs mais aussi de fournir de nombreux métabolites réactifs impliqués dans d’autres MPTNE, comme la carbonylation ou la glycoxydation (voir plus loin). Elle est due à l’action des espèces réactives de l’oxygène (ERO, ou reactive oxygen species [ROS] en anglais), et plus particulièrement des radicaux libres oxygénés (RLO) [ 2]. Les RLO sont formés à partir du dioxygène, oxydant puissant qui attire des électrons célibataires pour donner naissance à des espèces partiellement réduites. La chaîne de réduction monovalente du dioxygène qui consiste en l’addition un à un des électrons, permet la formation successive de l’ion superoxyde (O2
•-), du peroxyde d’hydrogène (H2O2) puis du radical hydroxyle (•OH). L’ion superoxyde peut être formé par différents mécanismes : soit au cours du métabolisme normal de l’oxygène dans la chaîne respiratoire mitochondriale, soit par voie enzymatique (NADPH [nicotinamide adénine dinucléotide phosphate réduit] oxydase, xanthine oxydase), ou encore par des réactions d’auto-oxydation non enzymatiques. Le peroxyde d’hydrogène est formé soit par réaction de dismutation enzymatique1, de l’ion superoxyde (par la superoxyde dismutase), soit par des réactions catalysées par des oxydases, présentes surtout dans les peroxysomes2,. Il est peu réactif mais est rapidement converti, en présence de métaux de transition, en radical hydroxyle •OH, qui est le plus réactif des RLO (réaction de Fenton3). Dans certaines situations, la production de RLO augmente fortement sans être contre-balancée par les systèmes antioxydants de défense, conduisant à un stress oxydant. Les RLO peuvent alors interagir avec les molécules environnantes, dont les protéines, pour provoquer le clivage de liaisons peptidiques ou former des produits d’oxydation avec les chaînes latérales des acides aminés. Les acides aminés soufrés et aromatiques sont les plus sensibles aux réactions d’oxydation. Enfin, l’oxydation des chaînes latérales d’acides aminés peut conduire à la formation de groupements hydroxyles ou carbonyles qui peuvent induire des réticulations intra- ou intermoléculaires4 [3]. Outre les RLO, les ERO comprennent aussi d’autres espèces radicalaires dérivant directement ou non de l’oxygène, comme l’ion hypochlorite OCl- ou le peroxynitrite ONOO-, qui présentent également une toxicité importante, notamment via des réactions de chloration ou de nitration. L’ensemble des composés issus de l’action des ERO sur les protéines sont regroupés sous le terme d’advanced oxidation protein products (ou AOPP), parmi lesquels la méthionine sulfoxyde, la dityrosine et la 3-nitrotyrosine [4]. Pour des informations complémentaires sur les RLO et le stress oxydant, on pourra se référer à la Synthèse parue en 2011 dans médecine/sciences [2] (→).
(→) Voir la Synthèse de C. Migdal et M. Serres, m/s n° 4, avril 2011, page 405
Carbonylation La carbonylation correspond à la fixation de dérivés carbonylés 5 ( reactive carbonyl compounds ou RCC) sur les protéines. La formation des RCC dépend en grande partie de mécanismes oxydatifs, dont le plus connu est la peroxydation lipidique. En effet, l’oxydation d’acides gras polyinsaturés conduit à la formation d’aldéhydes réactifs comme le dialdéhyde malonique (MDA) et des aldéhydes α,β-insaturés dont le 4-hydroxy-2-nonénal, le 4-oxo-2-nonénal et l’acroléine [ 5]. Les RCC peuvent se fixer directement sur les chaînes latérales des acides aminés (surtout des résidus de lysine, cystéine et histidine) via la formation d’une base de Schiff6, ou suite à une addition de Michael7 [6]. Comme la plupart des RCC dérivent de la peroxydation lipidique, les produits terminaux issus de la réaction de carbonylation sont fréquemment appelés advanced lipoxidation end-products (ALE). Les ALE les plus couramment décrits sont la 4-hydroxy-2-nonénal-lysine, la malondialdéhyde-lysine, la Nε-carboxyéthyl-lysine et des composés plus complexes comme des liaisons croisées de type pyrrole8, [6]. Glycation et glycoxydation La glycation est, avec l’oxydation, une des MPTNE les plus étudiées à ce jour. Cette réaction, qui est également appelée réaction de Maillard dans le monde de l’agroalimentaire, consiste en la fixation d’oses simples ou de leurs dérivés (par exemple phosphorylés) sur les groupements aminés des protéines [ 7]. L’étape initiale, souvent réversible, conduit à la formation d’une base de Schiff instable, qui subit par la suite un réarrangement moléculaire, dit d’Amadori, pour former une liaison cétoamine 9 stable. Les produits d’Amadori les plus connus et utilisés en médecine pour le suivi de l’équilibre glycémique chez les patients diabétiques sont l’HbA 1c (forme prépondérante de l’hémoglobine glyquée) et les fructosamines [ 8]. Dans des phases plus tardives, les produits d’Amadori subissent des modifications supplémentaires de type clivage ou cyclisation, qui génèrent un groupe de composés hétérogènes appelés advanced glycation end-products (ou AGE). Comme ces étapes tardives incluent de nombreux phénomènes oxydatifs, ce processus est souvent dénommé « glycoxydation » [9]. De nombreux AGE ont été identifiés dont la pentosidine ou la Nε-carboxyméthyl-lysine. D’autres AGE peuvent être également formés de façon indépendante par fixation de RCC, comme le glyoxal ou le méthylglyoxal, produits lors de la dégradation d’oses ou des métabolites associés (par exemple : le glycéraldéhyde-3-phosphate et la dihydroxyacétone-phosphate) [10]. Les RCC interagissent directement avec les résidus d’arginine pour former des AGE de type hydroimidazolone comme le glyoxal-hydroimidazolone-1, le méthylglyoxal-hydroimidazolone-1 ou l’argpyrimidine [11]. Même si le terme AGE est moins adapté dans ce cas car il s’agit plutôt de produits de carbonylation, ces composés sont néanmoins décrits comme AGE dans la littérature. Carbamylation La carbamylation se caractérise par l’addition non enzymatique d’un groupement « carbamoyl » (CONH 2) sur les groupements fonctionnels des acides aminés libres, des peptides et des protéines. La formation du groupement carbamoyl résulte majoritairement de l’interaction entre l’acide isocyanique, forme réactive du cyanate, et les groupements aminés des protéines. Cette réaction peut se produire sur les groupements α-NH 2 des acides aminés libres ou en position N-terminale des peptides et des protéines, mais également sur les groupements ε-NH 2 des chaînes latérales des résidus de lysine, générant alors un produit de carbamylation ( carbamylation derived-product, ou CDP) caractéristique, l’homocitrulline (HCit) [ 12]. L’acide isocyanique peut aussi interagir avec d’autres groupements, comme les groupements thiols ou phénols, mais de façon réversible [ 13]. Dans l’organisme, la source principale d’acide isocyanique est l’urée, qui se dissocie spontanément en milieux aqueux en cyanate et ammoniaque, selon un équilibre défavorable à cette dissociation (moins de 1 % de cyanate formé à l’équilibre). Cependant, le cyanate est produit de manière continue car, dès sa formation, il est transformé en acide isocyanique, qui réagit immédiatement avec les groupements aminés voisins. Une seconde voie de formation de l’acide isocyanique, probablement moins importante, est la transformation enzymatique du thiocyanate par la myéloperoxidase en présence de peroxyde d’hydrogène [14]. Le thiocyanate est apporté notamment par l’alimentation, et sa concentration sérique peut être augmentée chez les fumeurs. La myéloperoxidase étant très active dans les cellules inflammatoires, cette réaction se produirait préférentiellement au sein des plaques d’athérome [15]. Enfin, la possibilité d’un apport exogène d’acide isocyanique provenant de la combustion de biomasse a été décrite, mais cette source paraît mineure [16]. |
Conséquences du vieillissement moléculaire sur la structure et les fonctions des protéines Le vieillissement moléculaire peut conduire à de profondes modifications des propriétés structurales et fonctionnelles des protéines, et notamment altérer leurs interactions avec les cellules. Plusieurs exemples tirés de la littérature sont cités ci-dessous afin d’illustrer ce phénomène. Modification de structure et d’antigénicité des protéines La modification des chaînes latérales des acides aminés est à l’origine de changements de charge et d’un encombrement stérique plus important, qui se répercutent sur la structure tridimensionnelle des protéines. Par exemple, l’analyse par dichroïsme circulaire 10 de l’albumine glyquée a permis de mettre en évidence des changements conformationnels significatifs [ 17, 18]. Ces altérations structurales ont souvent pour conséquence de modifier la solubilité des protéines et d’entraîner leur agrégation, ce qui peut contribuer au développement de certaines pathologies [19]. Ainsi, la fixation de cholestérol oxydé (formant un dérivé carbonylé) sur le peptide β-amyloïde augmente son agrégation et donc sa neurotoxicité, contribuant ainsi au développement de la maladie d’Alzheimer [20]. Lorsque les protéines jouent un rôle important dans l’architecture tissulaire, comme les protéines de la matrice extracellulaire, leur vieillissement moléculaire est responsable d’une perte progressive des propriétés mécaniques des tissus concernés. Ainsi, le collagène devient beaucoup plus rigide sous l’effet de la glycation [21] qui réduit également les propriétés élastiques de l’élastine [22]. Enfin, les protéines modifiées peuvent constituer des néoantigènes à l’origine de réactions auto-immunes. La carbamylation des protéines du cartilage est responsable de la production d’auto-anticorps dirigés contre l’homocitrulline qui sont retrouvés dans le sérum de patients atteints de polyarthrite rhumatoïde [23]. Modification de la fonction des protéines Étant donné la relation étroite entre structure et fonction, les altérations structurales engendrées affectent quasi systématiquement les fonctions des protéines modifiées. Ainsi, de très nombreux facteurs de croissance, peptides ou hormones perdent leur activité après glycation ou carbamylation. Par exemple, l’insuline glyquée présente une action hypoglycémiante inférieure de 20 % à celle de l’insuline non modifiée [ 24]. De même, les activités enzymatiques des protéines sont en règle générale affectées par ces modifications. Par exemple, la diminution de l’activité glutamate déshydrogénase mitochondriale observée chez des rats âgés par rapport à des rats jeunes peut être expliquée par la carbonylation de l’enzyme par le méthylglyoxal [25]. Modification de sensibilité à la dégradation enzymatique Les changements structuraux des protéines modifiées peuvent altérer leur reconnaissance et donc leur catabolisme par les enzymes dont elles sont les substrats spécifiques. Ainsi, le collagène glyqué, qui présente de nombreux pontages formés par les AGE, présente une plus grande résistance à la pepsine [ 26]. De la même manière, notre équipe a montré que les modifications structurales de la triple hélice 11 induites par la carbamylation perturbaient l’accessibilité et l’affinité des métalloprotéinases matricielles pour le collagène, le rendant plus résistant aux collagénases et plus sensibles aux gélatinases [ 27]. Modification des interactions entre protéines Parallèlement aux interactions enzyme/substrat, d’autres modes d’interactions protéiques peuvent être impactés. Pour les protéines intracellulaires, il a été montré in vitro que la polymérisation de l’actine ainsi que la formation des microtubules étaient perturbées par la carbamylation [ 28, 29]. Pour les protéines matricielles, l’analyse du collagène de type I glyqué par microscopie électronique, ou à génération de seconde harmonique, a montré un épaississement et un diamètre irrégulier des fibres, conduisant à une désorganisation du réseau fibrillaire [ 30]. La glycation est également responsable d’une diminution des interactions entre collagène et protéoglycanes, qui perturbe l’adhérence et la migration cellulaires [ 31]. Modification des interactions entre protéines et cellules Les protéines modifiées peuvent afficher un comportement différent vis-à-vis de leurs récepteurs spécifiques. C’est le cas par exemple des lipoprotéines de basse densité (LDL) qui, lorsqu’elles sont oxydées et/ou carbamylées, présentent une affinité diminuée pour le récepteur des LDL mais augmentée pour les récepteurs de la famille des scavengers (éboueurs) des macrophages, ce qui constitue une des étapes initiales du processus athéromateux [ 14, 32]. Des interactions de ces protéines modifiées avec de nouveaux récepteurs peuvent conduire à l’activation de voies de signalisation spécifiques responsables d’effets délétères au niveau cellulaire et tissulaire. L’exemple le plus typique est le récepteur RAGE (receptor for advanced glycation end-products), récepteur multi-ligands capable de fixer les AGE et de déclencher un stress oxydant intracellulaire et l’expression de gènes codant des protéines impliquées dans la réaction inflammatoire [33]. De nombreuses études ont mis en évidence le rôle de l’interaction AGE-RAGE en physiopathologie comme responsable de dysfonctionnements cellulaires et tissulaires. Par exemple, l’activation de RAGE par les AGE peut conduire à la différenciation des cellules épithéliales des tubules rénaux en myofibroblastes, entraînant une fibrose tubulo-interstitielle [34]. Un mécanisme similaire a été observé pour les cellules musculaires lisses vasculaires, qui peuvent se différencier en ostéoblastes sous l’action des AGE [35]. |
Paramètres influençant le vieillissement moléculaire des protéines L’intensité du vieillissement moléculaire des protéines varie en fonction de nombreux paramètres liés aux caractéristiques des protéines, à leur environnement ou encore à la capacité des cellules à lutter contre ce phénomène. Les principaux paramètres pouvant influencer le vieillissement protéique sont les suivants. • La demi-vie des protéines Les MPTNE étant des réactions souvent cumulatives et irréversibles, les protéines à demi-vie longue sont plus particulièrement concernées par ce phénomène. Ainsi, les protéines de la matrice extracellulaire comme les collagènes et l’élastine, dont les demi-vies atteignent plusieurs dizaines d’années, constituent des cibles privilégiées du vieillissement moléculaire [ 36]. • La concentration des métabolites réactifs L’intensité des modifications protéiques est directement liée à la concentration des métabolites réactifs, qui peut être très différente entre les milieux intra- et extracellulaires. Certains contextes pathologiques peuvent entraîner l’augmentation des concentrations sériques de ces métabolites, comme l’insuffisance rénale chronique qui favorise la réaction de carbamylation en raison de l’augmentation de l’urémie. De même, la glycation est favorisée par l’hyperglycémie chronique au cours du diabète. • La réactivité des métabolites Les métabolites impliqués peuvent présenter une réactivité très différente vis-à-vis des groupements fonctionnels des protéines et induire un vieillissement moléculaire plus ou moins important. Par exemple, le ribose est un agent de glycation vingt fois plus puissant que le glucose [ 37], de même que les dérivés phosphorylés des oses (comme le glucose-6-phosphate) qui présentent souvent une réactivité supérieure [ 38]. Par ailleurs, les dérivés carbonylés figurent parmi les métabolites les plus réactifs. • Les propriétés des groupements fonctionnels Le taux de modifications d’une protéine dépend du nombre de groupements pouvant fixer les métabolites réactifs, de leur nature (et notamment leur pKa 12), de leur accessibilité et de leur environnement moléculaire proche (encombrement stérique). • Les paramètres physico-chimiques Ces réactions étant essentiellement chimiques et non enzymatiques, elles peuvent être influencées par des paramètres physico-chimiques comme le pH ou la température, même si ces paramètres varient peu dans l’organisme humain. • Les systèmes de protection L’organisme est capable de mettre en place des systèmes de défense visant à limiter le vieillissement moléculaire des protéines. On sait que les cellules sont dotées de systèmes anti-oxydants enzymatiques (superoxyde dismutase, catalase, glutathion peroxydase) ou non enzymatiques (glutathion réduit, vitamine E) efficaces. Elles sont également capables de métaboliser les dérivés carbonylés avant qu’ils ne se fixent sur les protéines grâce à une famille d’enzymes appelées glyoxalases [ 39]. • Les systèmes de réparation Des enzymes sont capables de réparer les protéines modifiées en fonction du type de modification, même si très peu de mécanismes ont été décrits à l’heure actuelle. Parmi ceux-ci, les méthionine sulfoxyde réductases permettent de restaurer les résidus de méthionine oxydés [ 40] ; la fructosamine-3-kinase est capable de déglyquer des protéines (si elles n’ont pas dépassé le stade de produits d’Amadori) en phosphorylant les fructosamines en position 3 [ 41]. Il est important de noter que ces systèmes enzymatiques sont intracellulaires. Ils ne permettent donc pas de réparer les protéines sériques ni les protéines de la matrice extracellulaire. |
Rôle du vieillissement moléculaire des protéines en physiopathologie Les MPTNE jouent un rôle important en physiopathologie en participant au vieillissement moléculaire des protéines puis, par répercussion, aux vieillissements cellulaire et tissulaire. L’accumulation des PTMDP au cours du vieillissement de l’organisme a été clairement démontrée, notamment au niveau de la peau et des vaisseaux [42–44] (→).
(→) Voir la Nouvelle de L. Gorisse et al., m/s n° 8-9, août-septembre 2016, page 684
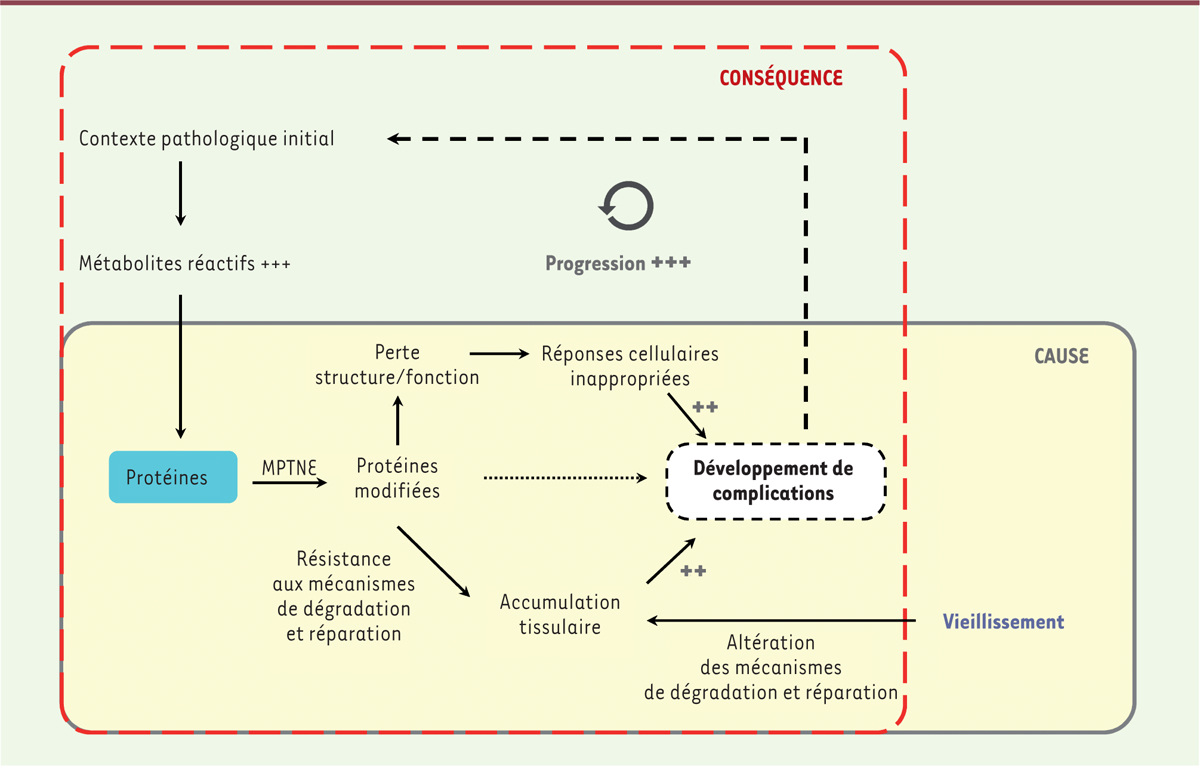
Cependant, les effets délétères de ces réactions ont été beaucoup plus étudiés dans des contextes physiopathologiques au cours desquels elles sont significativement amplifiées, parmi lesquels le diabète sucré, l’insuffisance rénale chronique, l’athérosclérose, la polyarthrite rhumatoïde ou encore les maladies neurodégénératives. Les mécanismes que nous avons détaillés précédemment permettent d’expliquer comment les PTMDP peuvent participer au développement de complications à long terme liées au vieillissement ou aux maladies chroniques. Le grand nombre d’études sur le rôle du vieillissement moléculaire en physiopathologie humaine ne permet pas d’en dresser une liste exhaustive dans le cadre de cette synthèse. En revanche, il est possible de proposer un schéma général décrivant le rôle du vieillissement moléculaire des protéines en physiopathologie (Figure 2). Pour cela, il faut au préalable répondre à la question suivante : ce phénomène est-il la cause ou la conséquence d’une pathologie donnée ? La réponse à cette question nécessite de distinguer le vieillissement normal de l’organisme de tout contexte pathologique responsable de l’amplification des MPTNE. En effet, au cours du vieillissement, ce phénomène progresse de façon lente mais continue, provoquant à long terme des pathologies. Les MPTNE en sont alors la cause. En revanche, dans le cas de pathologies accélérant une MPTNE donnée, le vieillissement moléculaire est une des conséquences de la pathologie, si bien que, dans ce cas, on assiste à une accélération du processus de vieillissement protéique lié aux MPTNE, responsable dans un second temps de l’apparition de complications (conséquence puis cause). Ainsi, dans les pathologies comme le diabète ou l’insuffisance rénale chronique, les MPTNE sont rarement la cause initiale de la pathologie mais en sont plutôt la conséquence dans un premier temps, avant de constituer, par la suite, un facteur d’aggravation et de progression de la maladie en favorisant l’apparition de complications à long terme.
 | Figure 2.
Représentation schématique du rôle du vieillissement moléculaire des protéines en physiopathologie humaine. Les modifications post-traductionnelles non enzymatiques (MPTNE) des protéines sont décrites pour leur implication dans le vieillissement de l’organisme et peuvent être identifiées comme une des causes principales de celui-ci. Dans le cas de maladies chroniques qui favorisent ces réactions par la formation accrue de métabolites réactifs, le vieillissement moléculaire des protéines est rarement la cause initiale de la pathologie mais en est plutôt la conséquence dans un premier temps, avant de constituer par la suite un facteur d’aggravation et de progression de la maladie par le biais du développement de complications à long terme. |
|
Les protéines subissent au cours de leur séjour dans l’organisme d’importants dommages causés par les MPTNE aboutissant à l’altération souvent irréversible de leurs propriétés. Bien que ce phénomène de vieillissement moléculaire des protéines ait longtemps été sous-estimé, il apparaît désormais comme un mécanisme prépondérant de vieillissement cellulaire et/ou tissulaire avec une implication reconnue dans de nombreux contextes physiopathologiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Jaisson S, Gillery P. Evaluation of nonenzymatic posttranslational modification-derived products as biomarkers of molecular aging of proteins . Clin Chem. 2010; ; 56 : :1401.–1412. 2.
Migdal C, Serres M. Espèces réactives de l’oxygène et stress oxydant . Med Sci (Paris). 2011; ; 27 : :405.–412. 3.
Hohn A, Konig J, Grune T. Protein oxidation in aging and the removal of oxidized proteins . J Proteomics. 2013; ; 92 : :132.–159. 4.
Witko-Sarsat V, Gausson V, Descamps-Latscha B. Are advanced oxidation protein products potential uremic toxins? Kidney Int. 2003; ((suppl)) : :S11.–S14. 5.
Grimsrud PA, Xie H, Griffin TJ, Bernlohr DA. Oxidative stress and covalent modification of protein with bioactive aldehydes . J Biol Chem. 2008; ; 283 : :21837.–21841. 6.
Negre-Salvayre A, Coatrieux C, Ingueneau C, Salvayre R. Advanced lipid peroxidation end products in oxidative damage to proteins. Potential role in diseases and therapeutic prospects for the inhibitors . Br J Pharmacol. 2008; ; 153 : :6.–20. 7.
Tessier FJ. The Maillard reaction in the human body. The main discoveries and factors that affect glycation . Pathol Biol (Paris). 2010; ; 58 : :214.–219. 8.
Sacks DB, Bruns DE, Goldstein DE, et al. Guidelines and recommendations for laboratory analysis in the diagnosis and management of diabetes mellitus . Clin Chem. 2002; ; 48 : :436.–472. 9.
Baynes JW. Role of oxidative stress in development of complications in diabetes . Diabetes. 1991; ; 40 : :405.–412. 10.
Rabbani N, Thornalley PJ. Dicarbonyl stress in cell and tissue dysfunction contributing to ageing and disease . Biochem Biophys Res Commun. 2015; ; 458 : :221.–226. 11.
Rabbani N, Thornalley PJ. The dicarbonyl proteome : proteins susceptible to dicarbonyl glycation at functional sites in health, aging, and disease . Ann NY Acad Sci. 2008; ; 1126 : :124.–127. 12.
Jaisson S, Pietrement C, Gillery P. Carbamylation-derived products : bioactive compounds and potential biomarkers in chronic renal failure and atherosclerosis . Clin Chem. 2011; ; 57 : :1499.–1505. 13.
Stark GR, Stein WH, Moore S. Reaction of cyanate present in aqueous urea with amino acids and proteins . J Biol Chem. 1960; ; 235 : :3177.–3181. 14.
Wang Z, Nicholls SJ, Rodriguez ER, et al. Protein carbamylation links inflammation, smoking, uremia and atherogenesis . Nat Med. 2007; ; 13 : :1176.–1184. 15.
Sirpal S. Myeloperoxidase-mediated lipoprotein carbamylation as a mechanistic pathway for atherosclerotic vascular disease . Clin Sci (Lond). 2009; ; 116 : :681.–695. 16.
Roberts JM, Veres PR, Cochran AK, et al. Isocyanic acid in the atmosphere and its possible link to smoke-related health effects . Proc Natl Acad Sci USA. 2011; ; 108 : :8966.–8971. 17.
Raghav A, Ahmad J, Alam K. Impact of glycation on structural and antioxidant function of human serum albumin : relevance in diabetic complications . Diabetes Metab Syndr. 2016; ; 10 : :96.–101. 18.
Simons ER, Hartzband P, Whitin J, Chapman C. Circular dichroism studies of cyanate-induced conformational changes in hemoglobins A and S . Biochemistry. 1976; ; 15 : :4059.–4064. 19.
Jaisson S, Gillery P. Impaired proteostasis : role in the pathogenesis of diabetes mellitus . Diabetologia. 2014; ; 57 : :1517.–1527. 20.
Usui K, Hulleman JD, Paulsson JF, et al. Site-specific modification of Alzheimer’s peptides by cholesterol oxidation products enhances aggregation energetics and neurotoxicity . Proc Natl Acad Sci USA. 2009; ; 106 : :18563.–18568. 21.
Reddy GK, Stehno-Bittel L, Enwemeka CS. Glycation-induced matrix stability in the rabbit achilles tendon . Arch Biochem Biophys. 2002; ; 399 : :174.–180. 22.
Yoshinaga E, Kawada A, Ono K, et al. N(epsilon)-(carboxymethyl)lysine modification of elastin alters its biological properties : implications for the accumulation of abnormal elastic fibers in actinic elastosis . J Invest Dermatol. 2012; ; 132 : :315.–323. 23.
Shi J, Knevel R, Suwannalai P, et al. Autoantibodies recognizing carbamylated proteins are present in sera of patients with rheumatoid arthritis and predict joint damage . Proc Natl Acad Sci USA. 2011; ; 108 : :17372.–17377. 24.
Boyd AC, Abdel-Wahab YH, McKillop AM, et al. Impaired ability of glycated insulin to regulate plasma glucose and stimulate glucose transport and metabolism in mouse abdominal muscle . Biochim Biophys Acta. 2000; ; 1523 : :128.–134. 25.
Hamelin M, Mary J, Vostry M, et al. Glycation damage targets glutamate dehydrogenase in the rat liver mitochondrial matrix during aging . FEBS J. 2007; ; 274 : :5949.–5961. 26.
Tian SF, Toda S, Higashino H, Matsumura S. Glycation decreases the stability of the triple-helical strands of fibrous collagen against proteolytic degradation by pepsin in a specific temperature range . J Biochem. 1996; ; 120 : :1153.–1162. 27.
Jaisson S, Larreta-Garde V, Bellon G, et al. Carbamylation differentially alters type I collagen sensitivity to various collagenases . Matrix Biol. 2007; ; 26 : :190.–196. 28.
Kuckel CL, Lubit BW, Lambooy PK, Farnsworth PN. Methylisocyanate and actin polymerization : the in vitro effects of carbamylation . Biochim Biophys Acta. 1993; ; 1162 : :143.–148. 29.
Mellado W, Slebe JC, Maccioni RB. Tubulin carbamoylation. Functional amino groups in microtubule assembly . Biochem J. 1982; ; 203 : :675.–681. 30.
Bai P, Phua K, Hardt T, et al. Glycation alters collagen fibril organization . Connect Tissue Res. 1992; ; 28 : :1.–12. 31.
Reigle KL, Di Lullo G, Turner KR, et al. Non-enzymatic glycation of type I collagen diminishes collagen-proteoglycan binding and weakens cell adhesion . J Cell Biochem. 2008; ; 104 : :1684.–1698. 32.
Apostolov EO, Ok E, Burns S, et al. Carbamylated-oxidized LDL : proatherosclerotic effects on endothelial cells and macrophages . J Atheroscler Thromb. 2013; ; 20 : :878.–892. 33.
Yan SF, Ramasamy R, Schmidt AM. The RAGE axis : a fundamental mechanism signaling danger to the vulnerable vasculature . Circ Res. 2010; ; 106 : :842.–853. 34.
Oldfield MD, Bach LA, Forbes JM, et al. Advanced glycation end products cause epithelial-myofibroblast transdifferentiation via the receptor for advanced glycation end products (RAGE) . J Clin Invest. 2001; ; 108 : :1853.–1863. 35.
Tanikawa T, Okada Y, Tanikawa R, Tanaka Y. Advanced glycation end products induce calcification of vascular smooth muscle cells through RAGE/p38 MAPK . J Vasc Res. 2009; ; 46 : :572.–580. 36.
Verzijl N, DeGroot J, Thorpe SR, et al. Effect of collagen turnover on the accumulation of advanced glycation end products . J Biol Chem. 2000; ; 275 : :39027.–39031. 37.
Bunn HF, Higgins PJ. Reaction of monosaccharides with proteins : possible evolutionary significance . Science. 1981; ; 213 : :222.–224. 38.
Sharma SD, Pandey BN, Mishra KP, Sivakami S. Amadori product and age formation during nonenzymatic glycosylation of bovine serum albumin in vitro . J Biochem Mol Biol Biophys. 2002; ; 6 : :233.–242. 39.
Thornalley PJ, Glyoxalase I. structure, function and a critical role in the enzymatic defence against glycation . Biochem Soc Trans. 2003; ; 31 : :1343.–1348. 40.
Boschi-Muller S, Branlant G. Methionine sulfoxide reductase : chemistry, substrate binding, recycling process and oxidase activity . Bioorg Chem. 2014; ; 57 : :222.–230. 41.
Delpierre G, Rider MH, Collard F, et al. Identification, cloning, and heterologous expression of a mammalian fructosamine-3-kinase . Diabetes. 2000; ; 49 : :1627.–1634. 42.
Gorisse L, Pietrement C, Vuiblet V, et al. Protein carbamylation is a hallmark of aging . Proc Natl Acad Sci USA. 2016; ; 113 : :1191.–1196. 43.
Simm A. Protein glycation during aging and in cardiovascular disease . J Proteomics. 2013; ; 92 : :248.–259. 44.
Gorisse L, Jaisson S, Pietrement C, Gillery P. Carbamylation des protéines : quand vieillissements protéique et chronologique se rejoignent . Med Sci (Paris). 2016; ; 32 : :684.–686. |