| |
| Med Sci (Paris). 33(5): 486–488. doi: 10.1051/medsci/20173305009.Addiction des systèmes toxine-antitoxine envers un chaperon chez Mycobacterium tuberculosis Patricia Bordes1 and Pierre Genevaux1* 1Laboratoire de microbiologie et de génétique moléculaires, centre de biologie intégrative (CBI), université de Toulouse, CNRS, 118, route de Narbonne, 31062Toulouse Cedex 9, France |
Les systèmes toxine-antitoxine (TA) sont des modules génétiques typiquement constitués d’une toxine protéique et d’une antitoxine antagoniste qui inhibe l’activité ou l’expression de sa toxine associée. Leurs gènes sont situés de façon ubiquitaire sur les chromosomes et les plasmides, et ces systèmes ont été classés en 6 types en fonction du mode d’action de la toxine. Les systèmes TA de type II sont les plus répandus et sont composés d’une antitoxine protéique labile qui interagit directement avec la toxine pour l’inhiber. Lorsque les cellules sont stressées, l’antitoxine est dégradée, libérant ainsi la toxine active qui peut alors cibler des processus cellulaires vitaux et aboutir à une inhibition de la croissance bactérienne. Cette inhibition est souvent réversible par néo-synthèse de l’antitoxine et il a été proposé que de tels cycles d’activation des TA pourraient faciliter la survie bactérienne en réponse aux agressions environnementales [1, 2]. Ainsi, les systèmes TA sont impliqués dans les défenses contre les infections par les phages, fonctionnent comme des modules anti-addiction contre les toxines plasmidiques, stabilisent des régions génomiques, régulent la réponse générale aux stress et sont des acteurs clé de la virulence bactérienne et de la persistance. |
Nombreux systèmes toxine-antitoxine chez le pathogène humain Mycobacterium tuberculosisLa tuberculose est la maladie la plus mortelle causée par un seul pathogène bactérien, Mycobacterium tuberculosis
1 [3] (→). En plus d’une synergie mortelle avec le VIH (virus de l’immunodéficience humaine) et de l’émergence de souches multi-résistantes, l’un des freins à l’éradication de la tuberculose est la capacité de M. tuberculosis à persister dans les poumons en état de dormance et en étant tolérante au système immunitaire de l’hôte et aux traitements antibiotiques. M. tuberculosis possède un nombre remarquablement élevé de systèmes TA (plus de 79) en comparaison avec les autres mycobactéries, et il a été proposé que la persistance induite par les toxines actives pourrait contribuer à sa pathogénicité. De manière intéressante, l’analyse transcriptomique de M. tuberculosis dans un modèle de persistance provoquée par des antibiotiques a montré, outre un arrêt global des voies métaboliques, que l’expression d’au moins 10 systèmes TA était augmentée [4], renforçant l’hypothèse d’un rôle des TA dans la persistance de M. tuberculosis.
(→) Voir l’édito de Camille Locht, m/s n° 6-7, juin-juillet 2016, page 535
|
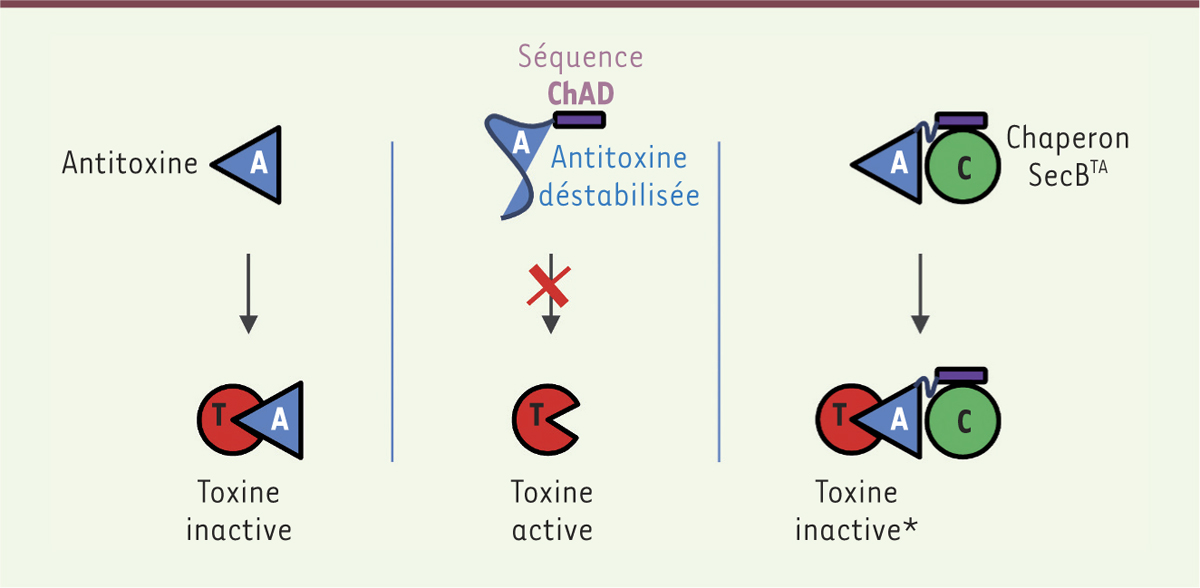
Systèmes toxine-antitoxine atypiques à 3 composants toxine-antitoxine-chaperon Les systèmes tripartites toxine-antitoxine-chaperon (TAC) sont des modules TA atypiques comprenant un système TA de type II et un chaperon moléculaire apparenté au chaperon canonique SecB impliqué dans l’export des protéines chez les bactéries [5, 6]. Le système TAC le mieux caractérisé à ce jour est celui de M. tuberculosis. Il se compose de trois gènes localisés au sein du même opéron, Rv1955-Rv1956-Rv1957, codant respectivement la paire toxine-antitoxine HigB1-HigA1 (host inhibition of growth) et le chaperon de type SecB. La transcription de ces trois gènes de TAC est induite lorsque M. tuberculosis est phagocytée ou lorsque la bactérie est soumise à divers stress, dont les dommages à l’ADN, le choc thermique, les carences nutritionnelles, l’hypoxie ou encore la persistance en réponse aux antibiotiques. En outre, l’expression ectopique de la toxine HigB1 inhibe de manière drastique la croissance de M. tuberculosis, M. marinum, M. smegmatis et Escherichia coli, et affecte les niveaux de plus de 30 transcrits chez M. tuberculosis. Nos travaux précédents ont montré que HigBA1 forme un système TA bona fide contrôlé spécifiquement par le chaperon de type SecB. L’interaction directe entre le chaperon SecB et l’antitoxine permet le repliement de l’antitoxine et sa protection contre la dégradation et, par conséquent, l’inhibition de la toxine (Figure 1) [7]. Récemment, nous avons utilisé le système TAC de M. tuberculosis comme modèle pour élucider un nouveau mécanisme permettant de convertir des systèmes TA classiques en systèmes dépendant d’un chaperon.
 | Figure 1.
Mécanisme d’addiction au chaperon chez les systèmes toxine-antitoxine. Dans le cas d’un système toxine-antitoxine « classique » à deux composants (TA), l’antitoxine se fixe à la toxine et inhibe son activité (partie gauche). Dans le cas du système toxine-antitoxine-chaperon (TAC), l’extension ChAD (chaperone addiction sequence) déstabilise l’antitoxine, l’empêchant ainsi d’inhiber la toxine (comme représenté au centre). Le chaperon SecB dédié se fixe à la séquence ChAD et stabilise l’antitoxine, facilitant son interaction avec la toxine (comme représenté à droite). L’étoile (*) indique que la présence du chaperon dans le complexe final n’est pas démontrée. |
|
Phénomène d’addiction à un chaperon L’analyse des systèmes TAC au sein des génomes bactériens a montré que les chaperons de type SecB peuvent être en association avec plusieurs familles de TA classiques à 2 composants comme HigBA, MqsRA (motility quorum sensing regulator) et HicAB (hif contiguous) [6]. La comparaison par alignement des séquences protéiques indique qu’en plus de domaines relativement bien conservés comme celui de liaison à l’ADN, les antitoxines TAC possèdent une extension C-terminale absente chez leurs homologues des systèmes à deux composants, qui est variable à la fois en longueur et en séquence. L’extension C-terminale des antitoxines TAC joue un rôle majeur dans le recrutement de leur chaperon de type SecB associé, sa délétion abolissant l’interaction avec le chaperon in vivo et in vitro. En outre, l’antitoxine HigA1 de TAC dont l’extension C-terminale a été éliminée est capable de contrecarrer les effets toxiques de la toxine HigB1 chez les mycobactéries en absence de chaperon [8], confirmant ainsi que cette nouvelle région, nommée ChAD (chaperone addiction sequence), confère une addiction au chaperon (Figure 1). Nous pensons que ce mécanisme original impliquant la reconnaissance spécifique SecB/ChAD pourrait ajouter un niveau de régulation post-traductionnelle des systèmes TA dans lequel la titration du chaperon déclencherait l’activation de la toxine. |
L’addiction au chaperon peut être transmise De manière intéressante, nous avons montré que des paires ChAD/SecB peuvent fonctionner comme des entités indépendantes, pouvant être greffées sur des systèmes TA classiques à 2 composants d’autres bactéries (HigBA2 de Vibrio cholerae, MqsRA d’Escherichia coli et HicAB de Treponema denticola) et les rendre strictement dépendantes d’un chaperon. De la même façon, l’addiction au chaperon peut être transmise à des protéines non apparentées comme la luciférase ou encore la GFP (green fluorescent protein). Il est particulièrement remarquable que la séquence ChAD puisse être aussi greffée de manière fonctionnelle en position N-terminale de ces protéines. La greffe d’un module ChAD/chaperon de type SecB sur des cibles protéiques spécifiques pourrait donc représenter un outil précieux, à visée technologique ou médicale, pour optimiser l’expression et le repliement de protéines hétérologues difficiles à exprimer chez E. coli [9]. Étant donné qu’un nombre significatif de protéines de type SecB (plus de 7 %) sont en association avec des systèmes TA, cela représente un réservoir important de séquences ChAD/SecB [10]. |
Chaperons TAC : lien entre activation d’une toxine et export des protéines ? Tous les chaperons de type SecB testés jusqu’à présent remplacent efficacement le chaperon d’export SecB d’E. coli in vivo [6-8], suggérant que les TAC pourraient constituer les premiers représentants d’un couplage entre activation d’un système TA et sécrétion des protéines. Une hypothèse séduisante est que l’induction de l’agrégation des pré-protéines en conditions de stress ou la synthèse de novo de protéines sécrétoires spécifiques pourrait titrer le chaperon de type SecB d’un système TAC pour aboutir à l’activation transitoire de la toxine pour des raisons adaptatives [7]. Ce double rôle pourrait aussi impliquer que les propriétés des chaperons SecB puissent être remodelées efficacement afin d’accommoder spécifiquement des extensions ChAD extrêmement différentes sans perdre leur aptitude à lier fonctionnellement un large éventail de substrats pré-sécrétoires. Des données antérieures montrant que SecB possède une surface de liaison au substrat pouvant accommoder de très longs segments au sein des polypeptides, suggèrent que des changements mineurs de sa surface pourrait spécialiser le chaperon envers une séquence ChAD sans affecter de manière détectable les propriétés de chaperon générique [11]. Des travaux complémentaires seront nécessaires afin d’élucider ce mécanisme unique de plasticité d’une protéine chaperon. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Sala A, Bordes P, Genevaux P Multiple toxin-antitoxin systems in Mycobacterium tuberculosis . Toxins. 2014; ; 6 : :1002.–1020. 2.
Yamaguchi Y, Park JH, Inouye M Toxin-antitoxin systems in bacteria and archaea . Annu Rev Genet. 2011; ; 45 : :61.–79. 3.
La Locht C. tuberculose, une histoire toujours d’actualité . Med Sci (Paris). 2016; ; 32 : :535.–536. 4.
Keren I, Minami S, Rubin E, Lewis K Characterization and transcriptome analysis of Mycobacterium tuberculosis persisters . MBio. 2011; ; 2 : :e00100.–e00111. 5.
Castanie-Cornet MP, Bruel N, Genevaux P Chaperone networking facilitates protein targeting to the bacterial cytoplasmic membrane . Biochim Biophys Acta. 2014; ; 1843 : :1442.–1456. 6.
Sala A, Calderon V, Bordes P, et al. TAC from Mycobacterium tuberculosis: a paradigm for stress-responsive toxin-antitoxin systems controlled by SecB-like chaperones . Cell Stress Chaperones. 2013; ; 18 : :129.–135. 7.
Bordes P, Cirinesi AM, Ummels R, et al. SecB-like chaperone controls a toxin-antitoxin stress-responsive system in Mycobacterium tuberculosis . Proc Natl Acad Sci U S A. 2011; ; 108 : :8438.–8443. 8.
Bordes P, Sala AJ, Ayala S, et al. Chaperone addiction of toxin-antitoxin systems . Nat Commun. 2016; ; 7 : :13339.. 9.
Schlegel S, Genevaux P, de Gier JW Isolating Escherichia coli strains for recombinant protein production . Cell Mol Life Sci. 2017; ; 74 : :891.–908. 10.
Sala A, Bordes P, Genevaux P Multitasking SecB chaperones in bacteria . Front Microbiol. 2014; ; 5 : :666.. 11.
Khisty VJ, Munske GR, Randall LL Mapping of the binding frame for the chaperone SecB within a natural ligand, galactose-binding protein . J Biol Chem. 1995; ; 270 : :25920.–25927. |