| |
| Med Sci (Paris). 33(5): 534–542. doi: 10.1051/medsci/20173305018.Les cellules lymphoïdes innées Adeline Crinier,1*# Charlotte Viant,1* Mathilde Girard-Madoux,1 and Éric Vivier1,2 1Aix Marseille Université, CNRS, Inserm, CIML, Marseille, France 2APHM, Hôpital de la Timone, Service d’immunologie, Marseille, France |
Vignette (Photo © Inserm – Nabila Jabrane-Ferrat). Les cellules lymphoïdes innées (ILC pour innate lymphoid cells) sont une composante nouvellement décrite du système immunitaire. Elles contribuent à la mise en place d’une réponse immunitaire rapide à la suite des agressions auxquelles l’organisme peut être confronté qu’elles soient d’origine virale, bactérienne, parasitaire ou cancéreuse. Les ILC sont composées des cellules natural killer (NK), des lymphoid tissue inducer cells (LTi), des ILC1, des ILC2 et des ILC3 [1] (→).
(→) Voir la Synthèse de M. Cherrier, m/s n° 3, mars 2014, page 280
|
Découverte des ILC La découverte des ILC est récente au regard de toutes les recherches menées sur les cellules lymphoïdes depuis celle des leucocytes en 1843 par G. Andral et W. Addison [ 2]. Ce n’est en effet qu’en 1975 que R. Kiessling, R.B. Herberman et leurs collaborateurs mirent en évidence la première population de cellules lymphocytaires innées : les cellules natural killer (NK) [ 3, 4]. Par la suite, en 1997, R.E. Mebius et ses collaborateurs montrèrent l’existence d’une deuxième population de cellules lymphocytaires innées, les lymphoid tissue inducer cells (LTi) [ 5]. Les cellules NK et LTi sont restées les seuls types de lymphocytes innés connus jusqu’à ce qu’une dizaine d’équipes révèlent simultanément l’existence de tout un pan de l’immunologie jusqu’alors inconnu. Une série d’articles, parus entre 2008 et 2011, montre en effet l’existence de nouvelles cellules lymphocytaires innées alors dénommées, entre autres, NK22, ROR( retinoic acid receptor related orphan receptor)γt + NKp46 +, NK-LTi, nuocytes ou encore natural helper cells [ 6– 12]. Très rapidement, en recoupant leurs caractéristiques, ces cellules nouvellement identifiées ont été classées en trois catégories : les ILC de type 1 (dont font partie les cellules NK), les ILC de type 2 et les ILC de type 3 (dont font partie les LTi) [ 13]. Nomenclature des ILC Contrairement aux lymphocytes T et B du système immunitaire adaptatif, les ILC n’expriment pas de récepteur de l’antigène, produit de réarrangements géniques dépendants des recombinases RAG ( recombination activating gene) [ 1] ( →). Toutefois, il existe de fortes similarités entre les ILC et les lymphocytes T activés en ce qui concerne les facteurs de transcription et les cytokines produites. C’est pourquoi la nomenclature des lymphocytes T auxiliaires a été utilisée pour l’établissement de celle des ILC. Ainsi, les ILC de type 1 (ILC1 et NK) et les lymphocytes T auxiliaires du type 1 (Th1) expriment le facteur de transcription T-bet ( T-box expressed in T cells) et sécrètent de l’IFN(interféron)-γ ; les ILC2 et les lymphocytes Th2 expriment le facteur de transcription GATA-3 ( GATA binding protein 3) et sécrètent les interleukines 5 (IL-5) et 13 (IL-13) ; et les ILC de type 3 (ILC3 et LTi) comme les lymphocytes Th17/Th22, expriment le facteur de transcription RORγt et sécrètent de l’IL-17 et/ou de l’IL-22. Les ILC3 forment en fait un groupe hétérogène dont les membres se distinguent par l’expression des récepteurs activateurs NCR ( natural cytotoxicity receptors). On différencie ainsi les ILC3 NCR + qui expriment à leur surface la protéine NKp46 chez la souris, et NKp44 chez l’homme, des ILC3 NCR - qui n’expriment pas de NCR à leur membrane. Comme pour les lymphocytes T, on distingue les ILC cytotoxiques (les NK) des ILC auxiliaires (ILC1, ILC2 et ILC3). Cette dichotomie est toutefois à nuancer. Les ILC1 peuvent en effet adopter dans certains tissus, un comportement cytotoxique via TRAIL ( tumor necrosis factor related apoptosis inducing ligand) [ 14]. |
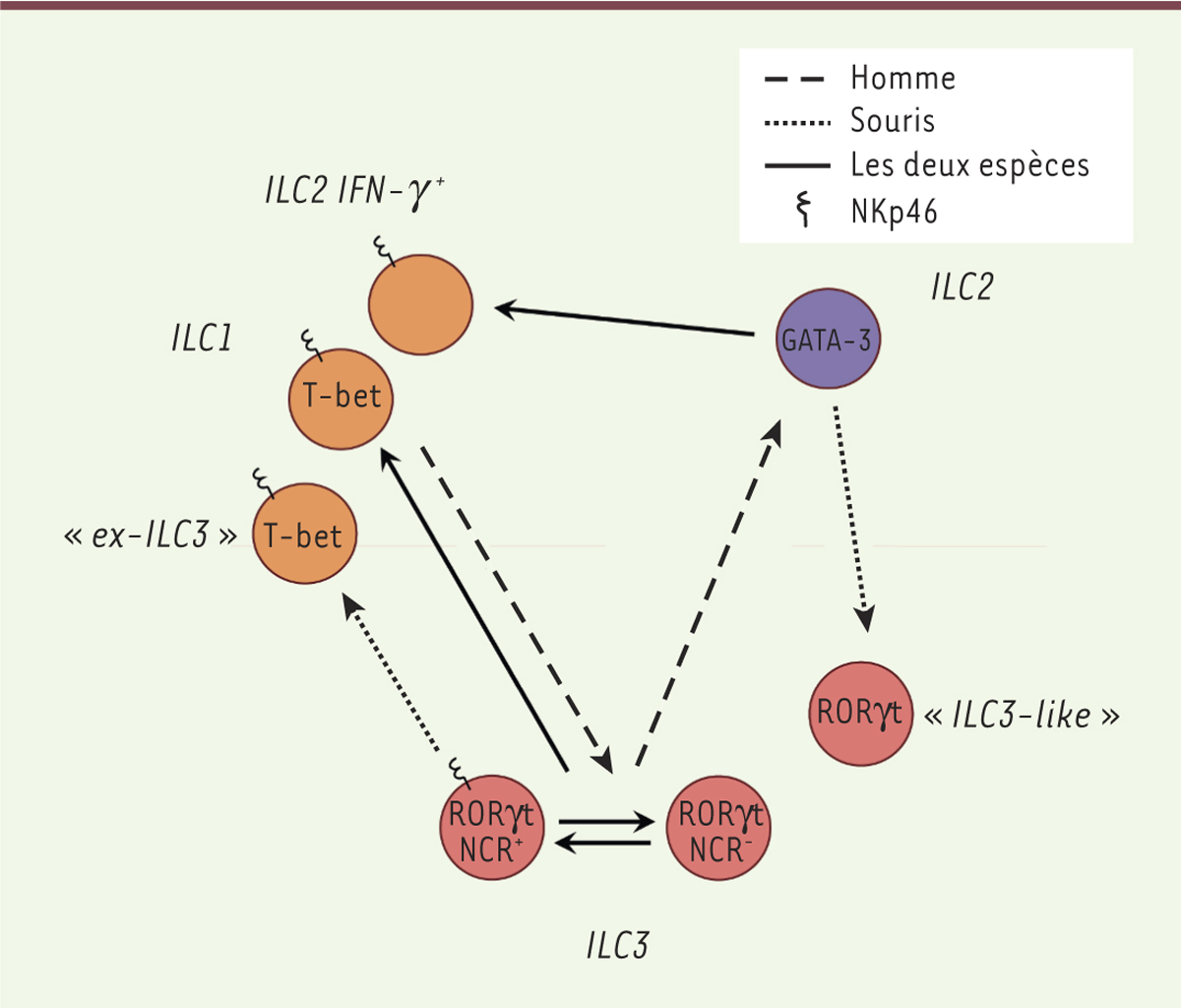
Sous l’influence de facteurs environnementaux, le phénotype des ILC peut être modifié. Elles peuvent en effet exprimer en fonction de leur environnement, des marqueurs et des cytokines qui ne sont pas caractéristiques de leur groupe mais d’un autre groupe d’ILC. Il existe donc une plasticité développementale et fonctionnelle des différentes populations d’ILC que l’on observe pour tous les groupes d’ILC, à la fois in vitro et in vivo, chez l’homme et dans les modèles murins (Figure 1).
 | Figure 1.
Représentation schématique de la plasticité entre les différents groupes d’ILC. Les pointillés longs représentent ce qui a été démontré chez l’homme ; les pointillés courts, ce qui a été établi chez la souris ; et les traits pleins ce qui a été montré dans les deux espèces. |
Transition ILC1-ILC2 Chez la souris, sous l’influence de l’IL-1β et de l’IL-12, les ILC2 peuvent acquérir in vitro et in vivo les marqueurs (expression de T-bet) et les fonctions (production d’IFN-γ) qui sont caractéristiques des ILC1. Il en est de même pour les ILC2 humaines cultivées en présence d’IL-12 [ 15]. Chez l’homme, l’inflammation induite par le virus de la grippe, ou des pathologies comme la broncho-pneumopathie chronique obstructive (BPCO), est associée à l’émergence dans les poumons d’ILC1, productrices d’IFN-γ, qui proviennent directement de la conversion des ILC2 résidentes [ 16]. La plasticité des ILC2 expliquerait ainsi, au moins partiellement, l’expansion locale des ILC1 dans les poumons en contexte inflammatoire. Transition ILC1-ILC3 Il existe une plasticité entre les ILC1 et les ILC3 chez l’homme et chez la souris [ 15, 17]. En effet, les ILC3 humaines peuvent, in vitro et in vivo, devenir des ILC1 exprimant CD127 (la chaîne α du récepteur de l’IL-7), et inversement. In vitro, cette conversion des ILC3 en ILC1 CD127 + peut être obtenue sous l’influence d’IL-12 et d’IL-15 sécrétées par les cellules dendritiques conventionnelles (cDC) et les monocytes. À l’inverse l’IL-2, l’IL-23 et l’IL-1β, sécrétées par les DC exprimant CD103 (intégrine aEb7), permettent la différenciation des ILC1 CD127 + en ILC3 [ 15]. Dans l’intestin, l’augmentation de la proportion d’ILC1, pouvant provenir des ILC3, a été observée chez la souris après induction de colites avec du dextran sulfate sodium (DSS) 1, et chez des patients atteints de la maladie de Crohn 2, [ 17]. La plasticité des ILC3 a également été montrée dans des expériences de transferts de cellules, chez la souris, à l’état basal. Des ILC3 NCR - injectées dans une souris hôte peuvent en effet acquérir l’expression de NKp46 et perdre celle de RORγt, pour devenir des cellules, appelées « ex-ILC3 », qui ont les caractéristiques des ILC1 [ 12]. L’expression de RORγt semble être inhibée par l’IL-12 et l’IL-15, ce qui favoriserait la conversion ILC3/ILC1. L’IL-17 et le microbiote intestinal semblent au contraire favoriser le maintien des ILC3 et empêcher leur conversion [ 12]. Transition ILC2-ILC3 Cultivées avec de l’IL-2 et de l’IL-7, les ILC2 murines, dites « inflammatoires », se différencient en cellules appelées « ILC3-like » qui sont capables de sécréter de l’IL-17. In vivo, ces cellules pourraient jouer un rôle dans l’immunité anti-fongique et anti-parasitaire [ 18]. À l’inverse, les ILC3 humaines peuvent, après costimulation IL-2-TLR ( Toll like receptor)2, produire, in vitro, de l’IL-13 et de l’IL-5 qui sont des cytokines spécifiques des ILC2 [ 19]. Transition ILC3 NCR--ILC3 NCR+ Les ILC3 NCR - peuvent se différencier in vivo en ILC3 NCR + de façon dépendante du facteur de transcription T-bet [ 12, 20]. In vitro, des ILC3 NCR - de souris peuvent se différencier en ILC3 NCR +, et inversement. La voie de signalisation Notch qui a un rôle important dans le développement d’une partie des ILC3 [ 21], induit, in vitro, la transformation des ILC3 NCR - en ILC3 NCR + [ 22]. À l’inverse, le TGF-β ( transforming growth factor-beta) inhibe cette voie de différenciation des ILC3 NCR - en ILC3 NCR + [ 22]. Les ILC qui sont considérées comme des cellules différenciées peuvent donc, sous l’influence de facteurs extérieurs, modifier de façon importante leur programme de transcription génique, leur profil d’expression de molécules de surface et de cytokines. Ceci pourrait avoir une réelle importance en conditions pathologiques. En effet, chaque groupe d’ILC peut produire un ensemble de cytokines qui lui est propre. Or, l’immunité développée contre les différentes agressions dépend de la production de cytokines particulières comme l’IL-17 [18] pour les infections fongiques (par exemple à Candida albicans), ou l’IL-22 pour les infections coliques comme celles ayant pour origine Citrobacter rodentium chez la souris [23]. La plasticité des ILC pourrait donc permettre d’adapter la réponse immunitaire innée tissulaire selon le type d’infection à laquelle l’organisme est confronté. Jusqu’à présent, les études ont principalement été réalisées sur des populations cellulaires sélectionnées par un tri utilisant des marqueurs de surface qui ne sont pas entièrement spécifiques du lignage cellulaire. Des expériences de traçage génétique complémentaires pourraient donc permettre de comprendre davantage la plasticité des ILC. |
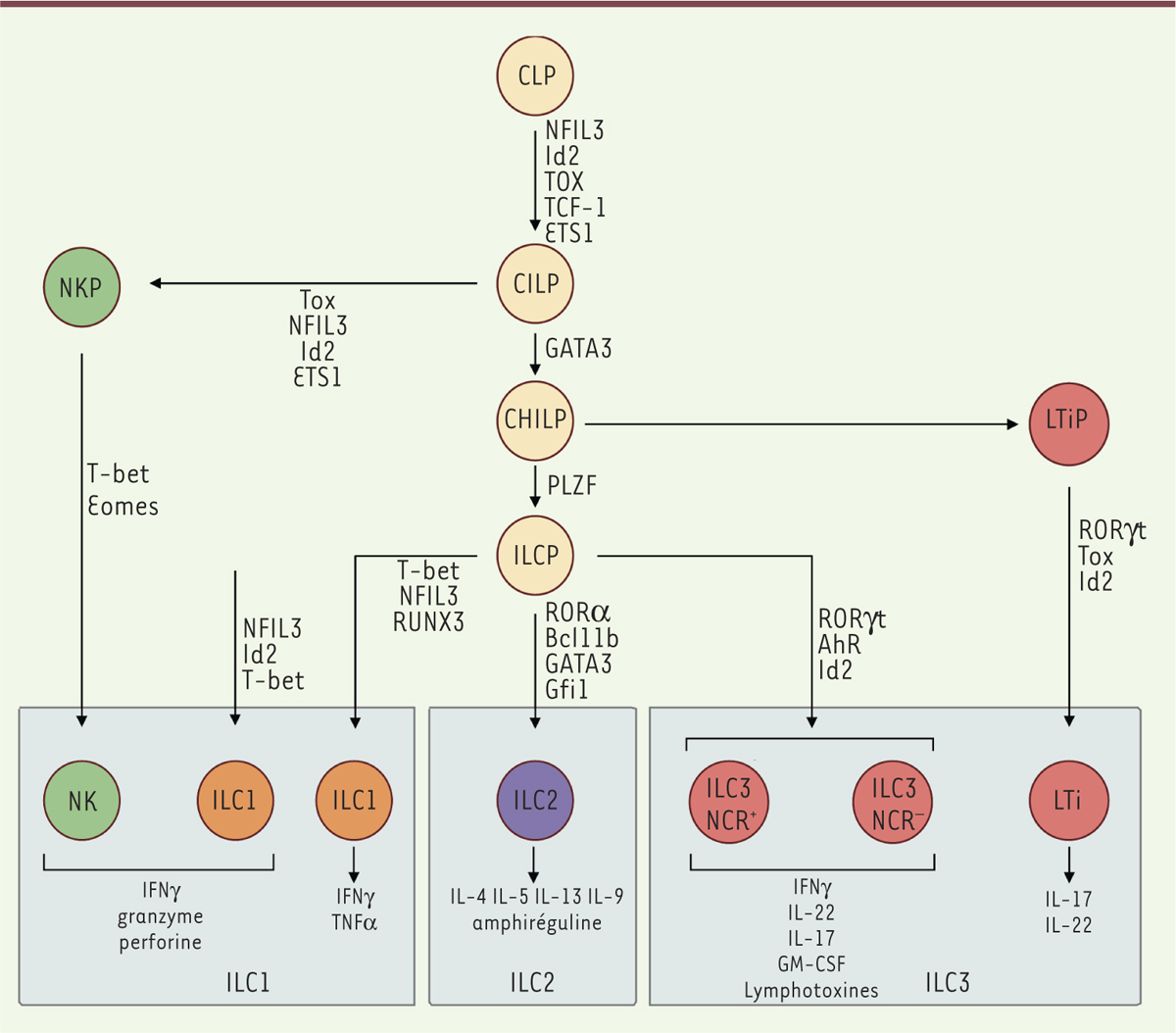
Les ILC ont pour origine un progéniteur lymphoïde commun (CLP pour common lymphoid progenitor), qui peut se différencier en tous types de lymphocytes, qu’ils soient adaptatifs ou innés. Ces CLP se caractérisent par l’expression de la sous-unité α du récepteur de l’IL-7 (CD127), du proto-oncogène c-Kit (CD117) et du récepteur de tyrosines kinases Flt3 (Fms-like tyrosine kinase 3) [15]. Le potentiel de différenciation de ces cellules se restreint ensuite, progressivement. L’engagement dans un lignage cellulaire particulier est alors déterminé notamment par les facteurs de transcription qui sont exprimés lors de la différenciation cellulaire (Figure 2).
 | Figure 2.
Développement des ILC. Les ILC se développent à partir des CILP ( common innate lymphoid progenitor), qui elles-mêmes se différencient à partir des CLP ( common lymphoid progenitor). Les CILP peuvent se différencier en précurseurs de cellules NK (NKP) ou en CHILP ( common helper innate lymphoid progenitor), qui elles-mêmes donneront les LTiP ( lymphoid tissue inducer progenitor) et les ILCP ( innate lymphoid cell precursor). Les LTiP se différencient en LTi, et les ILCP en ILC1, ILC2 ou ILC3. Chaque étape de différenciation est dépendante de l’expression des facteurs des transcription indiqués : NFIL3 ( nuclear factor il-3 induced), Id2 ( inhibitor of dna binding 2), TOX ( thymocyte selection-associated high mobility group box protein), TCF-1 ( T cell factor 1), ETS1 ( avian erythroblastosis virus E26 homolog-1), GATA3 ( GATA binding protein 3), PLZF ( promyelocytic leukaemia zinc finger), T-bet ( T-box transcription factor), Eomes ( Eomesodermin), RUNX3 ( runt-related transcription factor 3), RORα ( RAR-related orphan receptor α), Bcl11b ( B-cell lymphoma/leukemia 11B), Gfi1 ( growth factor independent 1), RORγt ( RAR-related orphan receptor γ t), AhR ( Aryl hydrocarbon receptor). Il a été montré chez l’homme que les ILC1 peuvent provenir de précurseurs autres que les ILCP mais qui restent pour l’instant inconnus [ 33]. Il est indiqué, pour chaque population d’ILC, les principales molécules effectrices qui peuvent être produites après activation. |
Les CLP sont les précurseurs de deux populations qui ont perdu la capacité de se différencier en lymphocytes adaptatifs : les EILP (early innate lymphoid progenitors) et les CILP (common innate lymphoid precursors), aussi appelés αLP (α-lymphoid precursor) [24]. Les CILP se distinguent de leurs précurseurs par l’absence d’expression de Flt3 et la présence à leur membrane de l’intégrine α4β7 et du récepteur de chimiokine CXCR6 (C-X-C motif chemokine receptor 6) [15]. Leur génération, à partir des CLP, repose sur l’expression de facteurs de transcription spécifiques, comme Nfil3 (nuclear factor IL-3 induced), Id2 (inhibitor of DNA binding 2), Tox (thymocyte selection-associated high mobility group box protein), TCF-1 (T cell factor 1) et ETS1 (avian erythroblastosis virus E26 homolog-1) (Figure 2) [15]. Les EILP qui ne présentent pas la sous-unité α du récepteur à l’IL-7 (CD127) à leur membrane, expriment les ARN messagers de Nfil3 et Id2. Déterminer si les EILP représentent une voie de différenciation des ILC indépendante de l’IL-7 ou si la perte transitoire de l’expression de CD127 permet la transition à des progéniteurs ILC plus matures reste à déterminer [24]. Les CILP sont à l’origine d’un premier embranchement dans la différenciation des ILC. Ils génèrent les précurseurs des cellules NK et, via l’expression du facteur de transcription GATA3, ceux appelés CHILP (common helper innate lymphoid progenitor) qui expriment l’intégrine α4β7 et pourront se différencier en tous types d’ILC auxiliaires [25]. À partir des cellules CHILP, un nouvel embranchement sépare le lignage des LTi de celui des autres ILC, les ILCP (ILC precursor) qui commencent à exprimer le facteur de transcription PLZF (promyelocytic leukaemia zinc finger) [26]. Contrairement aux CHILP, les ILCP ne se différencient plus en LTi [26]. C’est en fait à partir des ILCP, qui arborent le phénotype α4β7+ CXCR6- et expriment la protéine de surface PD1 (programmed cell death 1), que vont se différencier les ILC auxiliaires [27]. Cette différenciation repose sur l’expression différentielle, respectivement pour les ILC1, 2 et 3, des facteurs de transcription T-bet, NFIL3 et RUNX3 (runt-related transcription factor 3), RORα, Bcl11b (B-cell lymphoma/leukemia 11B), Gfi1 (growth factor independent 1) et GATA3 ou RORγt, Ahr (aryl hydrocarbon receptor) et Id2 [15]. L’utilisation de souris parabiotes a montré que les ILC, à l’exception des cellules NK, sont des cellules résidentes des tissus [28]. L’environnement tissulaire des cellules influence leur différenciation, comme en témoignent les variations phénotypiques observées selon les tissus où elles sont localisées (Tableau I). Toutefois, ces différences de phénotypes ne sont pas toujours associées à des différences fonctionnelles. De récentes analyses de transcriptomique et d’épigénétique réalisées sur des ILC de la lamina propria de l’intestin grêle ont révélé un grand nombre de sous-populations différentes dont les spécificités biologiques ne sont pas encore définies [29].
Tableau I.
|
|
Souris
|
|
|
Homme
|
|
|
Groupe 1
|
Groupe 2
|
Groupe 3
|
|
|
Groupe 1
|
Groupe 2
|
Groupe 3
|
|
|
NK
|
ILC1
|
ILC2
|
LTi
|
NCR
-
ILC3
|
NCR
+
ILC3
|
|
|
NK
|
CD127
+
ILC1
|
ILC2
|
LTi
|
NKp44
−
ILC3
|
NKp44
+
ILC3
|
|
Marqueurs de surface
|
CD45 |
+ |
+ |
+ |
int |
+ |
+ |
Marqueurs de surface
|
CD45 |
+ |
+ |
++ |
int |
+ |
+ |
| CD127 (IL-7Ra) |
*1
|
*2
|
+ |
++ |
F |
F |
CD127 (IL-7Ra) |
- |
*5
|
+ |
+ |
+ |
+ |
| CD161 (NK1.1) |
+ |
+ |
- |
- |
- |
-/+ |
CD161 (NK1.1) |
+/- |
+ |
+ |
+/- |
+ |
+ |
| ST2 (IL-33R) |
- |
n.d |
+ |
n.d |
n.d |
n.d |
ST2 (IL-33R) |
+/- |
- |
+ |
n.d |
n.d |
- |
| CD278 (ICOS) |
F |
n.d |
++ |
n.d |
F |
F |
CD278 (ICOS) |
- |
n.d |
+ |
n.d |
n.d |
+ |
| IL-17Rβ (IL25R) |
- |
n.d |
+ |
- |
- |
- |
IL-17Rβ (IL25R) |
- |
- |
+ |
- |
n.d |
- |
| CD294 (CRTH2) |
- |
n.d |
+ |
n.d |
n.d |
n.d |
CD294 (CRTH2) |
- |
- |
+ |
- |
- |
- |
| KLRG1 |
++ |
- |
+ |
- |
- |
- |
KLRG1 |
+ |
+ |
+ |
n.d |
n.d |
n.d |
| CD117 (c-kit) |
- |
+/- |
+/- |
++ |
F |
F |
CD117 (c-kit) |
-/F |
- |
+/- |
+ |
+ |
+ |
| CD69 |
*3
|
+ |
n.d |
n.d |
n.d |
n.d |
CD69 |
F |
+/- |
n.d |
n.d |
n.d |
n.d |
| CD254 (RANKL) |
n.d |
n.d |
n.d |
+ |
+ |
+ |
CD254 (RANKL) |
- |
n.d |
n.d |
+ |
+ |
+ |
| CD196 (CCR6) |
- |
n.d |
- |
+ |
+/- |
- |
CD196 (CCR6) |
- |
+/- |
+/- |
+ |
+/- |
+/- |
| CD335 (NKp46) |
+ |
+ |
- |
- |
- |
+ |
CD335 (NKp46) |
+ |
- |
- |
- |
-/F |
F/+ |
| CD25 (IL-2Rα) |
*4
|
-/F |
+ |
+/- |
+/- |
+/- |
CD25 (IL-2Rα) |
+/- |
F |
+ |
F |
+/- |
-/F |
| MHC-II |
- |
- |
+ |
+ |
+ |
- |
MHC-II |
+/- |
n.d |
+/- |
n.d |
n.d |
+/- |
| IL23R |
- |
- |
n.d |
+ |
+ |
+ |
IL23R |
+/- |
+/- |
-/F |
+ |
+ |
+ |
| IL1Rβ |
- |
+ |
n.d |
+ |
+ |
+ |
IL1R |
+/- |
+ |
+ |
+ |
+ |
+ |
| CD122 (IL-2Rβ et/ou IL15R) |
+ |
+ |
F |
- |
- |
- |
CD122 (IL-2Rβ et/ou IL15R) |
+ |
n.d |
n.d |
-/F |
F |
F |
| CD314 (NKG2D) |
+ |
n.d |
- |
- |
- |
+ |
CD314 (NKG2D) |
+ |
n.d |
n.d |
- |
-/F |
-/F |
| KIR (Ly49) |
+/- |
+/- |
- |
- |
- |
- |
KIR (Ly49) |
+/- |
- |
- |
- |
- |
- |
| CD94 |
+/- |
n.d |
+/- |
n.d |
- |
+/- |
CD94 |
+/- |
- |
- |
- |
- |
- |
| Perforin |
+ |
F |
- |
- |
- |
- |
Perforin |
+ |
- |
- |
- |
- |
- |
| CD253 (TRAIL) |
- |
+ |
n.d |
n.d |
n.d |
n.d |
IL12Rβ |
+ |
+ |
- |
- |
- |
+/- |
| Sca-1 (Ly6a) |
*4
|
+ |
+ |
- |
n.d |
+ |
CD194 (CCR4) |
n.d |
n.d |
+ |
n.d |
n.d |
n.d |
| CD49d (Integrin α4β7) |
n.d |
n.d |
- |
n.d |
+ |
+ |
CD56 |
+ |
- |
- |
-/F |
+/- |
+/- |
| CD49a (Integrin α1β1) |
*1
|
+ |
n.d |
n.d |
n.d |
n.d |
CD183 (CXCR3) |
n.d |
+ |
n.d |
n.d |
n.d |
n.d |
| CD90 (Thy1) |
+/- |
+ |
+ |
+ |
+ |
+ |
CD337 (NKp30) |
+ |
+ |
+ |
+/- |
+/- |
+/- |
| CD160 |
*6
|
+ |
n.d |
n.d |
n.d |
n.d |
CD336 (NKp44) |
*4
|
- |
- |
- |
- |
+ |
| CD103 |
*7
|
- |
n.d |
n.d |
n.d |
n.d |
CD16 |
+/- |
- |
- |
- |
- |
- |
|
|
Facteurs de transcription
|
Tbet |
+ |
+ |
- |
- |
+/- |
+ |
Facteurs de transcription
|
Tbet |
+ |
+ |
- |
- |
- |
- |
| Eomes |
+ |
- |
- |
- |
- |
- |
Eomes |
+ |
- |
- |
- |
- |
- |
| RORγt |
- |
- |
- |
+ |
+ |
+ |
RORγT |
- |
-/F |
-/F |
+ |
+ |
+ |
| GATA3 |
-/F |
-/F |
+ |
-/F |
-/F |
-/F |
GATA3 |
-/F |
-/F |
+ |
-/F |
-/F |
-/F |
| AhR |
- |
n.d |
n.d |
+ |
+ |
+ |
AhR |
-/F |
F |
+ |
+ |
+ |
+ |
| RORα |
n.d |
n.d |
+ |
n.d |
n.d |
n.d |
|
|
|
|
|
|
|
|
|
| PLZF |
- |
+ |
+ |
- |
+ |
n.d |
|
|
|
|
|
|
|
|
|
|
|
|
|
Principaux marqueurs caractéristiques des différents groupes d’ILC murins et humains. Chaque groupe d’ILC est composé de plusieurs sous-populations plus ou moins bien définies. L’expression de certains marqueurs varie en fonction des organes, ce qui peut rendre l’identification des ILC difficile, notamment entre les cellules NK (natural killer) et les ILC1. Int : expression intermédiaire, F : expression faible, n.d : non déterminé. |
Chez la souris, tous les progéniteurs des ILC sont présents dans le foie fœtal (les LTi migrent vers la périphérie dans la période entre E12,5 et E13,5 de l’embryogénèse) ainsi que dans la moelle osseuse des individus adultes [15]. Toutefois, il semblerait que chez l’adulte, des précurseurs périphériques existent. En effet, des précurseurs de cellules NK ont été trouvés en dehors de la moelle osseuse chez l’homme comme chez la souris [30] et des précurseurs des ILC3 ont été identifiés dans les amygdales et le sang périphérique [57] chez l’homme [31]. Le rôle des CHILP de la moelle osseuse chez l’adulte reste à définir. Ces progéniteurs pourraient participer à la reconstitution des populations d’ILC après des infections qui auraient éliminé les ILC résidentes d’un organe [15]. Les ILC auxiliaires auraient une longue demi-vie et seraient reconstituées par auto-renouvellement ou par des précurseurs périphériques résidant au sein du tissu [15]. Cette hypothèse est supportée par l’observation de l’implication, au moins partielle, de précurseurs ou de cellules matures provenant de la moelle osseuse au cours d’infections par Nippostrongylus brasiliensis par exemple [28]. Deux types de développement des ILC spatialement et temporellement différents pourraient donc exister avec une première vague de colonisation des tissus au stade embryonnaire par des précurseurs d’ILC médullaires et une seconde, en cas de stress, depuis des précurseurs périphériques ou provenant de la moelle osseuse [28]. Il reste beaucoup à découvrir sur le développement des ILC. Notamment, comment une population lymphocytaire intestinale et intra-épithéliale n’exprimant pas de récepteur de l’antigène se développe chez la souris et chez l’homme indépendamment du facteur de transcription Id2 qui est pourtant essentiel à la différenciation des ILC [32]. De plus, chez l’homme, une population intra-épithéliale d’ILC1, qui exprime Eomes, T-bet et CD103, reste, encore aujourd’hui, sans précurseur identifié [33]. |
Fonctions immunitaires des ILC Les ILC, localisées au niveau des tissus, sont en contact avec le milieu extérieur et sont capables de produire des cytokines rapidement. Ces cellules font ainsi partie des premiers effecteurs de la réponse immunitaire primaire [23]. Les ILC1 Les ILC1, activées par l’IL-12, l’IL-15 et l’IL-18 après infection des cellules de l’hôte par des virus ou des bactéries, produisent les cytokines effectrices, IFN-γ et TNF-α ( tumor necrosis factor alpha), qui sont à l’origine de l’activation des macrophages et de la production de radicaux oxygénés. Dans l’intestin, les ILC1 sont la source innée prédominante d’IFN-γ en réponse à l’IL-12 ou, par exemple, à une infection intestinale par le parasite Toxoplasma gondii [ 25]. Elles participent en effet, avec les lymphocytes T qui produisent de l’IFN-γ, au contrôle de la réplication du parasite et assurent le recrutement des monocytes inflammatoires [ 25, 34]. Les souris Rag1-/-Tbet-/- comme les souris Rag1-/-Ifng-/- sont aussi plus sensibles à l’infection par Clostridium difficile que les souris uniquement invalidées pour le gène Rag1. L’IFN-γ, produit par les ILC1, participe donc à l’élimination de C. difficile, possiblement en limitant sa dissémination dans le foie et/ou la circulation sanguine [ 35]. La production d’IFN-γ par les ILC1 est également nécessaire pour la production du mucus. Elles participent donc aussi à la protection des barrières intestinales contre les infections par les bactéries [ 20]. Les ILC1 qui sont impliquées dans ces processus présentent toutefois un phénotype particulier (RORγt + CCR6 - Tbet +) proche des « ex-ILC3 » et résultant de la plasticité des ILC [ 20]. Les ILC1 ont été impliquées dans la surveillance immunitaire de certaines tumeurs du sein ou de la prostate chez la souris [36]. En effet, des ILC1, distinctes des cellules NK sur le plan transcriptionnel (et phénotypiquement différentes des ILC1 conventionnelles), prolifèrent au niveau des lésions précancéreuses et semblent avoir une activité cytolytique qui contrôle la croissance de la tumeur [36]. La définition exacte des ILC1, qui partagent certaines caractéristiques des lymphocytes T, reste floue et uniquement fondée, en cytométrie en flux, sur l’absence de marqueurs spécifiques aux lignages ILC2 et 3 [37]. Récemment, une étude réalisée chez l’homme en cytométrie de masse a d’ailleurs rapporté l’absence de CD127 à la surface des ILC1 tissulaires, les seules ILC1 détectables étant situées au niveau intra-épithélial, produisant de l’IFN-γ, du granzyme B et de la perforine et exprimant les facteurs de transcription et de nombreux marqueurs de surface spécifiques des cellules NK [58]. Les ILC2 Les ILC2 participent à la régulation du développement des « tuft cells », des cellules épithéliales de l’intestin qui détectent les parasites et produisent de l’IL-25 [ 23]. Activées par l’IL-25, l’IL-33 et la cytokine TSLP ( thymic stromal lymphopoietin), les ILC2 interviennent après infection par des parasites [ 1]. Ainsi, au cours de l’infection par Nippostrongylus brasiliensis, elles représentent la source précoce prédominante d’IL-13 [ 7]. L’IL-5 et l’IL-13 qu’elles produisent induisent la vasodilatation, la production de matrice extracellulaire et de mucus et l’activation des macrophages de type 2 (M2) qui permettent l’élimination des parasites [ 23]. Au niveau pulmonaire, les ILC2 provoquent une inflammation d’origine éosinophilique induite contre Strongyloides venezuelensis [ 23]. Les ILC2 sont aussi source d’amphiréguline, une protéine qui participe au maintien de la fonction pulmonaire après une infection par le virus de la grippe [ 38]. Enfin, des ILC2 « inflammatoires », qui produisent de l’IL-17, participent à la réponse immunitaire lors d’une infection par la levure Candida albicans [ 18]. Les ILC3 Les ILC3 sont activées par l’IL-23 et l’IL-1β produites par les cellules dendritiques lors d’une infection par des microbes extracellulaires. Elles sécrètent de l’IL-17 et de l’IL-22 qui favorisent le recrutement des neutrophiles et la libération de peptides antimicrobiens par les cellules épithéliales [ 23]. L’IL-22 permet de lutter contre les bactéries symbiotiques qui sont capables d’induire une inflammation systémique à l’origine de pathologies intestinales chroniques [ 39]. L’IL-22 produite par les ILC3 entraîne également la fucosylation des cellules épithéliales, ce qui les protège de l’infection par Salmonella typhimurium [ 23]. Cette cytokine est aussi nécessaire à la résistance contre Citrobacter rodentium [ 11]. Il est cependant difficile de prouver que ce sont bien les ILC3 qui assurent cette protection impliquant l’IL-22. En effet, en présence de lymphocytes T, les ILC3 NCR + sont redondantes pour la protection contre C. rodentium [ 40, 41]. Chez l’homme, l’IL-22 protège les cellules souches intestinales des lésions inflammatoires qui surviennent après une greffe de cellules souches hématopoïétiques, protégeant ainsi l’organisme de la survenue d’une réaction du greffon contre l’hôte (ou, en anglais, GVHD pour graft versus host disease) [42]. Dans les poumons, cette cytokine participe à l’élimination de Streptococcus pneumoniae et, en synergie avec l’IFN-γ produit par les cellules épithéliales, elle protège l’organisme lors d’infections par les rotavirus [23]. L’IL-22 n’est pas la seule cytokine produite par les ILC3 pouvant avoir un rôle protecteur. Ces cellules sécrètent également des lymphotoxines qui induisent la production d’Ig(immunoglobulines)A par les lymphocytes B de l’intestin [43], et, dans un modèle murin de candidose oropharyngée, elles représentent la source initiale d’IL-17 qui permet le contrôle de l’infection fongique [23]. Certaines ILC3 qui expriment le complexe majeur d’histocompatibilité de classe II (CMH II) pourraient limiter l’activation de lymphocytes T CD4+ de la lamina propria spécifiques du microbiote lors d’une infection intestinale. En effet, l’inactivation des gènes codant les molécules du CMH II dans ces cellules, a pour effet de rendre les animaux plus susceptibles à la colite ayant pour origine l’activation des lymphocytes T [44]. Enfin, les LTi, qui font partie des ILC de type 3, sont essentielles à la formation des tissus lymphoïdes au cours de l’embryogenèse [1]. Les ILC interviennent donc dans la mise en place des réponses immunitaires précoces. Toutefois, certaines ILC ont également un rôle non immunitaire, comme les ILC2 qui produisent des peptides méthionine-enképhaline intervenant directement sur les adipocytes et favorisant le brunissement du tissu adipeux blanc [45]. |
Implication des ILC en immunopathologie Les ILC1 Les patients atteints de la maladie de Crohn ou d’une broncho-pneumopathie chronique obstructive (BPCO) présentent respectivement une fréquence plus importante d’ILC1 dans les intestins et les poumons [ 17, 33]. Bien que les ILC1 puissent protéger l’organisme de certaines colites, l’IFN-γ qu’elles produisent participe également au développement de celles induites par Helicobacter hepaticus [46]. Dans un modèle de colite induite par l’injection d’anticorps anti-CD40 chez des souris Rag-/-, leur déplétion provoque une diminution des infiltrats de cellules inflammatoires et des dommages de l’épithélium du côlon proximal [33]. Toutefois, la plasticité des ILC pose ici encore la question de l’origine de l’IFN-γ. Il pourrait être produit par des ILC1 ou des « ex-ILC3 ». Les ILC2 Les ILC2 peuvent exprimer CD40L (le ligand du CD40, un corécepteur participant à l’activation T-B) en réponse à l’IL-25 et l’IL-33 et ainsi stimuler la production d’IgE associée notamment aux allergies alimentaires et aux pathologies atopiques (rhinite allergique, asthme et dermatite atopique) [ 47]. Dans des modèles murins d’allergies alimentaires, où l’IL-4 sécrétée par les ILC2 altère l’activation des lymphocytes T régulateurs (Treg) et induit celle des mastocytes, un enrichissement en ILC2 est observé [ 48]. Cet enrichissement est aussi observé chez les patients atteints de rhinosinusite chronique [ 1] et dans les lésions inflammatoires de dermatite atopique, chez l’homme comme chez la souris. Leur déplétion atténue les symptômes cutanés chez la souris [ 49]. Dans les poumons, les ILC2 sont à l’origine de l’inflammation allergique provoquée, dans le modèle murin, par l’administration intranasale de l’allergène papaïne, et de l’hyperréactivité pulmonaire que l’on observe après une infection par le virus de la grippe [ 23]. Le nombre d’ILC2 est également augmenté dans le foie de souris présentant une fibrose hépatique induite par l’IL-33 et, dans les poumons, lors d’une fibrose pulmonaire provoquée par la bléomycine [50]. Leur déplétion est corrélée à une baisse de la sensibilité à la fibrose hépatique et, inversement, un transfert adoptif d’ILC2 peut accroître l’inflammation et la fibrose pulmonaire [50]. Les ILC3 Comme les ILC1, les ILC3 sont impliquées dans la survenue de maladies inflammatoires chroniques intestinales ou de colites infectieuses. Chez l’homme, une étude d’association pangénomique a en effet identifié le gène il23r ( IL-23 receptor), essentiellement exprimé par les lymphocytes Th17 et les ILC3, comme un gène de prédisposition aux maladies inflammatoires chroniques de l’intestin [ 51]. Chez la souris, les ILC3 ont été impliquées dans le développement de colites induites par Helicobacter hepaticus via leur capacité à produire de l’IL-17 et de l’IFN-γ [ 23]. Un rôle pathogénique des ILC3 a également été identifié dans des modèles de colites induites par Salmonella enterica [ 20], par Helicobacter typhlonius [ 23] ou via CD40 [ 12]. Chez l’homme, une plus forte production d’IL-17 par les ILC3 a été observée chez les patients atteints de la maladie de Crohn [ 52] et chez les souris Rag1 -/-, les ILC3 NCR + sont suffisantes pour promouvoir l’accumulation des monocytes inflammatoires lors d’une colite expérimentale [ 41].
Les ILC3 régulent également l’asthme associé à l’obésité [ 23] par la production d’IL-17 qui contrôle l’hyperréactivité pulmonaire induite par un régime alimentaire riche en matières grasses [ 53]. Les ILC3 NKp44 + sont également enrichies dans le sang et les lésions cutanées chez des patients atteints de psoriasis où l’accumulation d’IL-22 induit la prolifération accrue des kératinocytes. Les ILC3 produisant de l’IL-22 pourraient donc être directement impliquées dans la physiopathologie du psoriasis, mais leur rôle reste à définir [ 54]. |
Conclusion et perspectives En moins de 10 ans, de nombreux travaux ont permis de mieux caractériser les populations d’ILC et d’identifier certaines de leurs fonctions. Les études menées chez l’homme et la souris ont décrit leur rôle dans de nombreuses pathologies inflammatoires. L’absence de gènes qui soient spécifiquement exprimés par les ILC et le manque de modèles expérimentaux permettant leur déplétion sélective, ont été à l’origine d’interprétations devant être révisitées quant à leurs implications. Ceci est confirmé, chez la souris, par la mise en évidence d’un rôle partiellement redondant des ILC3 NCR+ dans la phase initiale de l’infection par Citrobacter rodentium [40, 41]. Par ailleurs, l’absence de pathologie particulière chez des patients ayant reconstitué les compartiments B et T mais très partiellement celui des ILC, après une greffe de cellules souches hématopoïétiques sans myéloablation préalable, semble également indiquer l’existence d’une redondance des ILC lorsque les lymphocytes B et T sont présents et dans les conditions d’hygiène et de médecine moderne [37]. À l’exception des pathologies impliquant les granulocytes ou le complément, les patients atteints de déficits immunitaires d’origine monogénique et congénitaux impliquant le système immunitaire inné, présentent une susceptibilité restreinte à certains types d’infections et qui s’atténue avec l’âge grâce au développement de l’immunité adaptative [55]. La redondance pourrait donc être un principe d’organisation général des mécanismes immunitaires innés, assurant la robustesse des défenses immunitaires. Redondance ne signifie pas inutilité. Les ILC pourraient, en effet, s’avérer très importantes chez des patients atteints de diverses pathologies génétiques ou acquises compromettant l’immunité adaptative (dont les patients sous traitements immunosuppresseurs) ou lors de la vie fœtale et la petite enfance, avant que les systèmes adaptatifs ne se mettent en place de manière optimale. On retrouve d’ailleurs chez l’homme un plus grand nombre d’ILC dans les tissus fœtaux et le sang de cordon que chez l’adulte [37]. La frontière entre redondance et complémentarité reste cependant à préciser, au regard des observations soulignant les interactions entre les ILC et l’immunité adaptative. Ainsi, chez la souris, lors d’une infection par le ver ankylostome, une coopération entre les ILC2 et les lymphocytes T assure le maintien des macrophages de type M2 dans l’immunité pulmonaire [56]. Les ILC semblent également impliquées de manière non-redondante dans de nombreuses pathologies inflammatoires, devenant, par là-même, d’intéressantes cibles thérapeutiques potentielles. |
E. Vivier déclare : avoir une participation financière dans le capital de l’entreprise Innate Pharma, avoir des liens durables avec l’entreprise Innate Pharma, participer à des interventions ponctuelles pour l’entreprise Innate Pharma.
A. Crinier, C. Viant, M. Girard-Madoux déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Cherrier M. Les cellules lymphoïdes innées : De nouveaux acteurs de la réponse immune mucosale . Med Sci (Paris). 2014; ; 30 : :280.–288. 2.
Addison W. Experimental and Practical Researches on the Blood: Second Series . Provincial medical journal and retrospect of the medical sciences. 1843; ; 6 : :444.–445. 3.
Herberman RB, Nunn ME, Holden HT, Lavrin DH Natural cytotoxic reactivity of mouse lymphoid cells against syngeneic and allogeneic tumors. II. Characterization of effector cells . Int J Cancer. 1975; ; 16 : :230.–239. 4.
Kiessling R, Klein E, Pross H, Wigzell H “Natural” killer cells in the mouse. II. Cytotoxic cells with specificity for mouse Moloney leukemia cells. Characteristics of the killer cell . Eur J Immunol. 1975; ; 5 : :117.–121. 5.
Mebius RE, Rennert P, Weissman IL Developing lymph nodes collect CD4+CD3- LTbeta+ cells that can differentiate to APC, NK cells, and follicular cells but not T or B cells . Immunity. 1997; ; 7 : :493.–504. 6.
Cella M, Fuchs A, Vermi W, et al. A human natural killer cell subset provides an innate source of IL-22 for mucosal immunity . Nature. 2009; ; 457 : :722.–725. 7.
Moro K, Yamada T, Tanabe M, et al. Innate production of T(H)2 cytokines by adipose tissue-associated c-Kit(+)Sca-1(+) lymphoid cells . Nature. 2010; ; 463 : :540.–544. 8.
Narni-Mancinelli E, Chaix J, Fenis A, et al. Fate mapping analysis of lymphoid cells expressing the NKp46 cell surface receptor . Proc Natl Acad Sci U S A. 2011; ; 108 : :18324.–18329. 9.
Price AE, Liang HE, Sullivan BM, et al. Systemically dispersed innate IL-13-expressing cells in type 2 immunity . Proc Natl Acad Sci U S A. 2010; ; 107 : :11489.–11494. 10.
Satoh-Takayama N, Lesjean-Pottier S, Vieira P, et al. IL-7 and IL-15 independently program the differentiation of intestinal CD3-NKp46+ cell subsets from Id2-dependent precursors . J Exp Med. 2010; ; 207 : :273.–280. 11.
Satoh-Takayama N, Vosshenrich CAJ, Lesjean-Pottier S, et al. Microbial Flora Drives Interleukin 22 Production in Intestinal NKp46+ Cells that Provide Innate Mucosal Immune Defense . Immunity. 2008; ; 29 : :958.–970. 12.
Vonarbourg C, Mortha A, Bui VL, et al. Regulated expression of nuclear receptor RORgammat confers distinct functional fates to NK cell receptor-expressing RORgammat(+) innate lymphocytes . Immunity. 2010; ; 33 : :736.–751. 13.
Spits H, Artis D, Colonna M, et al. Innate lymphoid cells–a proposal for uniform nomenclature . Nat Rev Immunol. 2013; ; 13 : :145.–149. 14.
Cortez VS, Fuchs A, Cella M, et al. Cutting edge: Salivary gland NK cells develop independently of Nfil3 in steady-state . J Immunol. 2014; ; 192 : :4487.–4491. 15.
Gronke K, Kofoed-Nielsen M, Diefenbach A Innate lymphoid cells, precursors and plasticity . Immunol Lett. 2016; ; 179 : :9.–18. 16.
Belz GT ILC2s masquerade as ILC1s to drive chronic disease . Nat Immunol. 2016; ; 17 : :611.–612. 17.
Bernink JH, Peters CP, Munneke M, et al. Human type 1 innate lymphoid cells accumulate in inflamed mucosal tissues . Nat Immunol. 2013; ; 14 : :221.–229. 18.
Huang Y, Guo L, Qiu J, et al. IL-25-responsive, lineage-negative KLRG1(hi) cells are multipotential ‘inflammatory’ type 2 innate lymphoid cells . Nat Immunol. 2015; ; 16 : :161.–169. 19.
Crellin NK, Trifari S, Kaplan CD, et al. Regulation of cytokine secretion in human CD127(+) LTi-like innate lymphoid cells by Toll-like receptor 2 . Immunity. 2010; ; 33 : :752.–764. 20.
Klose CS, Kiss EA, Schwierzeck V, et al. A T-bet gradient controls the fate and function of CCR6-RORgammat+ innate lymphoid cells . Nature. 2013; ; 494 : :261.–265. 21.
Chea S, Perchet T, Petit M, et al. Notch signaling in group 3 innate lymphoid cells modulates their plasticity . Sci Signal. 2016;; 9 : :ra45.. 22.
Viant C, Rankin LC, Girard-Madoux MJ, et al. . Transforming growth factor-beta and Notch ligands act as opposing environmental cues in regulating the plasticity of type 3 innate lymphoid cells . Sci Signal. 2016;; 9 : :ra46.. 23.
Klose CSN, Artis D Innate lymphoid cells as regulators of immunity, inflammation and tissue homeostasis . Nat Immunol. 2016; ; 17 : :765.–774. 24.
Zook EC, Kee BL Development of innate lymphoid cells . Nat Immunol. 2016; ; 17 : :775.–782. 25.
Klose Christoph SN, Flach M, Möhle L, et al. Differentiation of type 1 ILCs from a common progenitor to all helper-like innate lymphoid cell lineages . Cell. 2014; ; 157 : :340.–356. 26.
Constantinides MG, McDonald BD, Verhoef PA, Bendelac A A committed precursor to innate lymphoid cells . Nature. 2014; ; 508 : :397.–401. 27.
Seillet C, Mielke LA, Amann-Zalcenstein DB, et al. Deciphering the innate lymphoid cell transcriptional program . Cell Rep. 2016; ; 17 : :436.–447. 28.
Gasteiger G, Fan X, Dikiy S, et al. Tissue residency of innate lymphoid cells in lymphoid and nonlymphoid organs . Science. 2015; ; 350 : :981.–985. 29.
Gury-BenAri M, Thaiss CA, Serafini N, et al. The Spectrum and regulatory landscape of intestinal innate lymphoid cells are shaped by the microbiome . Cell. 2016; ; 166 : (1231–46)
:e13.. 30.
Vosshenrich CA, Ranson T, Samson SI, et al. Roles for common cytokine receptor gamma-chain-dependent cytokines in the generation, differentiation, and maturation of NK cell precursors and peripheral NK cells in vivo . J Immunol. 2005; ; 174 : :1213.–1221. 31.
Montaldo E, Teixeira-Alves LG, Glatzer T, et al. Human RORgammat(+)CD34(+) cells are lineage-specified progenitors of group 3 RORgammat(+) innate lymphoid cells . Immunity. 2014; ; 41 : :988.–1000. 32.
Ettersperger J, Montcuquet N, Malamut G, et al. Interleukin-15-dependent T-cell-like innate intraepithelial lymphocytes develop in the intestine and transform into lymphomas in celiac disease . Immunity. 2016; ; 45 : :610.–625. 33.
Fuchs A, Vermi W, Lee JS, et al. Intraepithelial type 1 innate lymphoid cells are a unique subset of cytokine responsive interferon-γ-producing cells . Immunity. 2013; ; 38 : :769.–781. 34.
Schulthess J, Meresse B, Ramiro-Puig E, et al. Interleukin-15-dependent NKp46+ innate lymphoid cells control intestinal inflammation by recruiting inflammatory monocytes . Immunity. 2012; ; 37 : :108.–121. 35.
Abt Michael C, Lewis Brittany B, Caballero S, et al. Innate immune defenses mediated by two ILC subsets are critical for protection against acute Clostridium difficile infection . Cell Host Microbe. 2015;; 18 : :27.–37. 36.
Dadi S, Chhangawala S, Whitlock Benjamin M, et al. Cancer immunosurveillance by tissue-resident innate lymphoid cells and innate-like T cells . Cell. 2016; ; 164 : :365.–377. 37.
Vely F, Barlogis V, Vallentin B, et al. Evidence of innate lymphoid cell redundancy in humans . Nat Immunol. 2016; ; 17 : :1291.–1299. 38.
Monticelli LA, Sonnenberg GF, Abt MC, et al. Innate lymphoid cells promote lung tissue homeostasis following acute influenza virus infection . Nat Immunol. 2011; ; 12 : :1045.–1054. 39.
Sonnenberg GF, Monticelli LA, Alenghat T, et al. Innate lymphoid cells promote anatomical containment of lymphoid-resident commensal bacteria . Science. 2012; ; 336 : :1321.–1325. 40.
Rankin LC, Girard-Madoux MJ, Seillet C, et al. Complementarity and redundancy of IL-22-producing innate lymphoid cells . Nat Immunol. 2016; ; 17 : :179.–186. 41.
Song C, Lee JS, Gilfillan S, et al. Unique and redundant functions of NKp46(+) ILC3s in models of intestinal inflammation . J Exp Med. 2015; ; 212 : :1869.–1882. 42.
Hanash AM, Dudakov JA, Hua G, et al. Interleukin-22 protects intestinal stem cells from immune-mediated tissue damage and regulates sensitivity to graft vs. host disease . Immunity. 2012; ; 37 : :339.–350. 43.
Kruglov AA, Grivennikov SI, Kuprash DV, et al. Nonredundant function of soluble LTα3 produced by innate lymphoid cells in intestinal homeostasis . Science. 2013; ; 342 : :1243.–1246. 44.
Hepworth MR, Monticelli LA, Fung TC, et al. Innate lymphoid cells regulate CD4+ T-cell responses to intestinal commensal bacteria . Nature. 2013; ; 498 : :113.–117. 45.
Brestoff JR, Kim BS, Saenz SA, et al. Group 2 innate lymphoid cells promote beiging of adipose and limit obesity . Nature. 2015; ; 519 : :242.–246. 46.
Buonocore S, Ahern PP, Uhlig HH, et al. Innate lymphoid cells drive IL-23 dependent innate intestinal pathology . Nature. 2010; ; 464 : :1371.–1375. 47.
Maggi L, Montaini G, Mazzoni A, et al. Human circulating group 2 innate lymphoid cells can express CD154 and promote IgE production . J Allergy Clin Immunol. 2016; ; 139 : :964.–976. 48.
Noval Rivas M, Burton OT, Oettgen HC, Chatila T. IL-4 production by group 2 innate lymphoid cells promotes food allergy by blocking regulatory T-cell function . J Allergy Clin Immunol. 2016;; 138 : :801.–11.e9. 49.
Kim BS, Siracusa MC, Saenz SA, et al. TSLP elicits IL-33–independent innate lymphoid cell responses to promote skin inflammation . Sci Transl Med. 2013;; 5 : :170ra16.–ra16. 50.
Li D, Guabiraba R, Besnard A-G, et al. IL-33 promotes ST2-dependent lung fibrosis by the induction of alternatively activated macrophages and innate lymphoid cells in mice . J Allergy Clin Immuno. 2014; ; 134 : (1422–32).:e11.. 51.
Duerr RH, Taylor KD, Brant SR, et al. A genome-wide association study identifies IL23R as an inflammatory bowel disease gene . Science. 2006; ; 314 : :1461.–1463. 52.
Geremia A, Arancibia-Cárcamo CV, Fleming MPP, et al. IL-23–responsive innate lymphoid cells are increased in inflammatory bowel disease . J Exp Med. 2011; ; 208 : :1127.–1133. 53.
Kim HY, Lee HJ, Chang Y-J, et al. Interleukin-17-producing innate lymphoid cells and the NLRP3 inflammasome facilitate obesity-associated airway hyperreactivity . Nat Med. 2014; ; 20 : :54.–61. 54.
Villanova F, Flutter B, Tosi I, et al. Characterization of innate lymphoid cells (ILC) in human skin and blood demonstrates increase of NKp44+ ILC3 in psoriasis . J Invest Dermatol. 2014; ; 134 : :984.–991. 55.
Picard C, Casanova JL, Puel A Infectious diseases in patients with IRAK-4, MyD88, NEMO, or IkappaBalpha deficiency . Clin Microbiol Rev. 2011; ; 24 : :490.–497. 56.
Bouchery T, Kyle R, Camberis M, et al. ILC2s and T cells cooperate to ensure maintenance of M2 macrophages for lung immunity against hookworms . Nat Commun. 2015; ; 6 : :6970.. 57.
Lim AI, Li Y, Lopez-Lastra S, et al. Systemic human ILC precursors provide a substrate for tissue ILC differentiation . Cell. 2017; ; 168 : :1086.–1100. 58.
Simoni Y, Fehlings M, Kløverpris HN, et al. Human innate lymphoid cell subsets possess tissue-type based heterogeneity in phenotype and frequency . Immunity. 2017; ; 46 : :148.–161. |